Bromo: reazioni, produzione e usi

Cos’è il bromo?
Il bromo è un liquido con formula chimica Br2 che possiede elevata densità, colorazione rosso scuro e forti proprietà fumanti, oltre a essere altamente corrosivo e lacrimogeno. L’odore del bromo è così pungente che può essere rilevato a un volume di 1 ppm nell’aria.
Il colore del bromo dipende dalla temperatura, con tonalità giallo-arancio a 20 K, che progrediscono verso il rosso-arancio, il rosso-marrone e infine quasi nero al suo punto di fusione. Il bromo liquido mantiene una tonalità rosso scuro, mentre i suoi vapori sono generalmente arancioni o rosso-marroni.
A. J. Balard scoprì il bromo nel 1824 mentre studiava la flora in una palude salata vicino a Montpellier, in Francia. Durante la sua ricerca, osservò un deposito di solfato di sodio che si era cristallizzato in una pentola di acqua madre derivata dal sale comune.
Mentre studiava i potenziali utilizzi dei liquidi di scarto, BALARD scoprì che la saturazione di cloro poteva produrre un nuovo liquido rosso che poteva essere distillato.
Sommario
1. Reazioni chimiche del bromo
Le robuste proprietà ossidanti del bromo sono responsabili di molte delle sue reazioni chimiche. L’affinità elettronica del bromo è intermedia tra quelle del cloro e dello iodio, così come la maggior parte delle sue altre proprietà chimiche.
Il bromo agisce come un agente ossidante moderatamente forte e viene ossidato dal cloro per produrre bromo elementare in linea con la sua posizione nella serie elettromotrice.
Il bromo viene ridotto a bromuro in acqua, con l’agente riducente che è l’acqua o il bromo rimanente. Nel primo caso si forma ossigeno, come mostrato dall’equazione:
2 Br2 + 2 H2O → 4 H+ + 4 Br– + O2 E0298 = +0,25 V
Il bromo reagisce con l’acido cianidrico per formare bromuro di cianogeno:
Br2 + HCN → BrCN + HBr
I carbonati reagiscono con il bromo, producendo sali di bromuro e bromato come risultato:
3 Br2 + 3 Na2CO3 → 5 NaBr + NaBrO3 + 3 CO2
Il bromo può ossidare l’anidride solforosa in acido solforico, come dimostrato dall’equazione:
Br2 + SO2 + 2 H2O → 2HBr + H2SO4
Il bromo reagisce con il fosforo rosso e altri composti del fosforo per produrre acido fosforico e bromuro di idrogeno, come segue:
3 Br2 + 2 P + 6 H2O → 6 HBr + 2 H3PO3
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
H3PO3 + Br2 + NaOH → NaH2PO4
Anche i composti contenenti azoto, ad esempio ammoniaca, idrazina, nitriti e azidi, subiscono l’ossidazione da parte del bromo, e l’azoto elementare è il prodotto frequente di queste reazioni.
A temperature più elevate, il bromo reagisce direttamente con l’idrogeno per produrre acido bromidrico, che è la base per la produzione commerciale di HBr utilizzando catalizzatori come carbone riscaldato e platino finemente suddiviso.
Il bromo reagisce con molti metalli per produrre bromuri, con il sodio che reagisce vigorosamente in presenza di vapore di sodio. Il potassio e il cesio reagiscono violentemente con il bromo.
Anche l’alluminio e il titanio sono altamente reattivi con il bromo, con l’alluminio che emette luce durante la reazione, mentre il magnesio, l’argento, il nichel e il piombo si ricoprono dei loro bromuri, impedendo ulteriori reazioni.
Il rivestimento protettivo del piombo lo rende un materiale utile per i contenitori che contengono bromo, così come il nichel, il tantalio, l’Hastelloy C e il Monel e altre leghe di rame.
L’umidità è un fattore chiave nella corrosione dei metalli da parte del bromo, probabilmente a causa dei prodotti di idrolisi, acidi bromidrico e ipobromoso.
A contenuti di umidità inferiori a 40 ppm, i contenitori di nichel possono essere utilizzati per il trasporto del bromo, ma il mercurio non deve essere utilizzato in strumenti e misuratori esposti al vapore di bromo.
Il bromo secco reagisce lentamente con il ferro per formare uno strato protettivo di bromuro ferrico, ma quando è bagnato, viene prodotta una miscela di bromuri di ferro idrati, che non aderisce alla superficie del ferro.
Diversi altri metalli pesanti, come rame, manganese, cromo, antimonio, cobalto, cadmio e bismuto, reagiscono con il bromo, con alcuni metalli che richiedono temperature più elevate per la reazione.
1.1. Bromurazione di alcheni e alchini
Il bromo è in grado di aggiungersi facilmente ai composti insaturi. Queste reazioni vengono in genere eseguite a basse temperature per evitare reazioni collaterali di sostituzione. Sebbene di solito non sia richiesto un catalizzatore, alte temperature o radiazioni ultraviolette possono accelerare la reazione.
Diversi importanti prodotti commerciali possono essere ottenuti tramite bromurazione di composti insaturi, tra cui bromuro di etilene, tetrabromuro di acetilene, 2,3-dibromopropanolo, esabromociclodecano e tetrabromobisfenolo A bis(2,3-dibromopropiletere).
1.2. Bromurazione di composti aromatici
La bromurazione di composti aromatici può avvenire tramite tre tipi di reazioni: addizione, sostituzione su catene laterali e sostituzione sull’anello aromatico.
L’aggiunta di bromo attraverso doppi legami aromatici è in genere una reazione lenta quando catalizzata dalla luce, ma il cloro può aumentare la velocità di reazione. La bromurazione di catene laterali aromatiche di solito procede tramite una reazione di radicali liberi.
La sostituzione elettrofila sull’anello aromatico è il tipo più significativo di bromurazione aromatica. In presenza di un catalizzatore, il bromo può reagire con composti aromatici per produrre bromuri arilici e bromuro di idrogeno attraverso la seguente reazione:
ArH + Br2 → ArBr + HBr
I catalizzatori adatti per la bromurazione aromatica includono acidi di Lewis come alogenuri di alluminio, ferro, zinco o antimonio. I composti aromatici attivati, come fenolo, anilina ed eteri aromatici, possono essere bromurati senza l’uso di un catalizzatore.
Al contrario, i composti aromatici fortemente disattivati contenenti gruppi elettron-attrattori possono subire bromurazione in presenza di acido solforico con acido nitrico.
Il bromo generato da acido bromidrico in situ è utilizzato in modo più efficiente nelle reazioni di sostituzione aromatica:
ArH + HBr + Cl2 → ArBr + 2 HCl
Anche il cloruro di bromo preformato può essere utilizzato a questo scopo. Le reazioni di sostituzione che utilizzano BrCl sono generalmente molto più rapide di quelle che utilizzano solo bromo.
1.3. Bromurazione con radicali liberi
Il bromo reagisce facilmente con idrocarburi saturi e catene laterali alchiliche di composti aromatici attraverso un meccanismo di reazione a catena che coinvolge radicali liberi. La reazione procede attraverso i seguenti passaggi:
Br2 → 2 Br•
RH + Br• → R• + HBr
R• + Br2 → RBr + Br•
L’inizio della reazione richiede la dissociazione delle molecole di bromo, che può essere ottenuta tramite iniziatori termici, fotolitici o perossidici. Rispetto al cloro, l’atomo di bromo è meno reattivo e la fase di estrazione dell’idrogeno è endotermica, con conseguenti velocità di reazione relativamente lente.
Tuttavia, l’atomo di bromo mostra un’elevata selettività di posizione. Ad esempio, nella bromurazione dell’n-butano, gli atomi di idrogeno secondari vengono sostituiti 82 volte più velocemente di quelli primari. La bromurazione delle catene laterali aromatiche è molto più rapida di quella degli alcani.
1.4. Produzione di bromuro di idrogeno
Il bromuro di idrogeno è un importante intermedio nella produzione di una varietà di bromuri organici e inorganici, tra cui prodotti medicinali, coloranti, profumi, prodotti chimici fotografici e molti altri composti chimici.
Il metodo commerciale più comune per preparare il bromuro di idrogeno prevede la reazione diretta in fase gassosa di idrogeno e bromo, che può essere realizzata senza catalizzatore, alimentando una fiamma autosufficiente all’interno di un bruciatore chiuso.
Br2 + H2 → 2 HBr + Calore
In laboratorio, l’acido bromidrico può essere generato distillando una soluzione di bromuro di sodio o di potassio con acido fosforico o solforico diluito (5,8 M), ma un acido solforico più concentrato o il fatto che la temperatura di reazione superi i 75 °C non sono efficaci poiché l’HBr inizialmente formato si ossiderà in bromo gassoso.
In alternativa, l’acido bromidrico può essere generato tramite la riduzione del bromo con acido fosforoso:
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
1.5. Bromurazione mediante trasportatori di bromo
I complessi di bromo e le bromoimmidi vengono utilizzati nelle reazioni di bromurazione che richiedono selettività. La N-bromosuccinimmide (NBS) è il trasportatore di bromo più comunemente utilizzato nelle bromurazioni di laboratorio.
La NBS ha un’applicazione unica nelle bromurazioni alliliche a radicali liberi:

Altri vettori efficaci del bromo per le reazioni chimiche includono dibromodimetilidantoina, diossano dibromuro, piridina bromidrato dibromuro e diversi tipi di polibromuri di ammonio quaternario.
2. Produzione di bromo
Il bromo viene prodotto da liquori contenenti bromo presenti in natura (salamoie) o dall’acqua di mare, nonché dalla produzione di sali di potassio.
Isolare il bromo da queste fonti è difficile a causa della concentrazione molare significativamente maggiore di ioni cloruro rispetto agli ioni bromuro nella maggior parte delle salamoie e dell’acqua dell’oceano.
Per estrarre il bromo è necessario un metodo di separazione ad alta selettività. Fortunatamente, esiste un metodo basato sulla maggiore facilità di ossidazione del bromuro rispetto al cloruro e sulla volatilità del prodotto di ossidazione, il bromo.
Il cloro è utilizzato come ossidante più economico e conveniente.
Le quattro fasi principali nella produzione del bromo includono l’ossidazione del bromuro a bromo, la rimozione del bromo dalla soluzione acquosa, la separazione del bromo dal vapore e la purificazione del bromo.
Due processi generali che utilizzano la clorurazione per il recupero del bromo sono comunemente impiegati, basati sulla seguente reazione chimica:
2 Br– + Cl2 → Br2 + 2 Cl–
- Il primo processo, il processo di steaming-out, viene utilizzato per salamoie e liquami di scarto contenenti bromo quando la concentrazione di bromuro nella salamoia è superiore a 1000 ppm. In questo processo viene impiegato il vapore per condensare il bromo direttamente dal vapore.
- Il secondo processo, il processo di blow-out, viene utilizzato per l’acqua di mare e prevede l’uso di aria a causa dei grandi volumi di gas di strippaggio richiesti. Per concentrare il bromo, è necessario intrappolarlo in una soluzione alcalina o riducente.
2.1. Produzione di bromo mediante processo di steaming-out
La produzione di bromo da salamoie che contengono Br- in concentrazioni di 1–5 g/L segue un processo descritto per la prima volta da KUBIERSCHKY nel 1906.
La salamoia grezza viene riscaldata in uno scambiatore di calore (a) e quindi fatta passare attraverso due torri di riempimento (b), (c) per gravità (Figura 1). Nella torre superiore, la salamoia incontra un flusso riciclato di gas che assorbono cloro e bromo.
Vicino al fondo della torre inferiore (c), vengono introdotti cloro e vapore. Mentre salgono, il cloro reagisce con il bromuro nella salamoia, producendo una miscela di vapore di bromo e cloro (circa 85: 15 in peso) con vapore che viene prelevato dalla parte superiore.
L’acqua e la maggior parte degli alogeni vengono condensati (d) e le fasi liquide entrano in un separatore per gravità (e), mentre il gas va alla torre superiore.
Dal separatore, l’acqua contenente alogeni disciolti viene inviata alla torre inferiore (di vaporizzazione) e lo strato di bromo più pesante, contenente un po’ di cloro, scorre verso una colonna di frazionamento (g).
I vapori di cloro si uniscono al flusso nella torre superiore, mentre il bromo liquido, puro al 99% circa, viene estratto per l’uso diretto nella produzione di composti di bromo o per un’ulteriore purificazione.
La salamoia calda debromurata viene trattata per neutralizzare l’acidità (h) e ridurre gli alogeni liberi, se necessario, quindi fatta passare attraverso lo scambiatore di calore, dove riscalda la salamoia in entrata.
Le recenti modifiche del processo Kubierschky originale sono correlate alla scala più ampia delle operazioni moderne, ai materiali di costruzione resistenti alla corrosione e alle procedure e alla strumentazione richieste per il controllo.
I processi sono controllati misurando punti critici come pH, potenziali di ossidoriduzione, portate, temperature e pressioni.
L’acidità viene generata quando il cloro reagisce con sostanze riducenti, come l’idrogeno solforato, nella salamoia. Questa acidità aumenta l’efficienza della liberazione del bromo impedendo l’idrolisi in acido ipobromoso.
Tuttavia, l’uso di acido solforico non è raccomandato se la salamoia contiene calcio o stronzio perché potrebbero precipitare come solfati e sporcare il riempimento della torre, le superfici di scambio termico o i pozzetti di smaltimento della salamoia. Si formeranno solfati se la salamoia contiene solfuri.
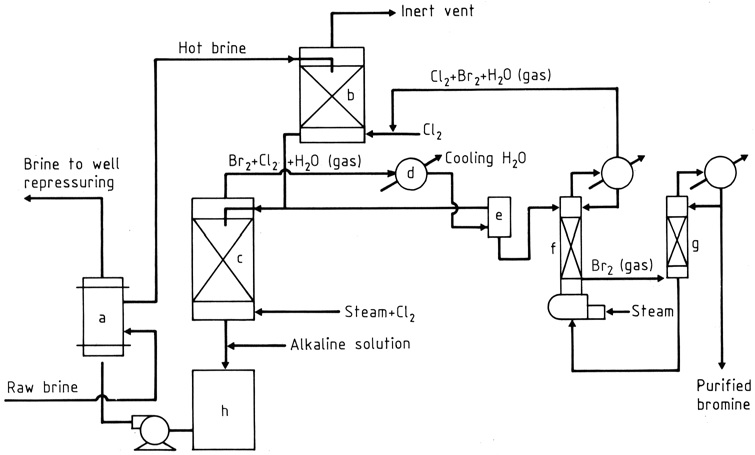
a) Scambiatore di calore incrociato del bromo; b) Assorbitore di cloro; c) Torre di vaporizzazione; d) Condensatore; e) Separatore; f) Colonna di strippaggio; g) Colonna di frazionamento; h) Neutralizzatore
2.2. Produzione di bromo mediante processo di acqua di mare
L’estrazione del bromo direttamente dall’acqua di mare, che ha portato al suo recupero commerciale di successo, è stata ottenuta per la prima volta nei pressi di Wilmington, Carolina del Nord (USA). Ciò è stato ottenuto utilizzando un metodo di soffiaggio ad aria inizialmente sviluppato per la lavorazione della salamoia da H. H. DOW.
L’uso di aria, anziché vapore, è stato ritenuto necessario a causa dell’elevato costo del vapore, che sarebbe stato necessario per riscaldare l’acqua dell’oceano che contiene solo circa 65 mg/L di bromo. È degno di nota che l’impianto di Wilmington non è più operativo.
L’acqua di mare viene pompata in cima alle torri di soffiaggio, con l’aggiunta di acido solforico e cloro appena sopra le pompe per garantire una corretta miscelazione durante la risalita.
È necessaria una quantità di 1,3 kg di acido solforico al 10% per tonnellata di acqua per neutralizzare gli idrocarburi naturali e portare il pH a 3,5, e viene utilizzato un eccesso di cloro del 15% rispetto al fabbisogno teorico.
L’aria viene aspirata attraverso le torri, il che consente l’estrazione di una miscela di bromo e cloro (o cloruro di bromo) dall’acqua oceanica in discesa. L’aria viene successivamente aspirata attraverso torri di assorbimento, dove viene depurata controcorrente utilizzando una soluzione di carbonato di sodio.
Le diverse reazioni che si verificano possono essere riassunte approssimativamente dalla seguente equazione:
3 Na2CO3 + 2 Br2 + BrCl → NaBrO3 + 4 NaBr + NaCl + 3 CO2
Per eliminare gli spruzzi dall’aria, vengono installate piccole camere imballate tra le torri di assorbimento e i ventilatori.
Quando l’alcalinità della soluzione di lavaggio è quasi esaurita, la soluzione viene trasferita in un serbatoio di stoccaggio e poi in un reattore, dove viene trattata con acido solforico e vaporizzata per rilasciare bromo. La reazione chimica è descritta come segue:
NaBrO3 + 5 NaBr + 3 H2SO4 → 3 Br2 + 3 Na2SO4 + 3 H2O
Sono stati utilizzati altri metodi per estrarre il bromo, tra cui l’uso dell’elettrolisi nella produzione iniziale in Germania, che è stata impiegata al posto del cloro per ossidare i bromuri.
Negli Stati Uniti, è stato impiegato un processo Kubierschky modificato per recuperare il bromo come sottoprodotto dai liquori di produzione del cloruro di potassio.
3. Usi del bromo
Il bromo è un elemento versatile con un’ampia gamma di applicazioni. È ampiamente utilizzato nella produzione di ritardanti di fiamma, fluidi di perforazione, sintesi organica, prodotti farmaceutici, biocidi per il trattamento delle acque e agricoltura.
Inoltre, è utilizzato nella produzione di coloranti, repellenti per insetti, profumi e materiali fotografici.
Altre applicazioni dei composti del bromo includono il controllo del mercurio e la produzione di carta.
I ritardanti di fiamma bromurati sono una parte significativa dei derivati del bromo. Dall’inizio degli anni ’90, il loro consumo è aumentato notevolmente e nel 2013 hanno costituito più della metà del consumo totale di bromo.
Sono utilizzati in apparecchiature industriali e domestiche come computer, mobili, schede, telefoni cellulari, televisori e tessuti.
Le caratteristiche di elevata densità dei composti di bromo sono applicate in modo vantaggioso nei fluidi idraulici, nei fluidi di misurazione, nella flottazione dei minerali e nei fluidi di perforazione.
I bromuri di calcio, zinco e sodio sono utilizzati dall’industria di perforazione di petrolio e gas per preparare fluidi di perforazione, completamento, packer e workover di salamoia ad alta densità e trasparenti.
Un gruppo significativo e in espansione di biocidi bromurati è destinato al trattamento delle acque, sebbene il cloro controlli la maggior parte dei mercati del trattamento delle acque.
In generale, sia i segmenti industriali che quelli di consumo dell’industria del trattamento delle acque stanno sostituendo sempre più il cloro e i composti clorurati con prodotti a base di bromo.
I biocidi bromurati sono inoltre preferiti ai biocidi clorurati in varie applicazioni industriali a causa della loro maggiore tolleranza a un’ampia gamma di livelli di pH, il che è un problema nelle torri di raffreddamento e nelle acque di processo.
Il bromo e i suoi composti vengono utilizzati per mitigare le emissioni di mercurio nelle centrali elettriche a carbone.
I composti inorganici del bromo, come il bromuro di calcio e il bromuro di sodio, si legano al mercurio presente nei gas di scarico delle centrali elettriche a carbone, creando composti di mercurio che vengono catturati negli scrubber, rimuovendo così fino al 90% del mercurio liberato durante la combustione.
Riferimenti
- Bromine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_391.pub2
- Bromine; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0218151310010311.a01.pub3
