Antrachinone: proprietà, reazioni, produzione e usi
Cos’è l’antrachinone?
L’antrachinone è un composto organico con formula C14H8O2. È un solido cristallino giallo, quasi insolubile in acqua e solventi organici a temperatura ambiente. La sua solubilità aumenta con la temperatura.
L’antrachinone è utilizzato come precursore nella produzione di un’ampia gamma di coloranti, nonché come catalizzatore nella polpa di legno.
Fu sintetizzato per la prima volta nel 1835, ma il suo ruolo fondamentale nell’industria dei coloranti non fu compreso fino al 1868. Da allora, la chimica dell’antrachinone si è espansa rapidamente, portando allo sviluppo di nuovi coloranti mordenti, coloranti acidi, coloranti al tino, coloranti dispersi e coloranti reattivi.
Negli ultimi decenni, l’industria dell’antrachinone ha subito una trasformazione globale. Sono state sviluppate nuove procedure di sintesi per soddisfare la crescente domanda di antrachinone e i metodi di lavorazione si sono evoluti per diventare più efficienti e rispettosi dell’ambiente.
Una delle applicazioni più innovative dell’antrachinone è il suo utilizzo come catalizzatore nella polpa di legno alcalina. Questo ramo della chimica dell’antrachinone si sta sviluppando rapidamente e ha il potenziale per superare le richieste dell’industria dei coloranti.
La domanda di antrachinone è aumentata costantemente dal 1870 e l’attuale domanda annuale supera le 30.000 tonnellate metriche.
Sommario
1. Proprietà fisiche dell’antrachinone
Le proprietà fisiche dell’antrachinone sono elencate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Numero CAS | 84-65-1 |
| Formula chimica | C14H8O2 |
| Massa molare | 208,20 g/mol |
| Aspetto | L'antrachinone cristallino è delicato, con aghi di colore da giallo chiaro a giallo pallido. Quando finemente suddiviso o precipitato dall'acido solforico, appare quasi incolore. |
| Punto di fusione | 287 °C |
| Punto di ebollizione | 377 °C |
| Classe cristallina | Monoclino |
| Gruppo spaziale | P 21/a |
| Dimensioni della cella unitaria |
|
| Densità cristallina |
|
| Pressione di vapore |
|
| Capacità termica molare a pressione costante (cp) | 265 J mol-1 K-1 |
| Entalpia di formazione | -179 kJ/mol |
| Entalpia di combustione | 6449 kJ/mol a 25 °C |
| Entalpia di fusione | 32,57 kJ/mol a 287 °C |
| Punto di infiammabilità | 185 °C |
| Solubilità |
|
| Altro |
|
2. Reazioni chimiche dell’antrachinone
2.1. Ossidazione
L’antrachinone è stabile all’ossidazione in condizioni normali, ma può essere ossidato ad alizarina in condizioni difficili con idrossido di sodio e clorato di sodio.
L’antrachinone può essere ossidato a poliidrossiantrachinoni con acido solforico concentrato e acido borico, persolfati o acido metaarsenico a temperature superiori a 200 °C.
L’oleum può anche essere utilizzato per ossidare l’antrachinone in poliidrossiantrachinoni a temperature più basse, a seconda del suo contenuto di SO3.
L’acido nitrico concentrato non ossida l’antrachinone, ma lo nitra. Alcune miscele di antrachinone e acido nitrico possono essere esplosive.
2.2. Riduzione
L’antrachinone può essere ridotto ad antraidrochinone con comuni agenti riducenti o idrogeno in presenza di un catalizzatore.
L’iposolfito di sodio in una soluzione alcalina riduce l’antrachinone a un sale di sodio rosso sangue dell’antraidrochinone, che può riorganizzarsi nel suo tautomero oxantrone in una soluzione acida.
Metodi di riduzione più vigorosi, come l’acido cloridrico o l’idrogenazione catalitica ad alta pressione o temperatura, producono antrone, che esiste in equilibrio con il suo tautomero antrolo (9-idrossiantracene) e successivamente si trasforma in antracene e idroantracene.
Quando si utilizza zinco o idrossido di sodio, il diantranolo viene prodotto tramite dimerizzazione.
In determinate condizioni di reazione, il processo di riduzione può essere indirizzato specificamente ai due nuclei esterni, portando alla formazione di 1,2,3,4-tetraidroantrachinone o ottaidroantrachinone.
2.3. Condensazione
L’antrachinone può essere condensato con glicerolo, polvere di ferro e acido solforico per produrre benzantrone.
2.4. Clorazione
L’antrachinone può essere clorurato nell’oleum, principalmente in posizione alfa.
Riscaldando l’antrachinone con pentacloruro di antimonio o reagenti simili che rilasciano cloro si ottengono prodotti clorurati che vanno dal monocloroantrachinone al percloroantrachinone.
2.5. Solfonazione e idrossilazione
L’acido solforico o l’oleum possono solfonare e/o idrossilare l’antrachinone. L’acido solforico concentrato solfona principalmente l’antrachinone sopra i 200 °C.
L’oleum viene solitamente utilizzato per solfonare l’antrachinone a temperature comprese tra 140 °C e 160 °C, producendo i principali prodotti di reazione tra cui acidi β-solfonici come l’acido antrachinone-2-solfonico, l’acido antrachinone-2,6-disolfonico e l’acido antrachinone-2,7-disolfonico.
In presenza di mercurio, la solfonazione avviene prevalentemente in posizione alfa, producendo acido antrachinone-1-solfonico, acido antrachinone-1,5-disolfonico e acido antrachinone-1,8-disolfonico.
2.6. Nitrazione
La nitrazione dell’antrachinone richiede condizioni rigorose, che si traducono principalmente in alfa-nitroantrachinoni insieme a proporzioni variabili di beta-nitro- e alfa,beta-dinitroantrachinoni.
Si verificano sia processi di mono- che dinitrazione, che spesso producono prodotti di nitrazione impuri che richiedono un’elaborazione approfondita per la separazione in 1-nitroantrachinone, 1,5-dinitroantrachinone e 1,8-dinitroantrachinone.
3. Produzione industriale di antrachinone
Nella produzione industriale di antrachinone vengono impiegati diversi processi. Il metodo più comune è l’ossidazione in fase vapore dell’antracene utilizzando aria. Tuttavia, anche il processo del naftalene e la sintesi da anidride ftalica e benzene stanno guadagnando importanza a causa della scarsità di antracene.
1. Ossidazione dell’antracene
L’antrachinone viene tradizionalmente sintetizzato dall’antracene, che si ottiene dal catrame di carbone. Questo processo prevede l’ossidazione dell’antracene con acido cromico in una soluzione di acido solforico al 48%. Il sottoprodotto solfato di cromo (III) deve essere trasformato in agenti concianti. Questo metodo richiede antracene ad alta purezza con una purezza minima del 94%.
2. Ossidazione in fase vapore dell’antracene
Circa l’85% della produzione globale di antrachinone si basa sull’ossidazione in fase vapore dell’antracene mediante aria. Tuttavia, il calo della produzione di antracene ha portato a una carenza di fornitura, promuovendo il processo del naftalene. Il naftalene è facilmente reperibile nel catrame di carbone e può anche essere estratto dagli oli residui ottenuti dalla riformazione della benzina.
3. Processo del naftalene
Questo processo è impiegato in Giappone da Kawasaki e in Europa da Bayer. Comporta una sintesi in tre fasi dell’antrachinone:
- Il naftochinone viene preparato mediante ossidazione in fase vapore del naftalene con aria.
- Il butadiene viene introdotto in una reazione di Diels-Alder con il naftochinone.
- Il tetraidroantrachinone risultante viene sottoposto a ossideidrogenazione.
Questo processo genera anidride ftalica come sottoprodotto.
4. Sintesi da anidride ftalica e benzene
Nelle regioni in cui l’antracene non è sufficientemente disponibile dal catrame di carbone, l’antrachinone può essere sintetizzato da anidride ftalica e benzene. Questo processo comporta l’uso di circa 1,4 tonnellate metriche di cloruro di alluminio e 4-6 tonnellate metriche di acido solforico per tonnellata di antrachinone.
Ha acquisito una rinnovata importanza a causa della scarsità di antracene. La disponibilità di anidride ftalica a basso costo in quantità sufficienti, ottenuta tramite l’ossidazione economica di naftalene o o-xilene con aria, ha contribuito alla rinascita di questa via di sintesi.
5. Processo di dimerizzazione dello stirene
All’inizio degli anni ’70, BASF introdusse un altro intrigante processo di produzione di antrachinone. Questo metodo inizia con la dimerizzazione dello stirene in 1-metil-3-fenilindano, facilitata da un catalizzatore acido. Successivamente, l’1-metil-3-fenilindano viene convertito in antrachinone nella fase di vapore mediante ossidazione con aria.
3.1. Produzione di antrachinone mediante ossidazione dell’antracene con acido cromico
La produzione industriale di antrachinone mediante ossidazione con acido cromico è un processo consolidato ed efficiente. È relativamente poco costoso e può essere condotto in operazioni batch.
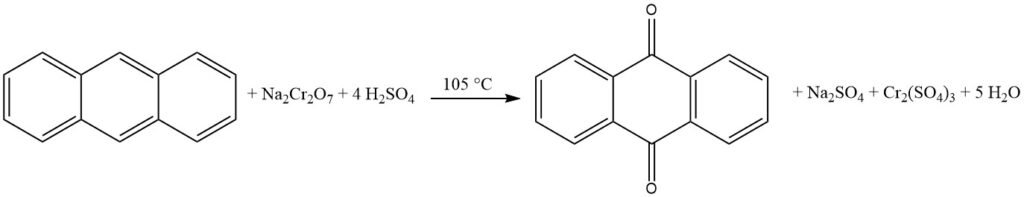
Il processo inizia con la preparazione di una pasta di antracene polverizzando finemente l’antracene puro (purezza 94-95%) e mescolandolo con acqua e un agente bagnante in un recipiente di miscelazione. La pasta di antracene viene quindi ossidata aggiungendo alternativamente porzioni di acido solforico al 48% e soluzione di bicromato di sodio al 20%. La reazione viene controllata per evitare un’eccessiva formazione di schiuma e un aumento della temperatura.
Dopo che l’ossidazione è completa, la miscela di reazione viene filtrata e il materiale filtrato viene lavato e sospeso in acqua. Il prodotto antrachinone grezzo viene quindi filtrato e ha una purezza di circa il 95%. L’antrachinone grezzo può essere ulteriormente lavorato mediante essiccazione o ricristallizzazione per ottenere un livello di purezza fino al 99%.
Questo processo è spesso combinato con la produzione di agenti concianti, poiché comporta spese minime per l’agente ossidante.
3.2. Produzione di antrachinone mediante ossidazione in fase vapore dell’antracene con aria
L’ossidazione in fase vapore dell’antracene con aria è un metodo efficiente e ben controllato per la produzione di antrachinone ad alta purezza.
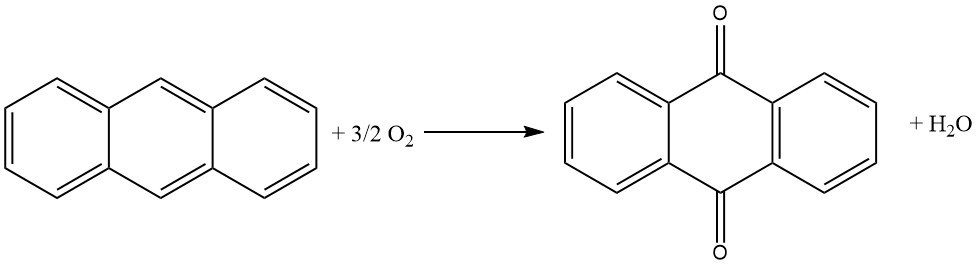
Si basa sull’uso di catalizzatori simili a quelli usati nell’ossidazione del naftalene o dell’o-xilene in anidride ftalica. Il processo è caratterizzato da un’elevata conversione dell’antracene, una minima formazione di sottoprodotti e un’elevata purezza del prodotto.
Il processo inizia con l’evaporazione dell’antracene usando una miscela di aria e vapore acqueo preriscaldata. Il flusso di gas viene quindi accuratamente miscelato con aria aggiuntiva per evitare il rischio di esplosione. Questa miscela viene quindi diretta in un forno catalitico dal basso, dove la temperatura è controllata.
Il forno catalitico è costituito da 1400 litri di materiale catalizzatore disposto a strati. La parte inferiore, dove avviene la reazione, viene raffreddata a 390 °C, mentre la parte superiore viene riscaldata a 339 °C. Il catalizzatore è in genere vanadato di ferro, preparato da vanadato di ammonio e cloruro di ferro (III).
I gas che escono dal forno catalitico vengono sottoposti a varie fasi di raffreddamento e filtraggio per separare il prodotto antrachinone dai gas sottoprodotti.
Il catalizzatore di vanadato di ferro utilizzato in questo processo viene preparato sciogliendo ossido di ferro rosso (III) in acido cloridrico e acqua. Questa soluzione viene quindi miscelata con vanadato di ammonio in acqua e precipitata. La soluzione risultante viene evaporata su pomice in un mulino a sfere riscaldabile e successivamente calcinata. Il catalizzatore risultante dovrebbe avere un colore giallo-marrone.
Nel tempo, l’attività del catalizzatore può diminuire, portando a un calo della resa di antrachinone e a un aumento della produzione di anidride ftalica. Per mantenere o riattivare l’attività del catalizzatore, è possibile aggiungere una piccola quantità di ammoniaca all’aria di ossidazione oppure lavare il catalizzatore esausto con una soluzione alcalina diluita.
Questo processo produce antrachinone con un’elevata purezza del 99%.
3.3. Produzione di antrachinone mediante il processo al naftalene
Il processo al naftalene, ideato da Kawasaki Kasei Chemicals, è un processo in tre fasi per produrre antrachinone dal naftalene.
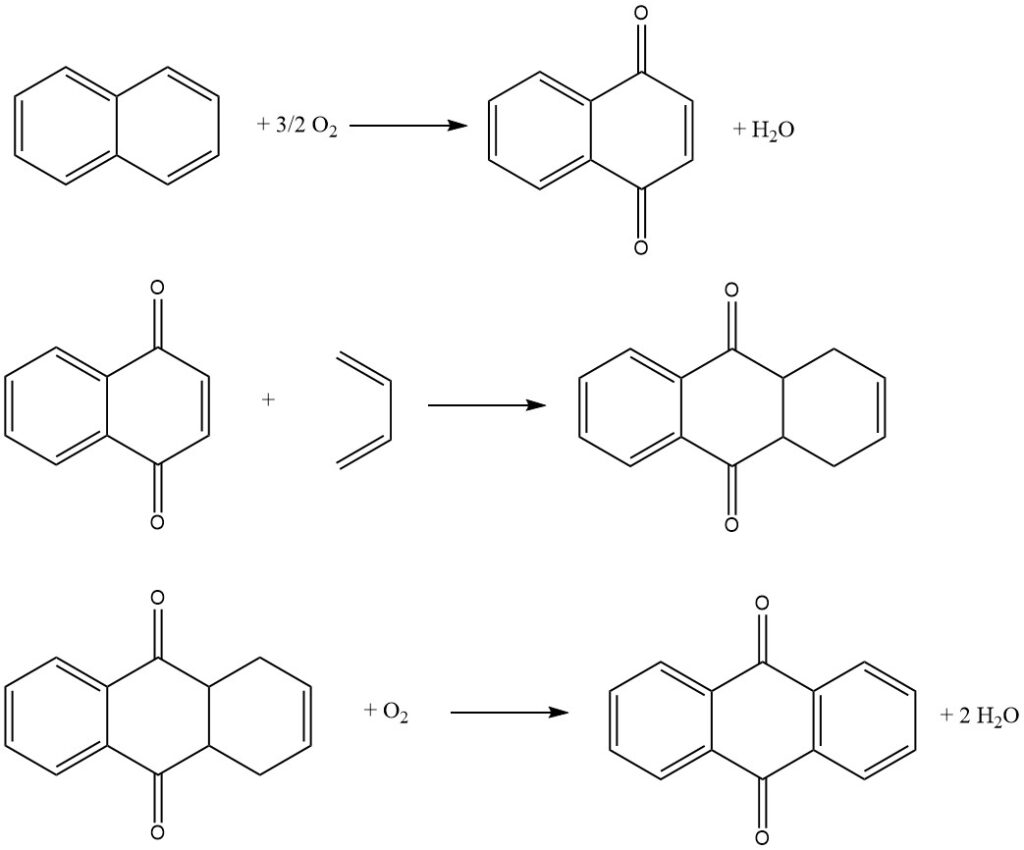
Passaggio 1: Ossidazione del naftalene
Nel primo passaggio, il naftalene viene ossidato con aria su un catalizzatore di pentossido di vanadio per produrre naftochinone e anidride ftalica. La reazione viene condotta in fase gassosa ad alta temperatura.
Passaggio 2: Reazione di Diels-Alder con butadiene
Nel secondo passaggio, il naftochinone viene fatto reagire con butadiene in una reazione di Diels-Alder per produrre tetraidroantrachinone. La reazione viene condotta in fase liquida utilizzando un solvente organico come xilene o tetraidroantrachinone.
Passaggio 3: Ossidodeidrogenazione del tetraidroantrachinone
Nel terzo passaggio, il tetraidroantrachinone viene ossidato con aria per produrre antrachinone. La reazione viene condotta in una fase acquosa utilizzando un catalizzatore alcalino.
L’anidride ftalica prodotta nel primo passaggio può essere recuperata dalla soluzione acquosa mediante cristallizzazione e filtrazione.
Variante di Bayer del processo al naftalene
La variante di Bayer del processo al naftalene differisce dal processo Kawasaki Kasei nei seguenti modi:
- L’ossidazione del naftalene viene condotta con una miscela di aria e gas di reazione riciclato.
- La reazione di Diels-Alder con butadiene viene condotta senza purificare i prodotti di ossidazione del naftalene.
- Il tetraidroantrachinone viene ossideidrogenato ad antrachinone in presenza di naftalene.
- L’antrachinone e l’anidride ftalica vengono separati tramite distillazione frazionata.
3.4. Sintesi da anidride ftalica e benzene
La sintesi dell’antrachinone da anidride ftalica e benzene è un processo in due fasi:
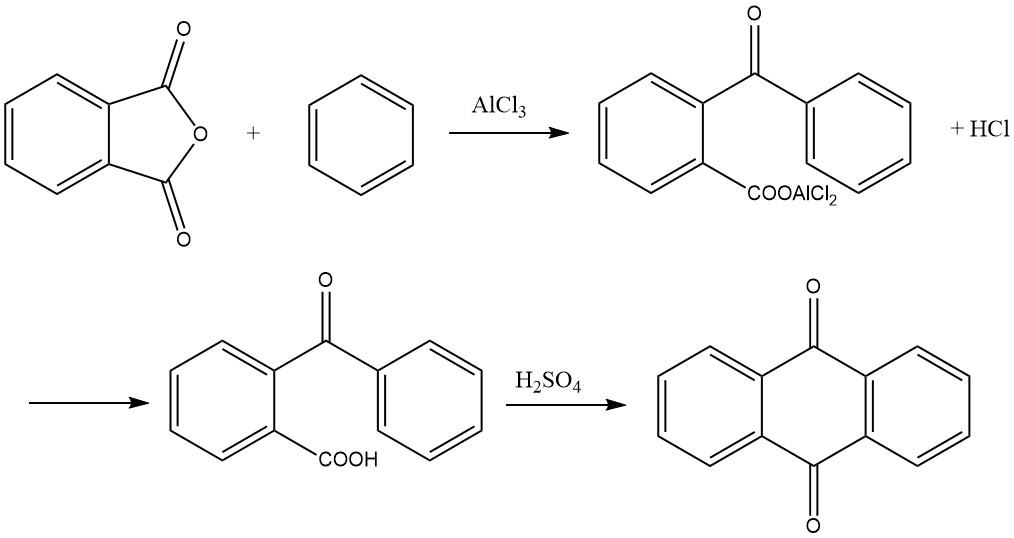
1. Formazione dell’acido o-benzoilbenzoico
Nel primo passaggio, l’acido o-benzoilbenzoico viene formato tramite un’acilazione di Friedel-Crafts utilizzando anidride ftalica e benzene come materiali di partenza. Questa reazione produce un complesso di cloruro di alluminio dell’acido o-benzoilbenzoico come prodotto primario, che può solidificarsi all’interno del recipiente di reazione.
Per affrontare questo problema, sono stati proposti vari metodi, tra cui:
- Condurre la reazione con eccesso di benzene per ottenere rese superiori al 95%.
- Eseguire la reazione in un processo senza solventi in mulini a sfere, utilizzando glicole etilenico o 1,4-butandiolo per attenuare il problema della solidificazione e ridurre l’eccesso richiesto di benzene.
La reazione in genere procede con un rapporto molare di 1:1:2 per anidride ftalica, benzene e cloruro di alluminio. Avviene a temperature inferiori a 45 °C e genera acido cloridrico come sottoprodotto. Durante la reazione si verifica un’ampia formazione di schiuma, aumentando il volume più volte, cosa di cui si deve tenere conto quando si misura la carica iniziale.
Il completamento della reazione è indicato quando si è sviluppata 1 mole di acido cloridrico per mole di anidride ftalica. Il prodotto di reazione risultante viene quindi posto in una soluzione acida diluita, precipitando l’acido o-benzoilbenzoico. Questo precipitato viene separato, lavato ed essiccato, producendo oltre il 95% del prodotto desiderato.
2. Ciclizzazione ad antrachinone
Nel secondo passaggio, l’acido o-benzoilbenzoico può essere ulteriormente convertito in antrachinone. Mentre è possibile iniziare con il complesso di cloruro di alluminio formato nel primo passaggio e scindere 1 mole di acido cloridrico riscaldando a 200 °C per produrre antrachinone, il metodo preferito nella pratica è quello di condensare l’acido o-benzoilbenzoico essiccato con acido solforico.
L’acido viene sciolto in circa tre o quattro volte il suo peso in acido solforico al 95-98% e riscaldato a una temperatura compresa tra 115 e 140 °C. La durata del riscaldamento dipende da fattori quali la quantità e la concentrazione dell’acido solforico e la temperatura.
Una volta completata la reazione, l’antrachinone precipita con l’aggiunta di acqua e può essere successivamente filtrato ed essiccato. In alternativa, una parte del prodotto può essere ottenuta in forma grossolanamente cristallizzata raffreddando direttamente la soluzione di acido solforico. La resa in questa fase è quasi quantitativa.
La soluzione di condensazione può anche essere utilizzata direttamente per la produzione di benzantroni o acidi antrachinonesulfonici.
3.5. Produzione di antrachinone mediante processo stirene
Il processo stirene, sviluppato da BASF, è un processo in più fasi per produrre antrachinone da stirene. È un metodo efficiente e versatile che produce antrachinone ad alta purezza.
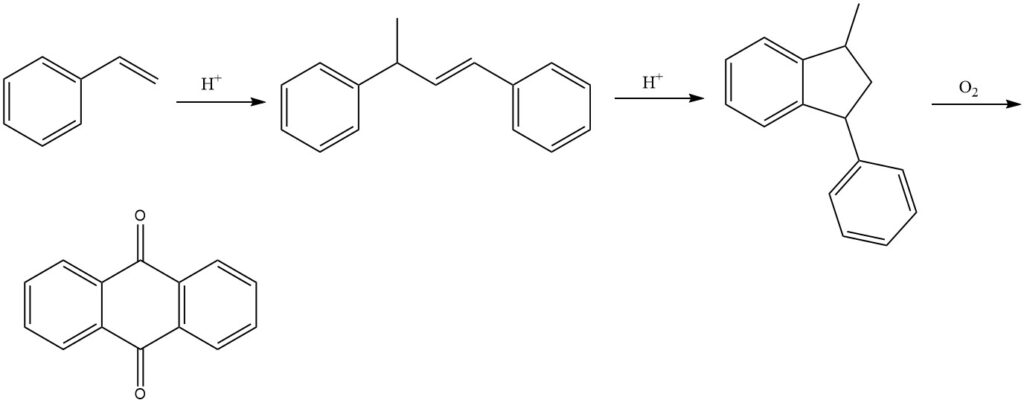
Il processo inizia con la dimerizzazione dello stirene in presenza di catalizzatori acidi per produrre 1,3-difenil-2-butene. Segue la ciclizzazione del 1,3-difenil-2-butene per formare 1-metil-3-fenilindano. Infine, il 1-metil-3-fenilindano viene ossidato con aria nella fase vapore per produrre antrachinone.
Nella fase di ossidazione possono essere utilizzati vari catalizzatori, come composti di vanadio (principalmente pentossido di vanadio), spesso in combinazione con altri ossidi come ossido di tallio e ossido di antimonio.
Il processo dello stirene produce rese di circa il 77% per il prodotto finale. Tuttavia, il prodotto di reazione precipitato può ancora contenere sottoprodotti, rendendo necessaria un’ulteriore purificazione per l’isolamento finale dell’antrachinone puro.
4. Utilizzi dell’antrachinone
L’antrachinone è una sostanza chimica versatile e importante utilizzata nella produzione di un’ampia gamma di prodotti, tra cui coloranti, materie plastiche, prodotti farmaceutici e carta.
L’antrachinone viene utilizzato per produrre un’ampia gamma di coloranti, tra cui coloranti acidi, coloranti di base, coloranti al tino, coloranti dispersi e coloranti reattivi. Questi coloranti vengono utilizzati in una varietà di settori, tra cui tessuti, materie plastiche e stampa.
L’antrachinone viene utilizzato anche nella produzione di materie plastiche, come il polietilene tereftalato (PET) e il polibutilene tereftalato (PBT). Queste materie plastiche vengono utilizzate in una varietà di prodotti, tra cui imballaggi alimentari, bottiglie per bevande e componenti elettrici.
L’antrachinone è utilizzato anche nella produzione di prodotti farmaceutici, come lassativi e farmaci antinfiammatori.
L’antrachinone è utilizzato nell’industria della carta come catalizzatore redox per facilitare l’idrolisi alcalina della lignina polimerica. Ciò comporta una maggiore resa della polpa e tempi di cottura ridotti.
L’antrachinone è utilizzato anche in una varietà di altre applicazioni, come la produzione di denaturanti per la protezione dei semi, la modifica degli standoli e il miglioramento della colofonia.
Negli ultimi anni, c’è stato uno spostamento nella produzione di coloranti antrachinonici dagli acidi solfonici ai composti nitro a causa di preoccupazioni ambientali. Il processo con acido solfonico genera grandi quantità di acque reflue, mentre il processo con composti nitro è più efficiente e produce meno rifiuti.
5. Tossicologia dell’antrachinone
L’antrachinone è una sostanza chimica relativamente non tossica. È considerata biologicamente inerte, il che significa che è inattiva nei sistemi biologici. Ciò è probabilmente dovuto alla sua bassa solubilità sia in acqua che nei lipidi.
Non sono disponibili dati tossicologici sull’antrachinone, ma gli studi hanno dimostrato che è meno irritante per gli occhi rispetto al benzochinone e ha un livello di inerzia simile alla polvere inerte.
È stato raccomandato un valore MAK di 10 mg/m³ per l’antrachinone in contesti occupazionali. Ciò significa che la polvere di antrachinone è considerata a basso rischio per la salute.
Riferimento
- Anthraquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_347
