Acroleina: proprietà, reazioni, produzione e usi
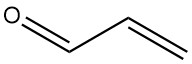
Cos’è l’acroleina?
L’acroleina, nota anche come propenale o acrilaldeide, è l’aldeide insatura più semplice con formula C3H4O. È un liquido volatile e incolore con un forte odore che è sia tossico che lacrimogeno.
La scoperta dell’acroleina, che deriva il suo nome dalle parole latine “acer” che significa acre e “oleum” che significa olio, può essere attribuita a Redtenbacher nel 1843. È stata trovata nel grasso surriscaldato.
Nel 1942, Degussa ha stabilito un metodo per produrre commercialmente acroleina attraverso la condensazione in fase gassosa catalizzata in modo eterogeneo di acetaldeide e formaldeide. Attualmente, l’acroleina viene prodotta su larga scala principalmente mediante l’ossidazione in fase gassosa del propene, catalizzata in modo eterogeneo.
Sommario
1. Proprietà fisiche dell’acroleina
L’acroleina ha una solubilità limitata in acqua ma è solubile in vari solventi organici, tra cui alcoli, eteri e idrocarburi alifatici o aromatici. Le proprietà fisiche essenziali dell’acroleina sono presentate di seguito:
| Proprietà | Valore |
|---|---|
| Massa molare | 56,06 g/mol |
| Punto di ebollizione | 52-53°C |
| Punto di fusione | -87°C |
| Densità relativa | 0,838 g/cm³ |
| Indice di rifrazione | 1,418 |
| Viscosità | 0,40 cP a 25°C |
| Solubilità in acqua | 260 g/kg |
| Pressione di vapore | 29 kPa a 20°C |
| Temperatura di autoaccensione in aria | 234 °C |
| Punto di infiammabilità | -26 °C |
2. Reazioni chimiche dell’acroleina
L’acroleina mostra un’elevata reattività dovuta ai suoi gruppi coniugati vinilici e aldeidici, che la portano a subire reazioni caratteristiche sia dei composti insaturi che delle aldeidi.
La coniugazione tra il doppio legame carbonio-carbonio e il gruppo carbonilico aumenta la reattività di entrambi i gruppi, consentendo loro di reagire insieme o separatamente.
Vale la pena notare che l’acroleina può subire una polimerizzazione spontanea altamente esotermica.
2.1. Reazione di Diels-Alder
L’acroleina agisce sia come diene che come dienofilo, consentendo la formazione di un dimero ciclico chiamato 3,4-diidro-2H-piran-2-carbossaldeide. Questo dimero viene prodotto attraverso la reazione termica non catalizzata dell’acroleina a circa 190 °C (1 ora per una conversione dell’acroleina del 75%), insieme alla formazione di prodotti collaterali polimerici.
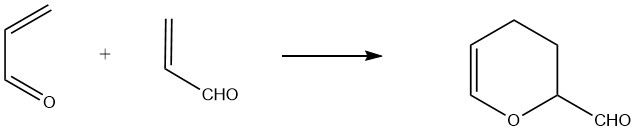
Per ottenere rese elevate, è necessaria la stabilizzazione con idrochinone o composti complessanti come gli acidi organici polivalenti.
Il “dimero termico” risultante è un liquido trasparente dall’odore sgradevole, che bolle a 151,3 °C a 101,3 kPa e ha una densità relativa di 1,0775. L’idrolisi acida del dimero produce 2-idrossiadipaldeide, che può essere ulteriormente idrogenata per formare 1,2,6-esantriolo.
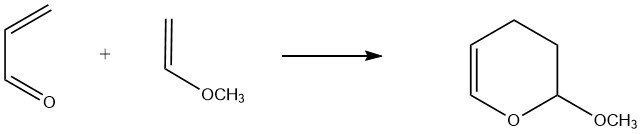
L’acroleina agisce come un 1,3-diene nelle reazioni con dienofili in cui la densità elettronica del doppio legame carbonio-carbonio viene aumentata da sostituenti che rilasciano elettroni. Ad esempio, l’acroleina reagisce facilmente con eteri vinilici e vinilammine per formare diidropirani.
Un esempio commerciale significativo è la reazione tra metilviniletere e acroleina, che porta alla formazione di 3,4-diidro-2-metossi-2H-pirano. Le rese riportate per questa reazione a temperature comprese tra 160 e 190 °C variano dall’80% al 90%.
2.2. Aggiunta al doppio legame carbonio-carbonio
L’atomo di carbonio β dell’acroleina, polarizzato dal gruppo carbonilico, agisce come elettrofilo. Di conseguenza, reagenti nucleofili come alcoli, tioli, acqua, ammine, composti metilenici attivi e acidi inorganici e organici possono aggiungersi al doppio legame carbonio-carbonio in presenza di catalizzatori acidi o basici.
Condizioni attentamente controllate sono essenziali per ridurre al minimo le reazioni collaterali indesiderate. L’aggiunta di acqua in condizioni leggermente acide porta alla formazione di 3-idrossipropionaldeide con elevata selettività.
Soluzioni tampone con un pH di 4-5 o resine a scambio ionico debolmente acide sono spesso utilizzate come catalizzatori. Un’ulteriore idrogenazione delle soluzioni acquose produce 1,3-propandiolo.
I catalizzatori di metalli preziosi facilitano l’ossidazione diretta di soluzioni acquose di 3-idrossipropionaldeide a pH 3, producendo acido 3-idrossipropionico. Al di sopra del pH 7, l’anione malonato si forma con elevata resa.
L’acroleina reagisce rapidamente con cloruro di idrogeno o bromuro di idrogeno per produrre 3-cloropropionaldeide o 3-bromopropionaldeide. Tuttavia, questi prodotti polimerizzano facilmente in trimeri e tetrameri in presenza di acidi. Per ottenere acetali di 3-alopropionaldeide, si preferisce un processo simultaneo di aggiunta di alogenuro di idrogeno e acetalizzazione, con conseguenti rese di acetale di circa il 90%.
Cloro e bromo possono aggiungersi all’acroleina in soluzione acquosa diluita, formando 2,3-dialopropionaldeidi con rese di circa l’85%. Queste dialopropionaldeidi possono essere deidroalogenate per produrre 2-aloacroleine. Le 2-aloacroleine sono note per essere potenti mutageni e possono essere ulteriormente alogenate per produrre 2,2,3-trialopropionaldeidi, che sono preziosi intermedi nella sintesi dell’acido folico.
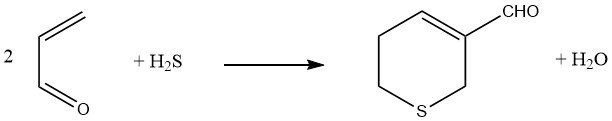
L’acido solfidrico, quando aggiunto a due equivalenti di acroleina seguito da una reazione aldolica, determina la formazione di 3-formil-5,6-diidrotiopirano.
Il metantiolo subisce un’addizione catalizzata da basi all’acroleina, che porta alla formazione di 3-(metiltio)propionaldeide, che è una reazione importante utilizzata nella sintesi dell’amminoacido essenziale D,L-metionina.
2.3. Reazioni del gruppo aldeidico
La selettività dell’acetalizzazione catalizzata da acidi dipende dalla natura dell’alcol utilizzato e dai catalizzatori impiegati. Le reazioni collaterali possono produrre le corrispondenti 3-alcossipropionaldeidi e 3-alcossipropionaldeidi acetali.
Gli acetali ciclici, in particolare quelli formati con dioli ramificati come il 2-metil-1,3-propandiolo, sono più facili da ottenere rispetto agli acetali aciclici di alcoli inferiori. Sono noti vari processi continui per la preparazione di acetali ciclici, con rese superiori al 90% ottenibili tramite processi speciali in combinazione con l’estrazione.
Gli acetali di acroleina servono come preziosi intermedi e hanno suscitato interesse come forme più sicure per il trasporto di acroleina, in particolare 2-vinil-1,3-diossolano. Questi acetali possono essere facilmente scissi in acroleina in soluzioni acquose acide, che trovano utilità nell’uso dell’acroleina come erbicida acquatico e come scavenger di idrogeno solforato nelle acque dei giacimenti petroliferi.
Spiro diacetale, diallilidene pentaeritritolo, preparato condensando il pentaeritritolo con due moli di acroleina, può essere polimerizzato con vinile o altri monomeri per formare resine spiraniche.
L’idroformilazione degli acetali di acroleina, in particolare degli acetali ciclici, porta ai monoacetali di 1,4-butandiale. La successiva idrolisi e idrogenazione di questo prodotto di idroformilazione determina la produzione di 1,4-butandiolo.
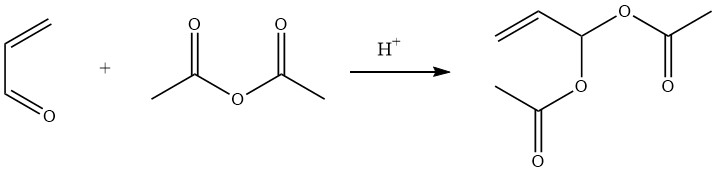
Il diacetato di acroleina, noto anche come diacetato di 2-propene-1,1-diolo, è facilmente preparato con una resa del 90% mediante la reazione acido-catalizzata dell’anidride acetica con l’acroleina.
Quando si aggiunge acido cianidrico all’acroleina in presenza di catalizzatori alcalini deboli, si forma acroleina cianoidrina con rese superiori al 90%. L’acetato di acroleina cianoidrina, ottenuto tramite la sua reazione con anidride acetica, funge da prezioso intermedio nella sintesi di sostanze farmaceuticamente e biologicamente attive.
2.4. Reazione simultanea dei gruppi aldeidico e vinilico
Sebbene acroleina e metacroleina siano riconosciute come intermedi nella sintesi di Skraup di chinoline da ammine aromatiche e glicerolo, il loro utilizzo commerciale come materiali di partenza per questa reazione rimane limitato.
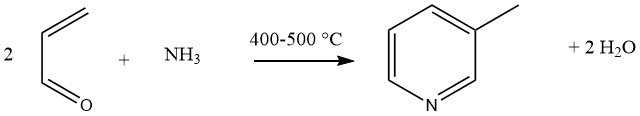
La condensazione in fase gassosa di acroleina e ammoniaca, catalizzata da catalizzatori multicomponente Al2O3 o SiO2-Al2O3, produce il 45% di 3-metilpiridina e il 20-25% di piridina come sottoprodotto. Questa reazione è stata generalizzata come sintesi universale per piridine sostituite.
L’acroleina reagisce con l’acido isocianurico per formare un addotto utile come agente di reticolazione. La reattività bifunzionale dell’acroleina è stata sfruttata in varie sintesi di eterocicli, come le reazioni con fenoli per produrre cromeni o cromani sostituiti e la reazione con 2-amminofenoli per produrre 8-chinolinoli.
Quando l’acroleina viene fatta reagire con un eccesso di fenolo in condizioni acide, si ottiene una miscela di polifenoli, con 1,1,3-tris(4-idrossifenil)propano come prodotto primario.
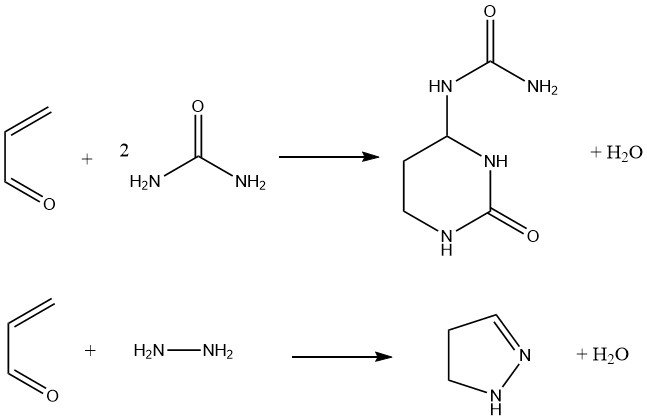
Inoltre, l’acroleina reagisce con l’urea per produrre esaidro-2-osso-4-pirimidinil urea, che è stata proposta come fertilizzante. La condensazione dell’acroleina con idrazina e idrazine sostituite fornisce pirazoline con una resa dell’80%.
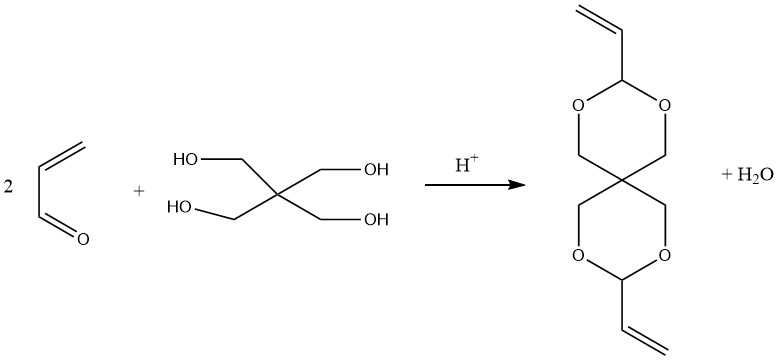
L’acroleina può reagire con la formaldeide in condizioni alcaline per produrre pentaeritritolo. Tuttavia, le rese sono inferiori rispetto alla sintesi commerciale di pentaeritritolo tramite acetaldeide e formaldeide.
Il bisolfito di sodio reagisce con l’acroleina per formare un addotto stabile chiamato sale disodico dell’acido 1-idrossipropan-1,3-disolfonico. Questa reazione trova una comoda applicazione per la deodorizzazione dell’acroleina versata.
2.5. Riduzione
La riduzione selettiva dell’acroleina ad alcol allilico in rese elevate (90%) può essere ottenuta tramite trasferimento di idrogeno da alcoli secondari, come il 2-propanolo, in una reazione Meerwein-Ponndorf nella fase liquida.
Nella fase gassosa, il trasferimento di idrogeno dall’etanolo o dal 2-propanolo su catalizzatori di ossido di magnesio o di ossido di terre rare a temperature comprese tra 300 e 500 °C porta anche alla produzione di alcol allilico.
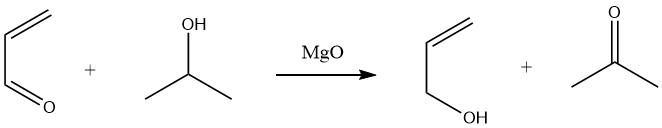
Tuttavia, l’idrogenazione catalitica dell’acroleina è meno selettiva o selettiva solo a conversioni molto basse.
2.6. Ossidazione
Facendo reagire l’acroleina con perossido di idrogeno acquoso a pH 8-8,5, si può ottenere glicidaldeide con rese dell’80-90%:
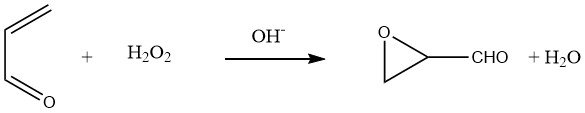
L’idratazione del gruppo ossirano nella glicidaldeide porta a una soluzione acquosa di D,L-gliceraldeide.
L’acido acrilico è prodotto commercialmente tramite l’ossidazione dell’acroleina con ossigeno molecolare.
2.7. Polimerizzazione
L’acroleina polimerizza facilmente quando riscaldata, esposta alla luce o in presenza di vari iniziatori. Le proprietà del polimero di acroleina risultante dipendono dalle condizioni di polimerizzazione, come il tipo di iniziatore, il solvente e la temperatura di reazione.
I gruppi funzionali dell’acroleina (vinile e aldeide) possono polimerizzare separatamente o insieme. La polimerizzazione avviata da radicali avviene esclusivamente nel gruppo vinilico, dando luogo a polimeri con gruppi aldeidici che formano facilmente strutture tetraidropiraniche. La polimerizzazione ionica produce principalmente polimeri con gruppi vinilici, insieme a polimeri contenenti sia gruppi aldeidici che vinilici.
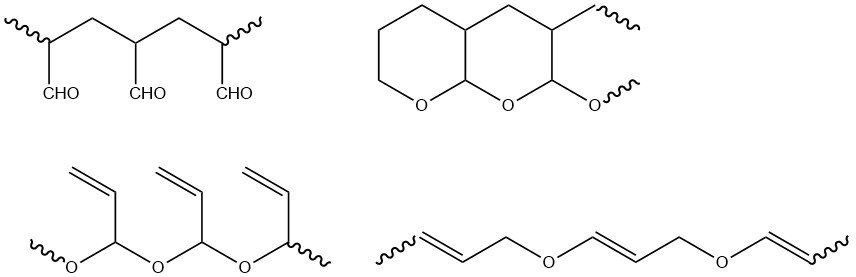
I polimeri radicalici sono infusibili e insolubili nei solventi comuni, mentre i prodotti di iniziazione anionica sono solubili in molti solventi organici. Oltre agli omopolimeri, sono stati sintetizzati copolimeri con vari comonomeri vinilici e acrilici.
I gruppi carbonilici della poliacroleina possono essere modificati chimicamente in condizioni blande. Molti derivati della poliacroleina sono solubili in solventi organici o persino in acqua. Questi polimeri hanno attirato l’interesse per la loro attività biocida, poiché l’acroleina viene rilasciata lentamente da essi.
Il metodo fotochimico (laser) è stato utilizzato per sintetizzare particelle ultrafini da miscele gassose di acroleina e alcuni composti organosiliconici. Le particelle di poliacroleina sono in fase di studio per le loro potenziali applicazioni nella nanotecnologia.
3. Produzione di acroleina
3.1. Acroleina mediante ossidazione del propene
Il primo processo commerciale per la produzione di acroleina fu sviluppato da Degussa nel 1942. Comportava la condensazione in fase vapore di acetaldeide e formaldeide, catalizzata da silicato di sodio su supporti di silice a temperature di 300-320 °C.
Questo metodo fu utilizzato fino al 1959, quando la Shell introdusse un nuovo processo basato sull’ossidazione in fase vapore del propene su un catalizzatore di ossido rameoso. Tuttavia, le prestazioni del catalizzatore in questo processo erano scarse.
Nel 1957, la Standard Oil of Ohio (Sohio) scoprì il sistema catalizzatore al molibdato di bismuto, che mostrava una selettività migliorata ma aveva ancora una bassa conversione del propene.
L’ossidazione del propene ad acroleina ha preso slancio con la scoperta del sistema bismuto molibdato-bismuto fosfomolibdato (Bi9PMo12O52 su un supporto di SiO2) da parte di Sohio. I catalizzatori commerciali includono anche ossidi di bismuto-molibdeno.
La catalisi dell’ossidazione del propene ad acroleina comporta due cicli di reazione: un ciclo di riduzione del catalizzatore (formazione selettiva del prodotto) e un ciclo di riossidazione del catalizzatore (rigenerazione reticolo-ossigeno). I siti attivi dei catalizzatori sono interfacce tra Fe2(MoO4)3 e β-CoMoO4, con il bismuto molibdato responsabile della selettività.
I moderni catalizzatori per la produzione di acroleina sono sistemi multicomponenti di ossidi metallici.
L’ottimizzazione di questi sistemi di catalizzatori è una sfida continua, con varie aziende chimiche che lavorano costantemente per migliorare le composizioni dei catalizzatori e le tecniche di preparazione. Vengono aggiunti ulteriori ossidi metallici come Co, Ni, P, Sb, W o K per bilanciare le proprietà redox del catalizzatore e migliorarne le prestazioni.
Negli attuali processi di produzione, il propene viene miscelato con aria e vapore e immesso in un reattore a letto fisso multitubolare azionato a temperature di 300-400 °C. L’effluente del reattore viene quindi raffreddato e il gas viene lavato con acqua o miscele di acqua/solvente per rimuovere i sottoprodotti.
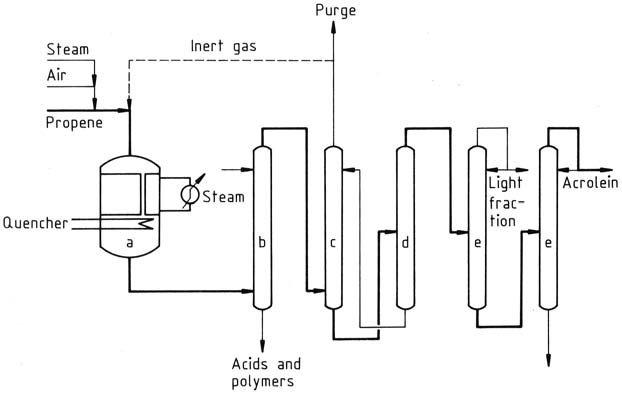
a) Reattore di ossidazione; b) Scrubber; c) Assorbitore; d) Desorbitore; e) Frazionatori
L’acroleina si ottiene assorbendo il gas in acqua fredda in un assorbitore. La soluzione acquosa di acroleina viene ulteriormente elaborata in una colonna di desorbimento per ottenere acroleina grezza, che viene poi distillata per purificare il prodotto.
I nuovi sviluppi nella produzione di acroleina si concentrano sul miglioramento della selettività e della resa del catalizzatore, riducendo al contempo il consumo di energia e le emissioni di CO2.
Si stanno esplorando percorsi alternativi per ottenere acroleina dal propano e si sta studiando la combinazione di deidrogenazione del propano e ossidazione selettiva del propene in acroleina.
Anche il processo metanolo in propene, che utilizza il metanolo come materia prima per la produzione di propene, sta acquisendo importanza nell’industria chimica.
4. Usi dell’acroleina
L’acroleina ha una vasta gamma di usi come intermedio chimico in vari settori. Alcuni dei principali usi dell’acroleina includono:
1. Biocida: l’acroleina è usata come biocida ad ampio spettro altamente efficace a basse concentrazioni, circa 10 ppm. È usata per controllare la crescita di erbacce acquatiche, alghe, molluschi e come disinfettante nei sistemi idrici. È anche usata nelle acque dei giacimenti petroliferi per eliminare l’acido solfidrico maleodorante.
2. Produzione di metionina: l’acroleina è usata principalmente nella produzione di metionina, che è un amminoacido essenziale e un integratore alimentare per animali. L’acroleina è anche usata per produrre l’analogo idrossilico della metionina, che è un integratore alimentare con una bioefficacia leggermente inferiore alla metionina.
3. Acido acrilico: l’acroleina è un precursore per la produzione di acido acrilico, che è una sostanza chimica importante usata per produrre acrilati. L’acido acrilico è ampiamente usato nella produzione di rivestimenti, adesivi, tessuti e vari polimeri.
4. 1,3-propandiolo: l’acroleina può essere utilizzata per produrre 1,3-propandiolo tramite un processo di idrolisi e idrogenazione. L’1,3-propandiolo trova applicazioni nella produzione di materiali compositi, adesivi, solventi e antigelo.
5. Glutaraldeide: l’acroleina è utilizzata nella produzione di glutaraldeide, che è una dialdeide versatile. La glutaraldeide è utilizzata nella concia delle pelli, nel trattamento delle acque, nelle applicazioni nei giacimenti petroliferi e come disinfettante e sterilizzante per apparecchiature mediche.
6. Piridine: l’acroleina può essere utilizzata per sintetizzare vari derivati della piridina, tra cui la 3-metilpiridina e altre piridine sostituite, che hanno applicazioni nei settori farmaceutico, dei pesticidi e delle fragranze.
7. Tetraidrobenzaldeide: l’acroleina può essere utilizzata nella produzione di tetraidrobenzaldeide, utilizzata nella sintesi di prodotti farmaceutici, fungicidi e fragranze.
8. Aromi e fragranze: l’acroleina e i suoi derivati sono utilizzati nella produzione di un’ampia gamma di aromi e fragranze, tra cui composti come lyral, myrac aldeide e 5-norbornene-2-carbaldeide.
9. Erbicidi: l’acetato di acroleina cianoidrina è utilizzato come intermedio nella produzione di fosfinotrycina, un erbicida non selettivo utilizzato nella protezione delle colture.
10. Altre applicazioni: l’acroleina è stata utilizzata in passato per la produzione di alcol allilico e glicerolo, ma questi processi sono stati interrotti. Può anche essere utilizzata per produrre D,L-gliceraldeide, che ha applicazioni nella concia delle pelli e in varie sintesi. I polimeri di acroleina, come l’acido polialdeide carbossilico, hanno applicazioni industriali come agenti sequestranti, trattamenti tessili, rinforzo della carta e biocidi.
Questi sono solo alcuni dei principali usi dell’acroleina e la sua versatilità come intermedio chimico consente potenziali applicazioni in vari settori.
Riferimento
- Acrolein and Methacrolein; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_149.pub2
