Acido sorbico: proprietà, reazioni, produzione e usi
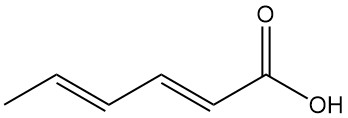
Cos’è l’acido sorbico?
L’isomero trans, trans dell’acido 2,4-esadienoico, comunemente noto come acido sorbico, è un acido grasso insaturo a catena corta con formula chimica C6H8O2. È un acido organico presente in natura che si presenta come un solido incolore con un leggero odore.
L’acido sorbico deriva il suo nome da “Sorbus aucuparia Linnaeus”, la nomenclatura scientifica del sorbo degli uccellatori. Nel 1859, Hofmann isolò un olio dall’odore caratteristico dalle bacche di sorbo acerbe per distillazione.
Il costituente principale di quest’olio era l’acido parasorbico, identificato come il d-lattone dell’acido sorbico. Gli acidi forti, o alcali, catalizzano la conversione dell’acido parasorbico in acido sorbico isomerico. Le bacche di sorbo acerbe contengono circa lo 0,1% di acido parasorbico.
L’acido sorbico si trova nei depositi grassi di alcuni afidi come 2-sorboil-1,3-dimiristina. Doebner determinò la struttura dell’acido sorbico nel 1890 e fu sintetizzato per la prima volta nel 1900.
Müller (Germania) e Gooding (Stati Uniti) scoprirono indipendentemente le proprietà antimicrobiche dell’acido sorbico nel 1939-1940. La produzione industriale di acido sorbico e sorbato di potassio iniziò negli anni ’50, inizialmente negli Stati Uniti, seguiti da Germania e Giappone.
L’acido sorbico è utilizzato come conservante alimentare primario per la sua sicurezza e le sue caratteristiche sensoriali favorevoli.
Sommario
1. Proprietà fisiche dell’acido sorbico
L’acido sorbico forma cristalli aghiformi o lamellari con un odore delicato e caratteristico e un sapore leggermente acidulo. La sua solubilità in acqua è limitata, con valori di 0,16 g, 0,58 g e 3,9 g per 100 mL rispettivamente a 20 °C, 50 °C e 100 °C.
La solubilità dell’acido sorbico in alcoli anidri a basso peso molecolare e acido acetico anidro è di circa 11-12 g per 100 mL. I grassi liquidi possono sciogliere 0,5-1 g di acido sorbico per 100 mL.
L’acido sorbico è volatile in vapore senza decomposizione. Questa proprietà viene utilizzata per il suo isolamento analitico dai prodotti alimentari.
Le principali proprietà fisiche dell’acido sorbico sono elencate nella tabella seguente.
| Proprietà | Valore |
|---|---|
| Numero CAS | [110-44-1] |
| Formula | C6H8O2 |
| Massa molecolare | 112,13 g/mol |
| Punto di fusione | 132–135 °C |
| Punto di ebollizione | 228 °C (decomposizione) |
| Temperatura di sublimazione | superiore a 60 °C |
| Indice di rifrazione | 1,4248 |
| Densità | 1,204 g/cm3 |
| Costante di dissociazione | 1,73×10-5 a 25 °C |
| pKa | 4,76 |
| Pressione di vapore a 20 °C | <0,001 kPa |
| Pressione di vapore a 100 °C | 0,25 kPa |
| Pressione di vapore a 120 °C | 1,3 kPa |
2. Reazioni chimiche dell’acido sorbico
La reattività dell’acido sorbico è caratterizzata dalla presenza di un gruppo carbossilico e di un sistema a doppio legame coniugato.
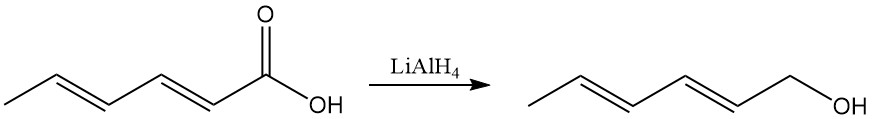
Le reazioni degli acidi carbossilici includono reazioni tipiche come la formazione di sali, esteri e altri derivati. L’idruro di litio e alluminio riduce selettivamente il gruppo carbossilico ad alcol sorbilico (2,4-esadien-1-olo).
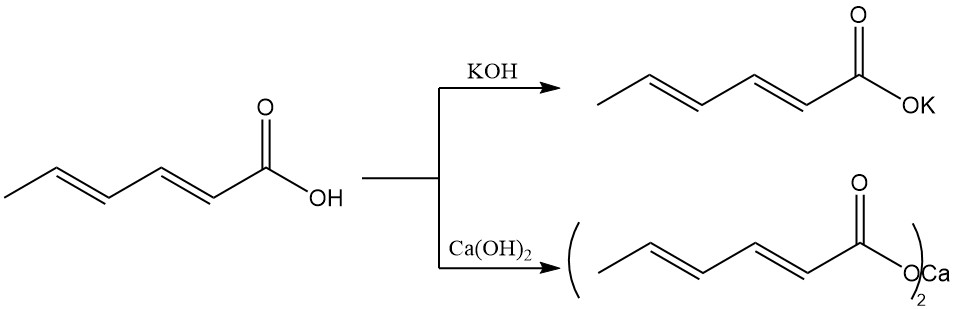
A differenza dell’acido sorbico, i sali alcalini hanno una maggiore solubilità in acqua, il che li rende preferiti per i sistemi di conservazione acquosi. Il sorbato di potassio è prodotto da acido sorbico e idrossido di potassio e ha una buona solubilità in acqua.
Il sorbato di calcio è prodotto da acido sorbico e idrossido di calcio ed è caratterizzato da una bassa solubilità in acqua.
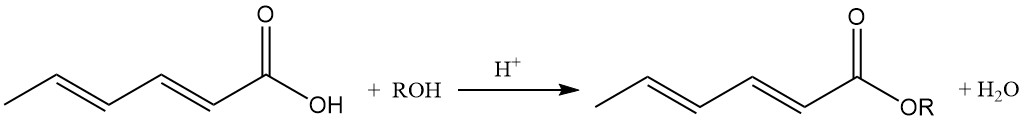
Gli esteri sorbati alchilici inferiori possiedono proprietà antimicrobiche e sono attivi in ambienti neutri e debolmente alcalini, a differenza dell’acido sorbico.
Le reazioni che coinvolgono il sistema a doppio legame spesso producono miscele di prodotti complesse a causa delle diverse reattività del doppio legame e delle potenziali isomerizzazioni, riarrangiamenti, migrazioni e polimerizzazioni.
Le reazioni di addizione e di idrogenazione parziale hanno come bersaglio preferenziale il doppio legame 4,5.
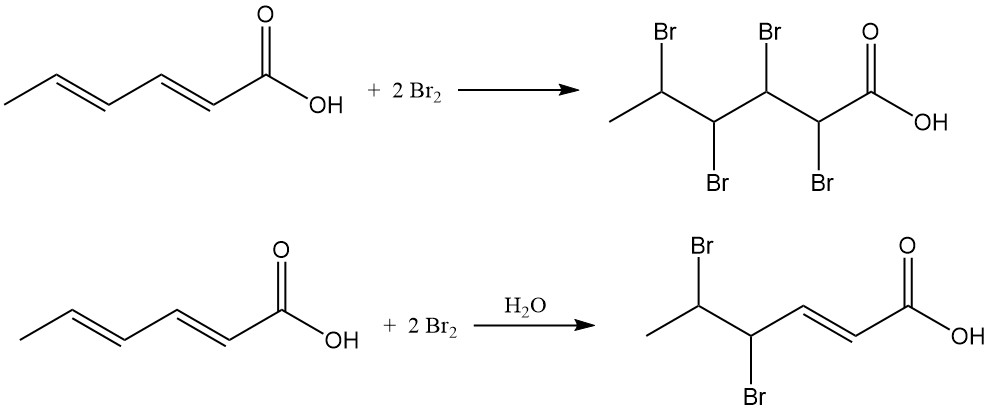
L’addizione di cloro produce miscele di acido cloroesenoico con un contenuto medio di cloro del 38-48% in peso. La reazione del bromo con acido sorbico in solventi organici produce acido 2,3,4,5-tetrabromoesanoico, mentre la bromurazione acquosa produce principalmente acido 4,5-dibromo-2-esenoico.
Nonostante la sua doppia insaturazione, l’acido sorbico cristallino puro mostra un’elevata resistenza all’ossidazione atmosferica, rimanendo stabile per anni a temperatura ambiente. Tuttavia, impurità come solventi, metalli pesanti o acidi esadienoici isomerici ne riducono significativamente la stabilità.
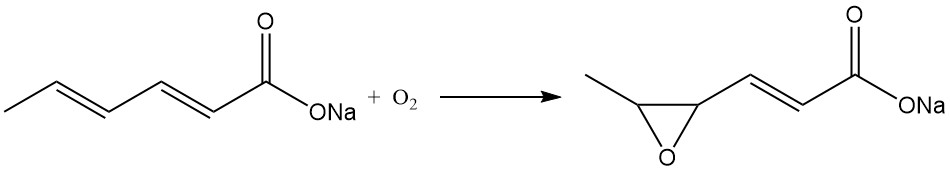
Considerazioni simili valgono per il sorbato di potassio, mentre il sorbato di sodio è instabile in forma solida e non viene prodotto commercialmente. Il sorbato di sodio si converte rapidamente nel sale sodico dell’acido 4,5-epossi-2-esenoico in presenza di aria.
L’ossidazione di sorbati acquosi o acido sorbico in solventi organici genera numerosi composti carbonilici, sebbene questa reazione dipenda dalla presenza di una grande quantità di ossigeno e sia fortemente aumentata dall’esposizione alla luce solare.
Le soluzioni prive di ossigeno mantengono la stabilità anche sotto l’esposizione alla luce. L’acido sorbico negli alimenti a umidità intermedia subisce una degradazione graduale nell’arco di mesi in presenza di aria.
L’ossidazione di soluzioni acquose acide di acido sorbico con bicromato di potassio produce malonaldeide. La reazione della malonaldeide con acido 2-tiobarbiturico produce un addotto rosso fluorescente 1:2 (malonaldeide:acido 2-tiobarbiturico), utilizzato come indicatore di colore nell’analisi dell’acido sorbico.
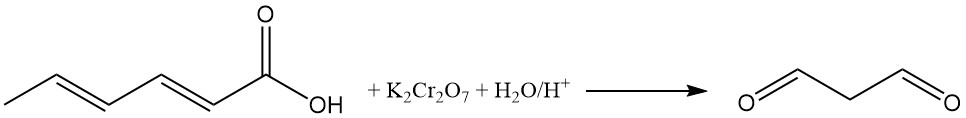
Una volta incorporato negli alimenti, la stabilità dell’acido sorbico corrisponde generalmente a quella di componenti alimentari essenziali come vitamine, aromi e sapori. Pertanto, il potenziale teorico di autossidazione dell’acido sorbico pone minime sfide pratiche in termini di conservazione.
3. Produzione dell’acido sorbico
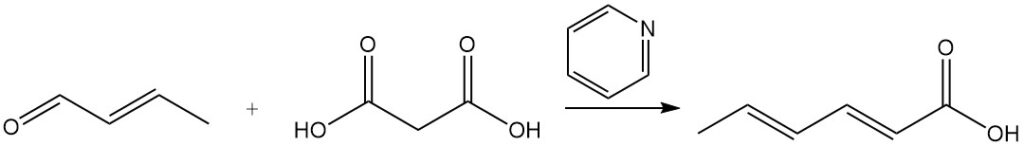
L’acido sorbico è stato inizialmente sintetizzato con il processo Doebner, che prevedeva una reazione di condensazione tra crotonaldeide e acido malonico in piridina. Sebbene molte altre sintesi utilizzino principi simili, la maggior parte di esse sono commercialmente impraticabili a causa delle basse rese, dei materiali di partenza costosi o degli elevati costi di produzione.
Questo vale anche per un processo Union Carbide degli anni ’50-’60 che ossidava il 2,4-esadienale ad acido sorbico con catalizzatori. Il processo fu abbandonato a causa della formazione di acidi esadienoici isomerici fino al 20%, meno stabili dell’acido sorbico e che richiedono una purificazione complessa. Anche i microrganismi possono ossidare il 2,4-esadienale ad acido sorbico.
In alternativa, l’acido sorbico può essere prodotto isomerizzando l’acido 2,5-esadienoico (1) mediante ebollizione con soluzione alcalina acquosa. L’acido 2,5-esadienoico si forma per reazione del cloruro di allile con acetilene, monossido di carbonio e acqua utilizzando un catalizzatore al tetracarbonilnichel.
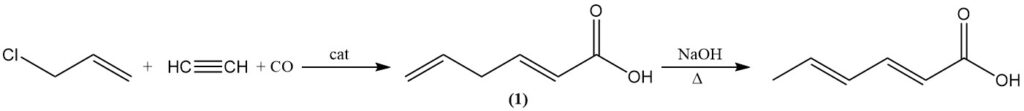
La scissione acida del 5-vinil-γ-butirrolattone, ottenuta da 1,3-butadiene e acido acetico con catalizzatori redox, non ha rilevanza industriale. Un’altra possibile sintesi è l’addizione di anidride carbonica all’1,3-pentadiene in presenza di complessi di nichel.
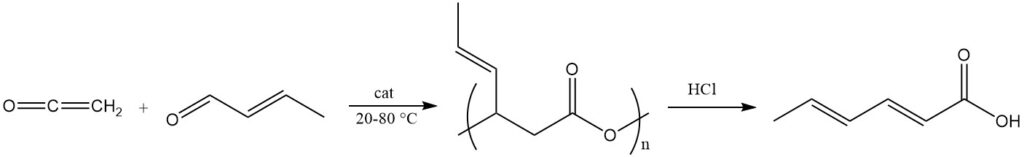
Un processo comune utilizza chetene e crotonaldeide in presenza di sali di metalli di transizione bivalenti come catalizzatori a una temperatura di 20-80 °C per produrre un estere polimerico dell’acido 3-idrossi-4-esenoico con una massa molecolare approssimativa di 2000.
Questo poliestere viene scisso per produrre acido sorbico utilizzando un trattamento basico o acido (ad esempio, acido cloridrico) o catalizzatori a complessi metallici. Questo poliestere viene anche utilizzato come precursore per la sintesi di esteri sorbati mediante reazioni con alcoli in presenza di catalizzatori di esterificazione acidi.
L’acido sorbico grezzo viene purificato mediante ricristallizzazione da una soluzione acquosa, miscele di acqua e alcol o di acetone, o solventi organici immiscibili in acqua come l’acetato di metile. Sono stati segnalati anche trattamenti con solventi organici e distillazione a vapore.
4. Usi dell’acido sorbico
L’acido sorbico e i suoi sali (principalmente sorbati di potassio e di calcio) sono utilizzati principalmente come conservanti grazie al loro basso profilo di tossicità. È attivo contro muffe e lieviti. I principali campi di applicazione includono:
- Alimenti: formaggi (varie tipologie), prodotti da forno, prodotti a base di frutta (prugne, polpe, marmellate, confetture, succhi, gelatine e caramelle), vino, verdure fermentate, margarina, burro e salumi.
- Mangimi per animali
- Tabacco
- Cosmetici
- Prodotti farmaceutici
- Materiali di imballaggio per alimenti, mangimi, cosmetici e prodotti farmaceutici
- Altri prodotti a contatto con la pelle umana o animale
È importante notare che, sebbene i potenziali usi dell’acido sorbico nelle reazioni chimiche e nelle polimerizzazioni siano stati esplorati nella letteratura brevettuale, queste applicazioni rimangono commercialmente insignificanti a causa del suo costo relativamente elevato.
L’acido sorbico può anche essere utilizzato come additivo nella produzione di gomma a freddo e come intermedio nel processo di produzione di alcuni plastificanti e lubrificanti.
5. Tossicologia dell’acido sorbico
L’acido sorbico presenta una bassa tossicità acuta, con una DL50 di circa 10 g/kg di peso corporeo nei ratti. Studi riportano valori simili, compresi tra 7,4 e 8,7 g/kg. Sebbene l’acido sorbico possa irritare le mucose a causa della sua natura acida, l’irritazione cutanea è rara.
Sono state condotte ampie indagini tossicologiche sull’acido sorbico a causa della sua precoce introduzione come conservante alimentare e dei requisiti obbligatori per i test. Studi acuti, subacuti, subcronici e cronici dimostrano costantemente un elevato profilo di sicurezza.
L’acido sorbico ha un basso potenziale allergenico grazie alle sue piccole dimensioni molecolari, che prevengono la formazione di anticorpi e il legame proteico covalente, che sono tipicamente associati a ipersensibilità immediata. I casi di reazioni pseudoallergiche all’acido sorbico come additivo alimentare sono rari.
Studi subcronici su ratti mostrano un aumento della crescita e del peso del fegato a dosi elevate di acido sorbico (10% nel mangime), che è stato interpretato come ipertrofia dovuta a un aumento del carico metabolico piuttosto che a tossicità.
Studi alimentari a lungo termine (due anni) su ratti e topi non dimostrano effetti cancerogeni a basse concentrazioni di acido sorbico (1,5-10% nel mangime). Dosi più elevate (10%) portano a un ridotto aumento di peso e a un ingrossamento di tiroide, fegato e reni.
L’acido sorbico non è né teratogeno né mutageno o genotossico e non è cancerogeno.
Metabolicamente, l’acido sorbico subisce una β-ossidazione simile ad altri acidi grassi.
Sia l’acido sorbico che il sorbato di potassio mostrano un basso potenziale allergenico e fototossico. È stato segnalato un singolo caso di reazione allergica di tipo 4 nonostante l’uso diffuso da oltre 40 anni. Il gruppo di esperti del Cosmetic Ingredient Review (CIR) classifica entrambe le sostanze come “sicure” per i cosmetici.
Il sorbato di sodio, poco utilizzato negli alimenti a causa della sua suscettibilità all’ossidazione, mostra una bassa tossicità genetica in vitro, a differenza dell’acido sorbico e del sorbato di potassio.
Riferimenti
- Sorbic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_507.pub2
- https://pubmed.ncbi.nlm.nih.gov/2079232/
Sono un chimico organico appassionato e continuo ad apprendere su vari processi di chimica industriale e prodotti chimici. Garantisco che tutte le informazioni su questo sito web siano accurate e meticolosamente referenziate ad articoli scientifici.
