Acido ossalico: produzione, reazioni e utilizzi
Cos’è l’acido ossalico?
L’acido ossalico è l’acido dicarbossilico saturo più semplice con la formula C2H2O4. È un solido bianco che si trova in natura sotto forma di diidrato. Il composto anidro deve essere prodotto dal diidrato anche quando viene prodotto industrialmente.
L’acido ossalico si trova in natura in molte piante, tra cui verdure a foglia verde, ortaggi, frutta, cacao, noci e semi. Si trova anche nelle foglie di rabarbaro e in alcuni tipi di fagioli.
È noto da molto tempo ed è stato identificato per la prima volta da WIEGLEB nel 1769 nel sale di potassio dell’acetosa.
Sommario
1. Produzione di acido ossalico
Esistono numerosi processi industriali utilizzati nella produzione di acido ossalico, che sono stati implementati da varie aziende e sono ancora in uso oggi.
In generale, solo tre tipi di composti sono utilizzati come materie prime nella produzione di acido ossalico. Questi includono carboidrati (come melassa ed etilenglicole), olefine e monossido di carbonio.
In tutti i processi industriali, l’acido ossalico è ottenuto come diidrato cristallino. Le sezioni seguenti descrivono quattro metodi che sono attualmente utilizzati a livello industriale. Tre di questi metodi si basano sull’ossidazione dell’acido nitrico e uno è una sintesi che utilizza monossido di carbonio.
1.1. Produzione di acido ossalico tramite ossidazione dei carboidrati
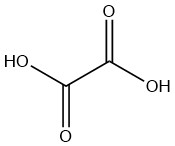
Questo metodo, che è il più antico delle produzioni chimiche, è stato scoperto per la prima volta da SCHEELE più di 200 anni fa nel 1776. Ha ossidato lo zucchero con acido nitrico concentrato per produrre acido ossalico.
Tuttavia, fu solo intorno al 1940 che questo processo acquisì importanza industriale, quando gli ossidi di azoto prodotti nella reazione poterono essere recuperati e riciclati.
In Germania, la I.G. Farben produsse 2000 tonnellate di acido ossalico all’anno utilizzando questo metodo fino al 1944. Questo processo è attualmente utilizzato in Brasile, Cina e in diversi paesi dell’Europa orientale.
Le materie prime utilizzate in questo processo includono zucchero, glucosio, fruttosio, amido di mais, amido di frumento, amido recuperato, amido di patate, pannocchie di mais, tapioca e melassa.
La selezione dei materiali di partenza per la produzione di acido ossalico dipende dalla disponibilità, dal costo e dall’ottimizzazione del processo di reazione.
Materie prime diverse possono comportare rese variabili e la formazione di schiuma, grassi e melma, che devono essere gestiti in modo appropriato.
La melassa e altri rifiuti agricoli sono diventati sempre più popolari come materie prime grazie al loro basso costo e ai benefici ambientali del loro utilizzo.
La melassa, che è un sottoprodotto della raffinazione dello zucchero, contiene composti contenenti azoto che vengono per lo più eliminati durante l’ossidazione dell’acido nitrico, nonostante causino un’eccessiva formazione di schiuma durante la reazione.
Nel caso di utilizzo di materiali a base di amido come materie prime, devono prima essere idrolizzati in glucosio in una fase separata in batch prima dell’ossidazione.
La soluzione di glucosio idrolizzata viene miscelata con acido solforico, pentossido di vanadio (0,001-0,05% in peso) e solfato di ferro (III) (0,39-0,8% in peso) in un reattore.
L’acido nitrico (65%) viene quindi aggiunto lentamente sotto energica agitazione entro un intervallo di temperatura strettamente controllato di circa 70 °C, variabile in base alla materia prima.
La reazione è fortemente esotermica e deve essere ben raffreddata.
Contemporaneamente, viene fornita aria al reattore per supportare la reazione e rimuovere NO e altri ossidi di azoto a basso numero di ossidazione. Gli ossidi di azoto espulsi vengono raccolti in un sistema di adsorbimento e riciclati dopo l’ossidazione.
L’acido ossalico grezzo si ottiene mediante raffreddamento e centrifugazione della miscela di reazione, seguita da dissoluzione in acqua calda, separazione del grasso, ricristallizzazione, una seconda centrifugazione ed essiccazione per ottenere acido ossalico diidrato con purezza superiore al 99%.
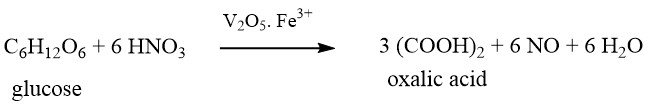
1.2. Produzione di acido ossalico mediante ossidazione di glicole etilenico
L’ossidazione di glicole etilenico con acido nitrico è un processo in un’unica fase. Si utilizza una miscela ossidante di acido solforico al 30-40% e acido nitrico al 20-25% e la reazione viene condotta a 50-70 °C e pressione atmosferica in presenza di pentossido di vanadio e sali di ferro (III). Il sottoprodotto formato durante questa reazione è solo CO2.
Il processo di produzione dell’acido ossalico ha subito notevoli miglioramenti da parte della Mitsubishi Gas Company, con il risultato che il Giappone si affida principalmente a questo metodo.
La tecnica migliorata comporta l’uso di un reattore a pressione che funziona a circa 10 bar. L’acido nitrico (circa il 60%), così come l’acido solforico (ove applicabile), vengono sottoposti a ossigeno pressurizzato, mantenendo una temperatura di 80 °C.
Successivamente, il glicole etilenico viene introdotto in modo continuo e la temperatura e la pressione della reazione vengono mantenute tramite l’aggiunta di ossigeno. È necessario un raffreddamento efficace per impedire che la reazione esotermica superi i 50-70 °C.
La resa in uscita dell’acido ossalico, basata sul glicole etilenico, varia tra il 90-94% del massimo teorico. In particolare, la maggior parte dell’acido nitrico utilizzato può essere recuperata. Ciò suggerisce che gli ossidi di azoto e l’acido nitrico agiscono semplicemente come catalizzatori nel processo di ossidazione, con l’ossigeno che funge da agente ossidante primario.
Possono essere utilizzati anche materiali di partenza alternativi, come glicole propilenico, acetaldeide o acido glicolico. Per migliorare l’efficienza, si raccomandano composti di vanadio (0,001 – 0,1% in peso) come promotori. Possono essere impiegati anche iniziatori come nitrito di sodio, acido formico o formaldeide.
1.3. Produzione di acido ossalico mediante ossidazione del propene
La produzione di acido ossalico mediante reazione di propene e acido nitrico è il secondo processo industriale più significativo dopo l’ossidazione dei carboidrati.
Nel 1978, questo metodo rappresentava 65.000 t/a di produzione globale di acido ossalico. I sottoprodotti della raffineria petrolchimica, vale a dire propene puro o frazioni ricche di propene, servono come materie prime fattibili per questa reazione.
Rhone-Poulenc, una società francese, ha migliorato significativamente il processo introducendo progressi tecnici di ingegneria e costruzione, mantenendo al contempo una rigorosa aderenza alle condizioni di reazione.
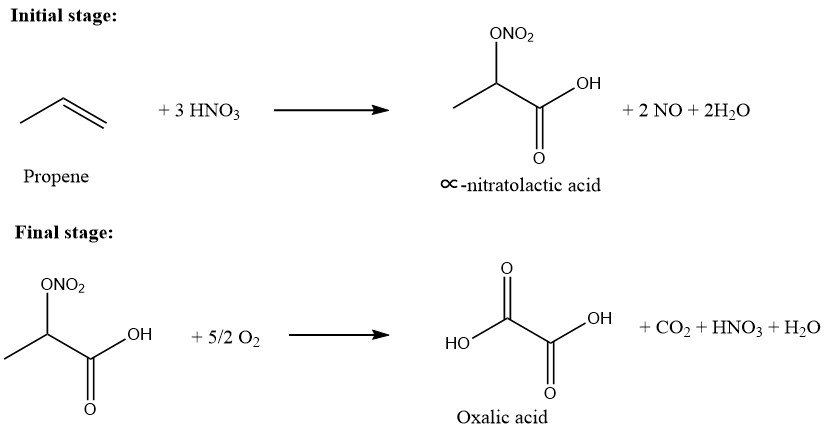
Il processo di ossidazione del propene ad acido ossalico comprende due fasi primarie.
Nella fase iniziale, il propene viene introdotto in una soluzione di acido nitrico (50-75% in peso) a una temperatura compresa tra 10 e 40 °C. Il rapporto molare tra propene e acido nitrico viene mantenuto tra 0,01/1,0 e 0,5/1,0. Questa fase produce acido ∝-nitratolattico solubile in acqua e intermedi di acido lattico.
Nella seconda fase, l’ossigeno viene introdotto nella soluzione contenente i prodotti parzialmente ossidati in presenza di un catalizzatore, a una temperatura compresa tra 45 e 100 °C.
L’acido ossalico risultante viene successivamente cristallizzato, filtrato e recuperato. La resa complessiva, basata sul propene, è di circa il 90% e la conversione del propene è quasi del 100%.
Gli ossidi di azoto generati nel secondo reattore vengono eliminati e recuperati. Il consumo di acido nitrico in questo processo è di 1,2 kg per kg di acido ossalico diidrato prodotto.
Per migliorare la resa vengono aggiunti catalizzatori contenenti sali o composti di Fe, Al, Cr, Sn, Bi o I. In questo processo, vengono utilizzati nitrato di cromo (III), nitrato di ferro (III) o cloruro di stagno (II) in quantità pari allo 0,4-0,5% in peso (in base al metallo) e disciolti in acido nitrico al 65% per migliorare l’efficienza.
1.4. Produzione di acido ossalico da monossido di carbonio
Ube Industries ha sviluppato il processo più recente per la produzione industriale di acido ossalico, che prevede due fasi. Nella prima fase, CO e un alcol inferiore vengono fatti reagire sotto pressione e in presenza di un catalizzatore per formare il corrispondente diestere di acido ossalico.
Nella seconda fase, l’idrolisi di questo diestere determina la formazione di acido ossalico e dell’alcol originale, che viene riciclato. La reazione è catalizzata dal palladio su carbone e nitriti alchilici, e condotta a una pressione di 10-11 MPa. L’alcool e il solvente preferiti sono l’n-butanolo.
Sebbene questo processo tragga vantaggio dall’uso di materiali di partenza poco costosi, presenta notevoli svantaggi dovuti all’investimento di capitale molto più elevato (dovuto ai requisiti di alta pressione) e ai costi di utenza.
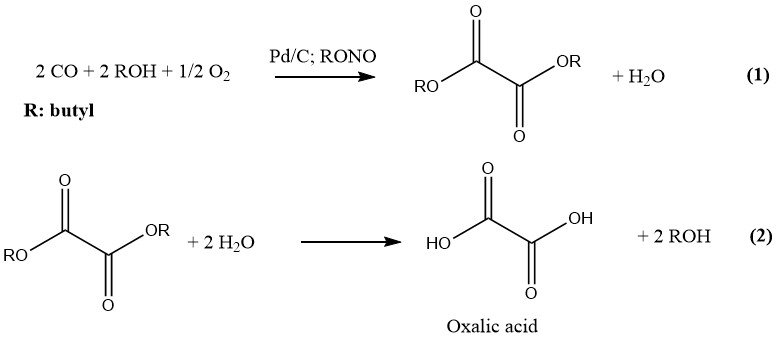
Il nitrito di butile e il nitrito di metile sono i nitriti alchilici preferiti per scopi industriali, grazie alla loro idoneità nella produzione di acido ossalico. Un impianto costruito nel 1978 impiegava il nitrito di butile nella produzione di acido ossalico a una velocità di 6000 t/a.
Il nitrito di butile offre diversi vantaggi in questo processo, tra cui la sua funzione sia come componente di reazione che come agente disidratante. Il punto di ebollizione più alto del nitrito di butile rispetto all’acqua e al nitrito di butile consente la rimozione dell’acqua formata come miscela azeotropica, lasciando la maggior parte del nitrito di butile nel sistema.
Il nitrito di butile recuperato può essere riutilizzato dopo la separazione. Il nitrito di butile viene infine idrolizzato a butanolo, che può essere facilmente separato dalla soluzione di acido ossalico mediante separazione di fase.
La reazione per la produzione di acido ossalico utilizzando nitrito di butile e un catalizzatore al palladio avviene in una torre di reazione. Un liquido di circolazione contenente nitrito di butile, butanolo e catalizzatore al palladio, nonché un gas di circolazione contenente monossido di carbonio e ossigeno, vengono pressurizzati e immessi nella torre.
La reazione esotermica tra nitrito di butile e monossido di carbonio determina la formazione di ossalato di dibutile e la rigenerazione simultanea di nitrito di butile. La reazione viene condotta a una temperatura di 90-100 °C e una pressione di 10-11 MPa per ottimizzare la selettività per l’ossalato di dibutile.
La concentrazione di ossigeno nella torre di reazione viene mantenuta al di sotto del limite di esplosione dalla circolazione del gas, che migliora anche l’utilizzo del monossido di carbonio e la velocità di contatto gas-liquido.
La soluzione rilasciata dalla torre viene fatta evaporare per far evaporare il gas di anidride carbonica formato come sottoprodotto. L’acqua formata durante la reazione viene rimossa tramite distillazione azeotropica con nitrito di butile e la maggior parte della soluzione viene riciclata nella torre di reazione.
Parte della soluzione viene ulteriormente elaborata per produrre ossalato di dibutile puro, che si ottiene dopo la separazione di catalizzatori, nitrito di butile e butanolo.
Il catalizzatore di palladio, il nitrito di butile e il butanolo vengono recuperati e restituiti al liquido di circolazione, che viene anche rifornito di butanolo di reintegro e acido nitrico. Il liquido di circolazione viene quindi pressurizzato e reimmesso nella torre di reazione.
L’ossalato di dibutile raffinato viene miscelato con il liquore madre dalla cristallizzazione dell’acido ossalico e idrolizzato a circa 80 °C in acido ossalico e butanolo.
La soluzione di acido ossalico e il butanolo vengono separati mediante separazione di fase. L’acido ossalico diidrato viene quindi cristallizzato dalla soluzione di acido ossalico e il butanolo viene riciclato nel processo dopo la raffinazione.
2. Reazioni chimiche dell’acido ossalico
Il comportamento dell’acido ossalico è unico a causa dell’interazione tra gruppi carbossilati adiacenti, che determina un aumento della costante di dissociazione e una facilità di decarbossilazione.
Con un rapido riscaldamento a 100 °C, l’acido ossalico si decompone in monossido di carbonio, anidride carbonica e acqua, con l’acido formico come intermedio isolabile.
La decomposizione dell’acido ossalico in soluzioni acquose può essere indotta dalla luce e, in misura maggiore, dai raggi γ o X, con conseguente formazione di monossido di carbonio, anidride carbonica, acido formico e occasionalmente idrogeno. I sali di metalli pesanti, come i sali di uranile, catalizzano questa decomposizione.
L’acido ossalico non può formare un’anidride intramolecolare, ma può essere decomposto in monossido di carbonio, anidride carbonica e acqua riscaldandolo a oltre 190 °C o riscaldandolo in acido solforico o fosforico concentrato. Questa decomposizione non è esotermica.
Le proprietà riducenti dell’acido ossalico costituiscono la base per le sue applicazioni pratiche, in quanto può essere facilmente ossidato nei prodotti finali innocui anidride carbonica e acqua da una varietà di agenti ossidanti, tra cui aria e sali di metalli pesanti.
L’acido ossalico è facilmente esterificato, producendo monoesteri acidi o diesteri neutri come intermedi nelle sintesi chimiche. Questi esteri reagiscono facilmente con acqua, ammoniaca o ammine per produrre i corrispondenti derivati acilici.
Anche i sali metallici dell’acido ossalico dimostrano importanti caratteristiche chimiche, esistendo come sali acidi o neutri. I sali di metalli alcalini e di ferro (III) sono facilmente solubili in acqua, mentre tutti gli altri sali sono scarsamente solubili.
La quasi completa insolubilità dei sali alcalino-terrosi, in particolare l’ossalato di calcio, trova applicazioni nell’analisi quantitativa. Quando riscaldati, questi sali metallici perdono monossido di carbonio e alcuni sali più facilmente decomponibili perdono anche anidride carbonica. I sali alcalini e alcalino-terrosi formano carbonati in queste condizioni.
I sali metallici di manganese, zinco e stagno formano ossidi, mentre i sali di ferro, cadmio, mercurio e rame formano miscele di ossidi e metalli. I sali di nichel, cobalto e argento forniscono metalli puri. La fusione anidra di ossalati con alcali produce carbonati e idrogeno.
3. Usi dell’acido ossalico
Per quanto riguarda le sue applicazioni come intermedio sintetico, l’acido ossalico o i suoi sali sono stati utilizzati principalmente come agenti riducenti, che producono prodotti finali innocui di anidride carbonica e acqua, nonché precipitanti per ioni calcio o come agenti complessanti per i sali di metalli pesanti.
3.1. Trattamento dei metalli
I metalli pesanti, in particolare il ferro, formano doppi sali solubili con ossalati di sodio, potassio o ammonio.
L’ossalato di ferro (III) è l’unico sale di metallo pesante facilmente solubile. I sali di acido ossalico vengono quindi impiegati per rimuovere la ruggine dai sistemi di raffreddamento (come i radiatori delle automobili), dalle caldaie o dalle piastre di acciaio prima della fosfatazione.
Possono anche essere usati per rimuovere le venature di ferro dal marmo, come costituente di detergenti per metalli con protezione dalla ruggine, in particolare per rame, argento o alluminio, nell’anodizzazione dell’alluminio e nella creazione di rivestimenti molto duri, antiabrasione e anticorrosione, dove l’uso di additivi conferisce colori superficiali diversi all’alluminio.
L’acido ossalico viene anche impiegato nei materiali di pulizia per dispositivi elettronici e come rivestimenti per la protezione di acciaio inossidabile, leghe di nichel, cromo, acciai legati e titanio.
3.2. Trattamento tessile
L’acido ossalico viene utilizzato come mordente nella stampa e nella tintura di lana e cotone. Viene utilizzato come agente di sverniciatura per i colori della lana per ottenere effetti di motivi speciali, come ausiliario nella stampa a scarica caustica di indaco e nella tintura in tino come agente riducente per il bicromato di potassio.
Nelle lavanderie, l’acido ossalico viene utilizzato per rimuovere le macchie di ruggine e neutralizzare l’alcalinità, e ha anche proprietà antibatteriche.
L’acido ossalico può essere impiegato come catalizzatore per la reticolazione di agenti di finitura tessile nella pressatura permanente di tessuti di cellulosa e per l’ignifugazione.
3.3. Agenti sbiancanti
L’acido ossalico viene utilizzato nella concia e nello sbiancamento della pelle, nonché nello sbiancamento di sughero, legno (in particolare legno impiallacciato), paglia, canna, piume e cere naturali e sintetiche.
La maggior parte dell’acido ossalico viene impiegata per lo sbiancamento del legno da polpa.
Nella lavorazione della pelle, l’acido ossalico viene utilizzato per lo sbiancamento al posto del ditionito di sodio.
Riferimento
- Oxalic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a18_247.pub2
