Acido malonico: proprietà, reazioni, produzione e usi
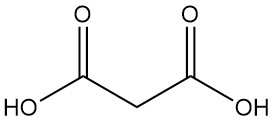
Cos’è l’acido malonico?
L’acido malonico, noto anche come acido propandioico o acido metandicarbossilico, è un acido dicarbossilico con formula chimica C3H4O4. È un solido incolore e igroscopico che sublima nel vuoto. La forma ionizzata dell’acido malonico, così come i suoi esteri e sali, sono noti come malonati.
Sommario
1. Proprietà fisiche dell’acido malonico
L’acido malonico è un solido bianco, igroscopico, molto solubile in acqua (139 g in 100 g di acqua a 22 °C) e solubile in piridina (15 g in 100 g di piridina a 15 °C). È leggermente solubile in etanolo ed etere dietilico e insolubile in benzene.
Le proprietà fisiche dell’acido malonico sono elencate nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero di registro CAS | [141-82-2] |
| Formula molecolare | C3H4O4 |
| Peso molecolare | 104,06 g/mol |
| Punto di fusione | 134 – 138 °C |
| Punto di ebollizione point | Si decompone a 140 °C |
| Densità | 1,62 g/cm³ |
| pKa1 | 2,83 |
| pKa2 | 5,70 |
| Punto di infiammabilità | 157 °C |
2. Reazioni dell’acido malonico
L’acido malonico si trova in piccole quantità nella barbabietola da zucchero e nel grano verde ed è formato dalla degradazione ossidativa dell’acido malico.
L’acido malonico mostra reazioni tipiche degli acidi carbossilici e un’elevata reattività del gruppo metilenico centrale a causa dell’acidità degli atomi di idrogeno in posizione 2.
L’acido malonico reagisce come la maggior parte degli acidi carbossilici per produrre ammidi, esteri, anidridi e cloruri acidi.
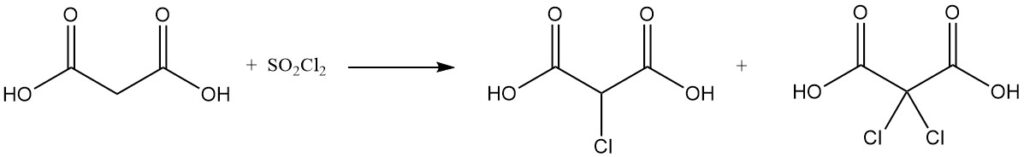
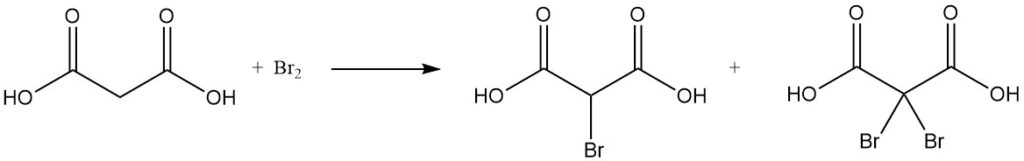
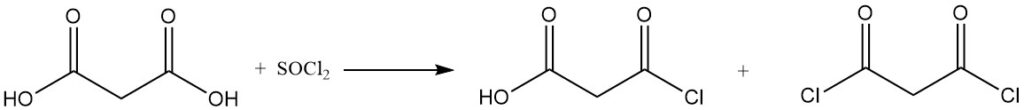
La reazione dell’acido malonico con cloruro di solforile o bromo produce derivati mono- o dialogenati, mentre il cloruro di tionile o il pentacloruro di fosforo formano cloruri mono- o diacilici.
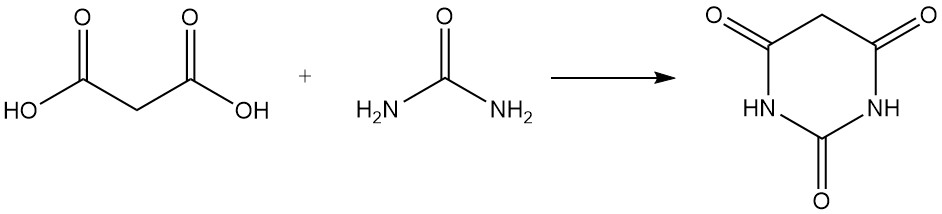
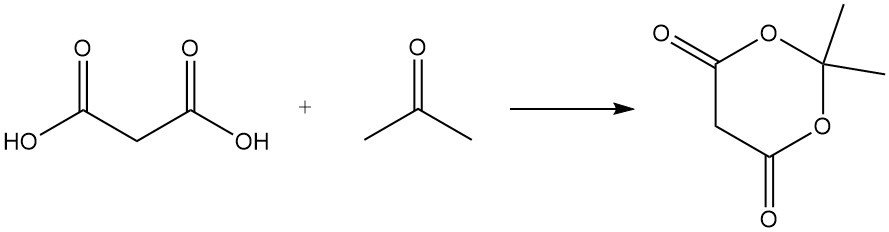
L’acido malonico reagisce con l’urea per produrre acido barbiturico, un precursore di vari farmaci, e con l’acetone per formare l’acido di Meldrum, un importante intermedio nella sintesi organica.
A differenza dei tipici acidi carbossilici, riscaldando l’acido malonico con anidride fosforica non si produce un’anidride, bensì subossido di carbonio, un gas tossico che riforma facilmente l’acido malonico a contatto con l’acqua.
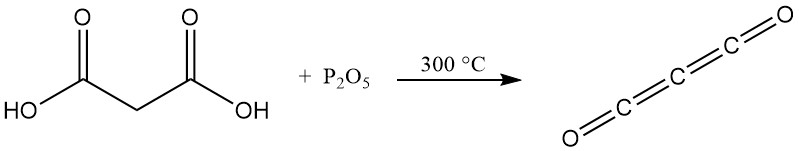
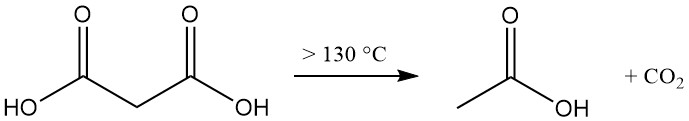
La decomposizione termica dell’acido malonico a temperature superiori a 130 °C (acido libero) o 70 °C (soluzione acquosa) produce acido acetico e anidride carbonica.
I mono- e dianioni dell’acido malonico sono più stabili rispetto all’acido libero. In soluzioni acquose, il malonato monosodico si decompone sopra i 90 °C, mentre il malonato disodico si decompone sopra i 130 °C.
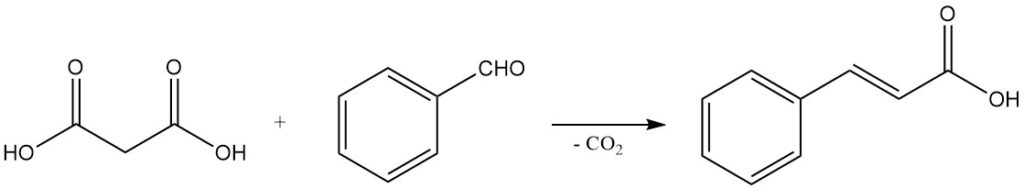
Il comportamento di decarbossilazione blando, unito alla capacità di subire condensazioni di Knoevenagel, rende l’acido malonico un reagente importante per la sintesi di acidi carbossilici α,β-insaturi. Ad esempio, la reazione con la benzaldeide produce acido cinnamico e le reazioni con aldeidi alifatiche producono acidi acrilici.
La ricerca ha anche esplorato i complessi di platino dell’acido malonico e dei suoi derivati come potenziali agenti antitumorali.
3. Produzione industriale dell’acido malonico
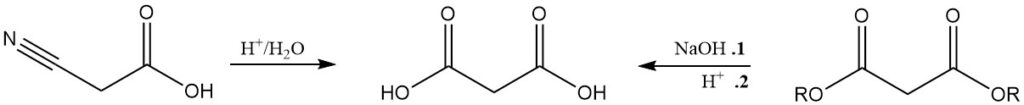
Sebbene meno significativo della produzione di malonato, l’acido malonico è comunemente prodotto dall’idrolisi dell’acido cianoacetico o dalla saponificazione acida dei malonati.
Sono stati segnalati anche metodi emergenti per la produzione di acido malonico, che includono l’ozonolisi del ciclopentadiene, l’ossidazione dell’aria catalizzata dal palladio del 1,3-propandiolo, l’ossidazione catalizzata da metallo della 3-idrossipropionaldeide o dell’acido 3-idrossipropionico e la conversione biocatalitica del malononitrile utilizzando un enzima nitrilasi.
La prima sintesi di laboratorio dell’acido malonico, ottenuta nel 1858, ha comportato la decomposizione ossidativa dell’acido malico utilizzando bicromato di potassio. Questo metodo non è comunemente utilizzato oggi.
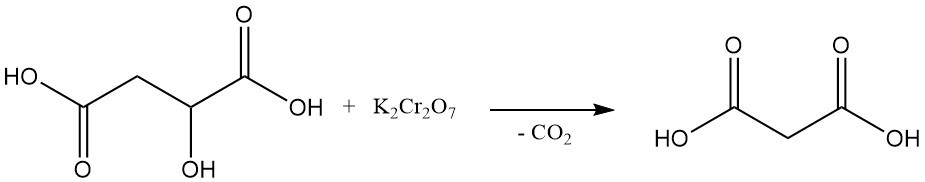
4. Utilizzi dell’acido malonico
L’acido malonico è utilizzato come elemento costitutivo di vari composti organici grazie alla sua capacità di introdurre una frazione di acido acetico in condizioni blande tramite condensazione di Knoevenagel seguita da decarbossilazione. Esempi di composti sintetizzati dall’acido malonico includono:
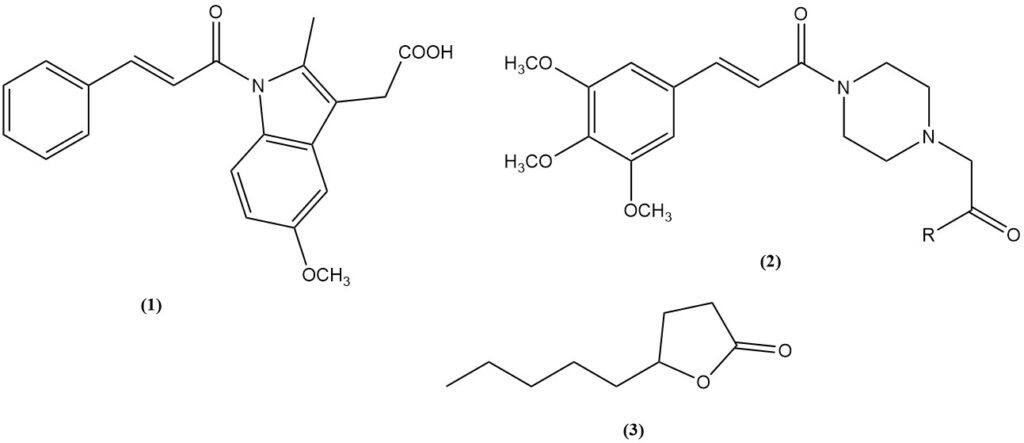
- L’acido cinnamico è un precursore del farmaco antinfiammatorio cinmetacina (1).
- Acido 3,4,5-trimetossicinnamico: un intermedio per i vasodilatatori cinepazet (2, R = OEt) e cinepazide (2, R = 1-pirrolidinile).
- γ-lattone nonanoico (3): un composto profumato ottenuto tramite condensazione di Knoevenagel dell’acido malonico con eptaldeide seguita da ciclizzazione.
L’acido malonico è anche utilizzato nella produzione di materie plastiche tecniche con le proprietà desiderate, contenitori biodegradabili, barbiturici e rivestimenti.
5. Tossicologia dell’acido malonico
L’acido malonico è considerato avere una tossicità moderata, che colpisce principalmente gli occhi e la pelle. Ecco quali dati tossicologici sono disponibili:
Tossicità orale acuta: LD50 (orale, ratto): 2750 mg/kg
L’acido malonico può irritare la pelle (lieve irritazione cutanea nei conigli) e causare gravi danni agli occhi in caso di contatto. Le schede di sicurezza (SDS) raccomandano di indossare adeguati dispositivi di protezione individuale (DPI) per evitare il contatto.
Non ci sono dati prontamente disponibili sugli effetti cronici sulla salute negli esseri umani.
Anche l’inalazione di polvere di acido malonico può essere dannosa, sebbene i dati specifici possano essere limitati.
Gli effetti specifici dell’esposizione all’acido malonico possono variare a seconda di fattori come la quantità, la durata dell’esposizione e la via di ingresso (inalazione, ingestione, contatto con la pelle).
Come per qualsiasi sostanza chimica, è fondamentale maneggiare l’acido malonico secondo i protocolli di sicurezza raccomandati descritti nelle schede di sicurezza (SDS).
Riferimenti
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- Malonic acid. – https://www.acs.org/molecule-of-the-week/archive/m/malonic-acid.html
- The Knoevenagel Reaction. – https://www.sciencedirect.com/science/article/abs/pii/B9780080523491000330
- https://beta-static.fishersci.com/content/dam/fishersci/en_US/documents/programs/education/regulatory-documents/sds/chemicals/chemicals-m/S25416.pdf
