Acido ftalico: proprietà, produzione e usi
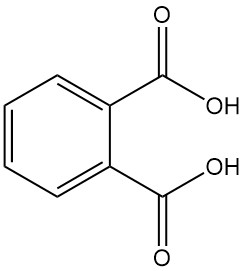
L’acido ftalico, noto anche come acido o-ftalico o acido 1,2-benzendicarbossilico, è un acido dicarbossilico aromatico con formula chimica C8H6O4. È un solido bianco cristallino che non ha importanza a livello industriale. Si forma come sottoprodotto nella produzione di anidride ftalica.
L’acido ftalico si trova naturalmente in alcune piante, come Papaver somniferum, Cocos nucifera e altri organismi e animali. Fu scoperto per la prima volta nel 1836 dal chimico francese A. Laurent come prodotto dell’ossidazione del naftalene.
Sommario
1. Proprietà fisiche dell’acido ftalico
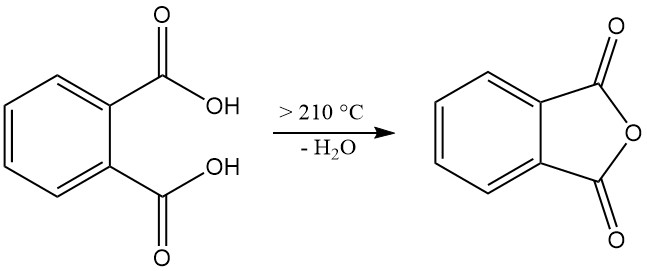
L’acido ftalico [88-99-3] è un acido diprotico debole con costanti di dissociazione pKa1 = 2,89 e pKa2 = 5,51. Forma cristalli monoclini incolori con un punto di fusione di 191 °C in un tubo sigillato che vengono convertiti in anidride ftalica con l’eliminazione di acqua a temperature superiori a 210 °C.
L’acido ftalico è solubile in acqua bollente (100 °C), 18 g/100 mL, ed è molto meno solubile in acqua fredda (14 °C), 0,54 g/100 mL. È solubile in etanolo (10 g/100 ml) e metanolo (19,5 g/100 ml) e insolubile in cloroformio ed etere.
Alcune delle importanti proprietà fisiche dell’acido ftalico sono elencate nella seguente tabella.
| Proprietà | Valore |
|---|---|
| Formula | C8H6O4 |
| Peso molecolare | 166,14 g/mol |
| Punto di fusione | 191 °C (in provetta sigillata) Decomposizione a 210 °C |
| Densità a 15 °C | 1,593 g/cm3 |
| Densità di vapore | 5,7 |
| Calore di fusione | 315,3 J/g |
| Calore specifico del solido (0–99 °C) | 1,214 J g-1 K-1 |
| Calore di combustione | 19657,03 J/g |
| Calore di formazione | 43714,34 J/g |
| Calore di soluzione a 25 °C | 123,55 J/g |
| Punto di infiammabilità | 168 °C |
2. Reazioni dell’acido ftalico
L’acido ftalico subisce le tipiche reazioni chimiche degli acidi carbossilici e dei composti aromatici.
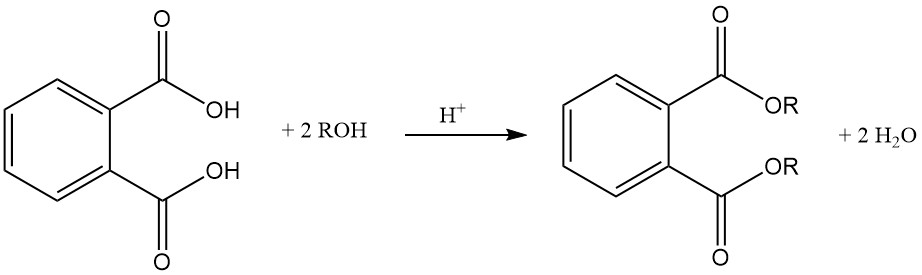
L’acido ftalico è un acido diprotico debole che reagisce con basi come NaOH o KOH e ossidi metallici per formare sali chiamati ftalati. Questi sali possono essere solubili in acqua (sali formati con metalli alcalini (ad esempio, sodio, potassio)) o insolubili, come ftalati di calcio e magnesio.
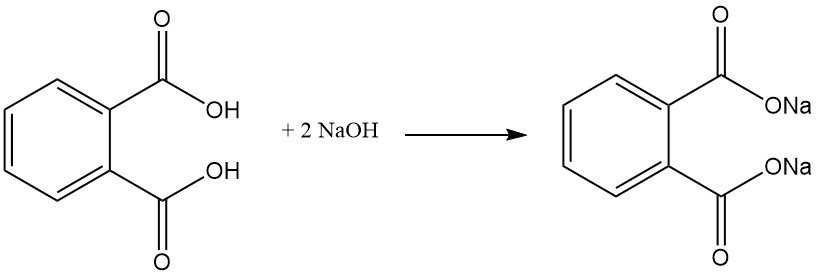
L’acido ftalico reagisce con gli alcoli in presenza di un catalizzatore acido (acido solforico) per formare diesteri ftalici. Questi esteri sono utili prodotti chimici industriali con varie applicazioni.
Riscaldato a 210 °C o più, l’acido ftalico subisce una disidratazione che produce anidride ftalica.
L’acido ftalico può subire reazioni di sostituzione aromatica; tuttavia, la presenza dei due gruppi di acido carbossilico lo disattiva. In condizioni specifiche e difficili, potrebbe essere possibile un’ulteriore funzionalizzazione dell’anello aromatico.
3. Produzione di acido ftalico
L’acido ftalico si forma come sottoprodotto nella produzione di anidride ftalica mediante idrolisi. L’acido ftalico non è importante nell’industria. Invece, l’anidride ftalica viene prodotta industrialmente e quindi convertita in acido ftalico se necessario.
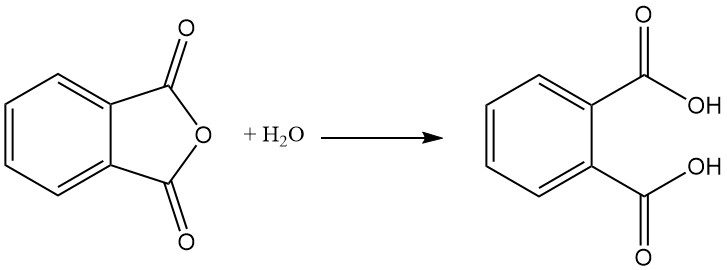
L’anidride ftalica viene preparata mediante ossidazione catalitica di naftalene o orto-xilene (o-xilene) ad alte temperature e spesso utilizza un reattore tubolare a letto fisso.
Un brevetto del 1979 descriveva la produzione di acido ftalico mediante ossidazione liquida continua di o-xilene con aria in un reattore agitato. La reazione viene condotta a una temperatura compresa tra 160 °C e 200 °C e una pressione compresa tra 21 e 29 kg/cm2.
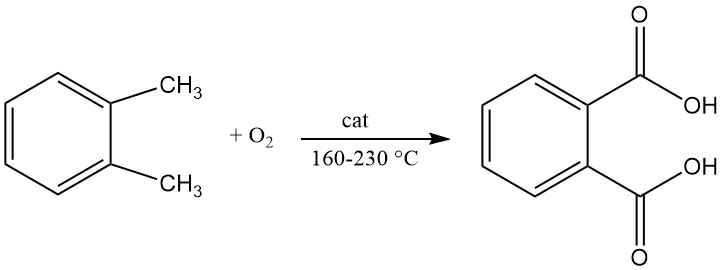
Il catalizzatore utilizzato in questo processo conteneva una miscela di cobalto, manganese e bromo e il contenuto di acqua nel mezzo di reazione è compreso tra lo 0,2% e il 7%.
L’aria viene utilizzata come ossidante e la miscela liquida risultante contiene dall’8% al 40% di acido ftalico e dal 6% al 30% di o-xilene. Questa miscela liquida viene alimentata continuamente, insieme ad aria aggiuntiva, in un secondo reattore agitato.
La temperatura in questo secondo reattore viene mantenuta tra 210 °C e 230 °C. È importante notare che qui viene aggiunto un catalizzatore fresco, contenente almeno 1 milligrammo di atomo di cobalto per mole di xilene elaborato (rispetto alla prima fase).
Questa reazione in due fasi produce un effluente liquido ricco di acido ftalico (dall’85% al 92%). Tuttavia, contiene anche acqua, impurità come l’acido benzoico e composti con punto di ebollizione più alto.
4. Usi dell’acido ftalico
L’acido ftalico è utilizzato come reagente analitico e di laboratorio e per produrre medicinali, coloranti, ftalimmide, acido antranilico, esteri dell’acido ftalico e profumi sintetici.
L’acido ftalico può essere utilizzato come precursore dell’anidride ftalica, che è più preziosa e viene utilizzata in vari settori come vernici, materie plastiche, tessuti e prodotti farmaceutici.
5. Tossicologia e pericoli dell’acido ftalico
L’acido ftalico è un intermedio che viene prodotto e ulteriormente utilizzato nell’industria in condizioni ben controllate. L’esposizione occupazionale può verificarsi, ma si prevede che sia bassa. L’esposizione del pubblico generale all’acido ftalico è bassa e trascurabile.
Nonostante il numero limitato di studi tossicologici disponibili, i dati esistenti suggeriscono una bassa tossicità per l’acido ftalico. Studi di tossicità acuta nei topi (iniezione intraperitoneale) indicano una dose letale mediana (LD50) di 550 mg/kg.
Dopo l’esposizione, la maggior parte dell’acido ftalico viene escreta nelle urine, direttamente (come nei cani) o parzialmente coniugata (come nei ratti e nei conigli). Una piccola parte può subire decarbossilazione ed essere eliminata come acido benzoico.
Riferimenti
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://patents.google.com/patent/US4215053A/en
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalic-acid
