Acido formico: proprietà, reazioni, produzione e usi
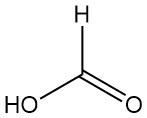
Cos’è l’acido formico?
L’acido metanoico, meglio noto come acido formico, è l’acido carbossilico più semplice con formula HCOOH. È un liquido incolore e corrosivo dall’odore pungente, completamente miscibile con acqua e molti solventi polari, ma solo parzialmente miscibile con gli idrocarburi.
L’acido formico deriva il suo nome dalle formiche (latino Formica), da cui fu ottenuto per la prima volta per distillazione a secco. Il primo studio scientifico sulle sue proprietà, “Concerning Some Un-Common Observations and Experiments Made with an Acid Juice to be Found in Ants”, fu pubblicato già nel 1670.
Sommario
1. Proprietà fisiche dell’acido formico
L’acido formico è un liquido incolore, limpido e corrosivo, dall’odore pungente. È l’acido alchilcarbossilico non sostituito più forte.
La dipendenza della densità dell’acido formico dalla temperatura è riportata nella Tabella 1.
| Temperatura, °C | Densità, g/cm3 |
|---|---|
| 0 | 1,244 |
| 10 | 1,232 |
| 15 | 1,226 |
| 20 | 1,220 |
| 25 | 1,214 |
| 30 | 1,207 |
| 40 | 1,195 |
| 50 | 1,182 |
| 60 | 1,169 |
| 70 | 1,156 |
| 80 | 1,143 |
| 90 | 1,130 |
| 100 | 1,117 |
L’acido formico non aumenta di volume quando solidifica e tende a sottoraffreddarsi.
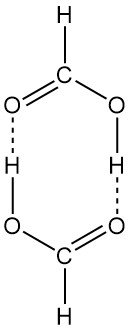
La Tabella 2 mostra la curva della pressione di vapore dell’acido formico puro. Il vapore dell’acido formico si discosta notevolmente dal comportamento di un gas ideale perché le molecole dimerizzano parzialmente in fase vapore. A temperatura ambiente e pressione normale, il 95% del vapore di acido formico è costituito da acido formico dimerizzato.
| Liquido | Solido | ||
|---|---|---|---|
| Temperatura, °C | Pressione (kPa) | Temperatura, °C | Pressione (kPa) |
| -5,23 | 1,083 | -5,07 | 0,664 |
| 0,00 | 1,488 | 0,00 | 1,096 |
| 8,25 | 2,392 | 8,25 | 2,392 |
| 12,57 | 3,029 | - | - |
| 20,00 | 4,473 | - | - |
| 29,96 | 7,248 | - | - |
| 39,89 | 11,357 | - | - |
| 49,93 | 17,347 | - | - |
| 59,98 | 25,693 | - | - |
| 70,04 | 37,413 | - | - |
| 79,93 | 52,747 | - | - |
| 100,68 | 101,667 | - | - |
| 110,62 | 135,680 | - | - |
L’entalpia della dimerizzazione in fase gassosa è di -63,8 kJ/mol.
La struttura dimerica ad anello è presente sia in fase vapore che in soluzione. L’acido formico liquido è costituito da lunghe catene di molecole legate tra loro da legami a idrogeno. L’acido formico solido può anche essere isolato in due forme polimorfiche (α e β).
L’acido formico e l’acqua formano una miscela azeotropica massimo-bollente il cui punto di ebollizione è 107,6 °C a 101,3 kPa; è composta dal 77,6% in peso di acido formico e dal 22,4% in peso di acqua.
La variazione della viscosità dinamica con la temperatura è mostrata nella Tabella 3. La viscosità dinamica delle miscele acido formico-acqua diminuisce approssimativamente in modo lineare all’aumentare del contenuto d’acqua dell’acido formico. La conduttività termica dell’acido formico è notevolmente superiore a quella di liquidi comparabili a causa della sua pronunciata polarità.
| Temperatura, °C | Viscosità, mPa.s |
|---|---|
| 10 | 2,262 |
| 20 | 1,804 |
| 30 | 1,465 |
| 40 | 1,224 |
| 50 | 1,025 |
Le proprietà fisiche dell’acido formico sono elencate nella tabella seguente:
| Proprietà | Valore |
|---|---|
| Numero CAS | [64-18-6] |
| Formula | HCOOH |
| Peso molecolare | 46,03 g/mol |
| Punto di fusione | 8,3 °C |
| Punto di ebollizione | 100,8 °C |
| pKa | 3,74 |
| Calore di fusione | 276 J/g |
| Calore di vaporizzazione (al punto di ebollizione) | 483 J/g |
| Costante dielettrica |
Liquido (a 20 °C): 57,9 Solido (a -10,1 °C): 11,7 |
| Indice di rifrazione | 1,37140 |
| Tensione superficiale σ | (a 20°C): 37,67×10-3 N/m (a 40°C): 35,48×10-3 N/m (a 60°C): 33,28×10-3 N/m (a 80°C): 31,09×10-3 N/m |
| Calore di formazione | Liquido (a 25°C): -425,0 kJ/mol Vapore (a 25°C, monomero): -378,57 kJ/mol (a 25°C, dimero): -820,94 kJ/mol |
| Calore di combustione | Liquido (a 25 °C): -254,8 kJ/mol |
| Entropia |
Liquido (a 25 °C): 129,0 J K-1 mol-1 Vapore (a 25 °C, monomero): 248,88 J K-1 mol-1 (a 25 °C, dimero): 332,67 J K-1 mol-1 |
| Calore di neutralizzazione | 56,9 kJ/mol |
2. Reazioni dell’acido formico
Sebbene l’acido formico sia relativamente stabile a temperatura ambiente, è in realtà un composto termicamente instabile che presenta due principali vie di decomposizione alternative: disidratazione e deidrogenazione.
HCOOH → CO + H2O
HCOOH → CO2 + H2
La reazione di disidratazione, predominante in fase liquida, è favorita in presenza di catalizzatori ossidici o acidi forti, mentre la reazione di deidrogenazione è promossa da catalizzatori metallici.
L’acido formico diventa particolarmente instabile in concentrazioni prossime al 100%, e questo deve essere tenuto in considerazione quando si conserva acido formico ad alta concentrazione. In generale, la decomposizione dell’acido formico è funzione sia della concentrazione dell’acido che della temperatura.
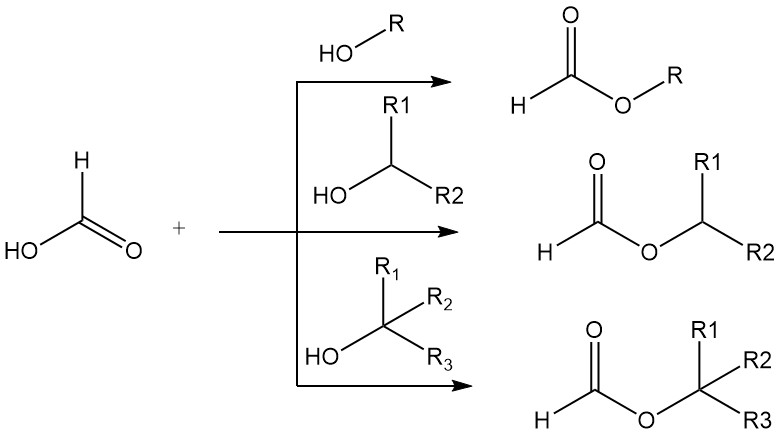
L’acido formico presenta molte delle proprietà chimiche tipiche degli acidi carbossilici alifatici, ad esempio l’esterificazione e l’amidazione, ma, come spesso accade per il primo membro di una serie omologa, vi sono differenze distintive nelle proprietà dell’acido formico e dei suoi omologhi superiori.
L’acido formico forma esteri con alcoli primari, secondari e terziari. L’elevata acidità dell’acido formico rende superfluo l’uso di catalizzatori acidi minerali nelle esterificazioni semplici. Gli alcoli primari e secondari vengono esterificati in acido formico puro 15.000-20.000 volte più rapidamente che in acido acetico puro.
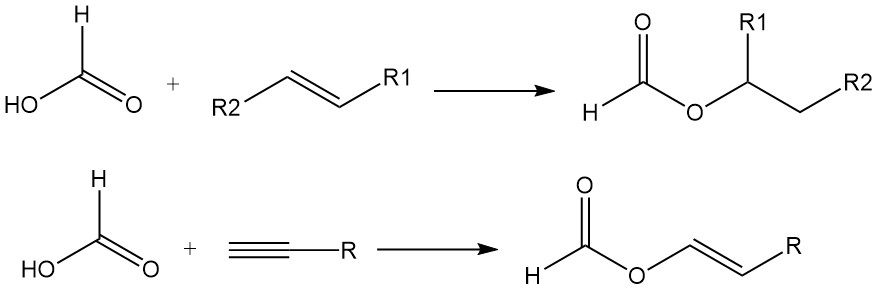
L’acido formico si aggiunge anche ai doppi legami delle olefine per formare esteri. Gli acetileni reagiscono con l’acido formico in fase vapore per produrre formiati vinilici.
L’acido formico reagisce con la maggior parte delle ammine per formare composti formilaminosi. Ad esempio, nella produzione di formammidi, l’acido formico viene utilizzato per ottenere la formilazione per disidratazione. Con alcune diammine, si verifica la formazione di imidazolo. Entrambi i tipi di reazione hanno utilità sintetica.
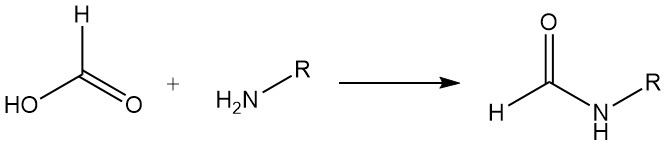
L’acido formico e le basi organiche terziarie formano composti di addizione (rapporti acido formico/base 3:1 e 2:1). I composti di addizione di acido formico e trimetilammina o trietilammina possono essere utilizzati come agenti riducenti liquidi in molte riduzioni selettive. La riduzione dell’anidride solforosa a zolfo è approssimativamente quantitativa.
L’acido formico dissolve ferro e zinco e corrode la maggior parte dei tipi di acciaio. La reazione con il ferro produce formiato di Fe(II) e idrogeno gassoso. Tra i metalli e le leghe comuni, alluminio, rame e nichel mostrano una certa resistenza.
2 HCOOH + Fe → Fe(OOCH)2 + H2
L’acido formico è più corrosivo in soluzioni relativamente diluite in acqua. Per l’acciaio dolce, la velocità di corrosione più elevata si osserva intorno al 20% di concentrazione della soluzione, a cui anche la conduttività della soluzione è massima. Alcuni inibitori di corrosione possono fornire un’ottima protezione.
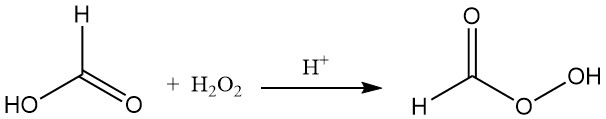
L’acido formico reagisce con il perossido di idrogeno in presenza di un catalizzatore acido per formare acido performico instabile (HCOOOH).
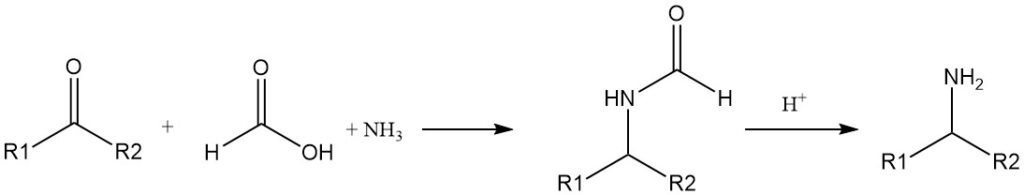
L’atomo di idrogeno formilico presenta un certo carattere aldeidico e l’acido formico riduce alcuni sali e ossidi a metalli. Può essere utilizzato come agente riducente (donatore di idruri) anche in molte reazioni organiche, in sostituzione di H2.
La riduzione delle immine (basi di Schiff) mediante acido formico è nota da tempo. Le ammine primarie possono essere preparate da chetoni, ammoniaca e acido formico (reazione di Leuckart).
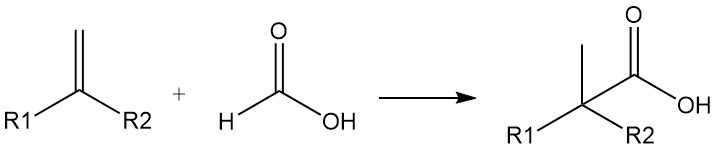
L’acido formico può anche essere utilizzato come fonte di monossido di carbonio. Acidi carbossilici altamente ramificati possono essere preparati da olefine e acido formico in presenza di acido solforico o fluoridrico (sintesi di acidi carbossilici di Koch). La reazione avviene tramite aggiunta di CO.
3. Produzione di acido formico
L’acido formico viene prodotto oggi principalmente attraverso due metodi: l’idrolisi del formiato di metile e la preparazione di acido formico libero da sali di formiato.
Il processo basato sul formiato di metile è attualmente dominante. Circa il 90% della capacità installata si basa su questo processo. Gli svantaggi economici dei metodi precedentemente utilizzati hanno portato allo sviluppo di un processo specificamente dedicato alla produzione di acido formico, privo di sottoprodotti indesiderati.
Negli anni ’70, l’idrolisi del formiato di metile a metanolo e acido formico è stata sviluppata commercialmente da diverse aziende, diventando un metodo economicamente fattibile.
Questo processo prevede la carbonilazione del metanolo e la successiva idrolisi del formiato di metile prodotto. Il metanolo risultante da questo processo viene reimmesso nella fase iniziale.
Impianti di acido formico basati su questo processo sono stati avviati presso BASF (Germania) nel 1981 e Kemira (Finlandia) nel 1982. Produttori su larga scala più recenti che utilizzano questo processo sono le aziende cinesi Feicheng Acid Chemicals e Luxi Chemical Group.
L’altro metodo di produzione attuale prevede la formazione di acido libero dai suoi sali. A questo scopo vengono utilizzati principalmente formiato di sodio e formiato di calcio. L’acidolisi viene normalmente effettuata con acido solforico o acido fosforico. Sali di solfato o fosfato vengono prodotti come sottoprodotti.
3.1. Produzione di acido formico per idrolisi del formiato di metile
Il metodo teoricamente più semplice per produrre acido formico è la reazione del monossido di carbonio con acqua. Al di sotto di 150 °C, la reazione è molto lenta e, sebbene l’equilibrio venga raggiunto rapidamente a temperature più elevate, la pressione deve essere aumentata per ottenere concentrazioni accettabili di acido formico.
CO + H₂O → HCOOH
Gli ostacoli termodinamici possono essere aggirati se si forma il formiato di metile come intermedio.
La carbonilazione in fase liquida del metanolo a formiato di metile in presenza di un catalizzatore basico come il metossido di sodio o di potassio (NaOCH₂ o KOCH₂) e la successiva idrolisi ad acido formico sono state praticate a livello industriale fin dai primi anni ’80.
Il metossido di potassio è più solubile nel formiato di metile rispetto al metossido di sodio e, di conseguenza, ha una velocità di reazione più elevata. Il metanolo liberato nel secondo stadio viene reimmesso nel primo stadio.
CH3OH + CO → HCOOCH3
HCOOCH3 + H2O → HCOOH + CH3OH
Il processo del formiato di metile viene utilizzato, ad esempio, da Eastman Chemical Company, BASF, Kemira, Luxi Chemical Group e Feicheng Acid Chemicals.
Le condizioni di reazione per la prima fase di carbonilazione sono sostanzialmente simili in ciascuna di esse, ma differiscono nell’approccio alla fase di idrolisi.
3.1.1. Carbonilazione
Secondo i dati pubblicati, le condizioni di reazione tipiche sembrano essere 80 °C, 4,5 MPa di pressione e 2,5% in peso di catalizzatore a base di metossido di sodio. In queste condizioni, la conversione del metanolo è di circa il 30% e quella del monossido di carbonio di circa il 95%.
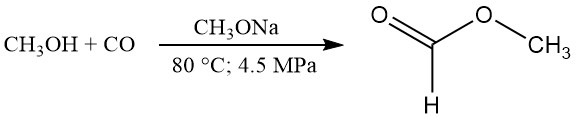
Una conversione pressoché quantitativa del metanolo in formiato di metile può essere ottenuta riciclando il metanolo non convertito. La velocità di carbonilazione può essere aumentata aumentando la temperatura, la pressione parziale di CO2, la concentrazione del catalizzatore o l’interfaccia tra la fase gassosa e quella liquida.
Come reazione secondaria, il catalizzatore produce sali di formiato (Na e K). I sali di formiato sono meno solubili nel formiato di metile che nel metanolo. Pertanto, è necessario gestire il rischio di incrostazioni e ostruzioni dovute alla precipitazione del catalizzatore.
Il monossido di carbonio non deve contenere una quantità significativa di anidride carbonica; in caso contrario, il carbonato cataliticamente inattivo precipita.
Il metossido di metallo alcalino non decomposto nel formiato di metile deve essere neutralizzato per evitare la reazione inversa, ovvero la decomposizione del formiato di metile in metanolo e CO2 quando riscaldato.
3.1.2. Idrolisi
L’equilibrio di idrolisi del formiato di metile è relativamente sfavorevole, ma dipende dalla concentrazione di acqua, favorendo l’utilizzo di un elevato eccesso stechiometrico di acqua, con conseguenti problemi nell’individuazione di un metodo energeticamente efficiente per la rimozione dell’acqua in eccesso.
L’acido formico agisce da catalizzatore di idrolisi (autocatalisi). Un modo per superare la posizione sfavorevole dell’equilibrio di idrolisi è idrolizzare il formiato di metile in presenza di un additivo, ad esempio un’ammina terziaria.
La base forma un addotto simile a un sale con l’acido formico; pertanto, la concentrazione di acido formico libero diminuisce e l’equilibrio di idrolisi si sposta nella direzione dei prodotti. In una fase successiva, l’acido formico può essere distillato dalla base senza decomposizione.
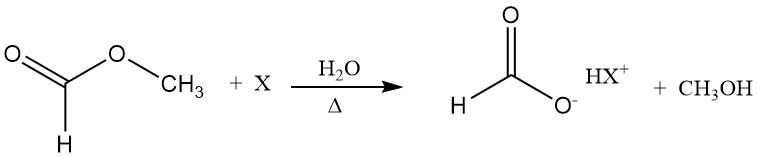
3.2. Produzione di acido formico da formiati
La reazione dei sali di formiato con acidi minerali (solitamente acido solforico) è il più antico processo commerciale per la produzione di acido formico e riveste ancora un’importanza industriale. Perstorp è il maggiore produttore di acido formico attraverso l’acidolisi dei sali di formiato.
Il formiato di sodio, il formiato di potassio e il formiato di calcio sono disponibili industrialmente dalla produzione di alcoli polivalenti.
L’acidolisi dei sali di formiato è tecnicamente semplice, ma l’inevitabile produzione di sali coprodotti come il solfato di sodio e di calcio rappresenta un chiaro svantaggio di questo metodo.
2 HCOONa + H2SO4 → 2 HCOOH + Na2SO4
(HCOO)2Ca + H2SO4 → 2 HCOOH + CaSO4
Alcuni brevetti cinesi descrivono la preparazione di acido formico da CO e idrossidi di metalli alcalini o alcalino-terrosi, seguita da acidificazione con acido fosforico. Il monossido di carbonio può derivare dalla produzione di fosforo. I sali di fosfato risultanti vengono utilizzati come fertilizzanti.
3.2.1. Formiati come sottoprodotti di polioli
I sali di formiato si trovano come sottoprodotti nella produzione di pentaeritritolo, trimetilolpropano e 2,2-dimetil-1,3-propandiolo (neopentilglicole).
Ad esempio, il pentaeritritolo viene prodotto dalla reazione di formaldeide con acetaldeide in un mezzo acquoso alcalino. L’aldeide intermedia reagisce ulteriormente con la formaldeide attraverso la reazione di Cannizzaro, producendo pentaeritritolo e acido formico.
L’acido formico formato reagisce immediatamente con l’alcali presente, dando come coprodotto finale il corrispondente sale di formiato.
3 HCHO + CH3CHO → (HOCH2)3CCHO
(HOCH2)3CCHO + HCHO + H2O → C(CH2OH)4 + HCOOH
HCOOH + NaOH → HCOONa + H2O
2 HCOOH + Ca(OH)2 → (HCOO)2Ca + 2 H2O
Inoltre, l’eccesso di alcali nel processo viene neutralizzato dall’acido formico. Il prodotto pentaeritritolo viene isolato mediante concentrazione graduale e cristallizzazione frazionata.
3.2.2. Formiati da monossido di carbonio
I sali di formiato possono essere prodotti mediante un processo diretto basato sulla reazione di CO con una base come NaOH e KOH.
NaOH (aq) + CO → HCOONa (aq)
KOH (aq) + CO → HCOOK (aq)
3.3. Produzione di acido formico da anidride carbonica
L’idrogenazione dell’anidride carbonica in alcol produce acido formico in un ambiente quasi privo di acqua, il che rappresenta un vantaggio per il recupero del prodotto. I complessi solubili di Ru sono i catalizzatori preferiti e un agente complessante viene utilizzato per rendere la reazione termodinamicamente favorevole.
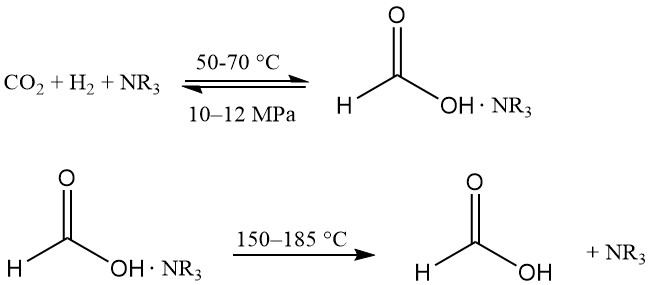
Questa tecnologia è stata introdotta per la prima volta da BP Chemicals negli anni ’80 ed è stata sviluppata da BASF.
La reazione avviene in una miscela di ammina terziaria (solitamente n-triesilammina) e alcol (ad esempio metanolo) a 50-70 °C e 10-12 MPa. Viene aggiunta una certa quantità d’acqua per facilitare la separazione di fase. Il complesso acido formico-ammina viene dissociato termicamente a 150-185 °C.
Il processo deve mantenere attivo il costoso catalizzatore a base di complessi di metalli di transizione, ma evitare anche solo tracce della sua presenza in forma attiva nella distillazione dell’acido formico, poiché può catalizzare la decomposizione dell’acido. Eventuali residui del catalizzatore possono essere inattivati in modo reversibile con CO.
Sono in fase di sviluppo diversi processi elettrochimici per la produzione di acido formico o di sale di formiato a partire dall’anidride carbonica. Il processo di elettrolisi della CO2 è sostanzialmente il funzionamento inverso di una cella a combustibile. In un elettrolizzatore, la CO2 viene ridotta al catodo, mentre la reazione di sviluppo dell’ossigeno avviene all’anodo.
Negli ultimi anni, i notevoli miglioramenti nei sistemi catalitici e negli elettrodi hanno portato a rese molto più elevate, efficienze faradica e consumi di combustibile più elevati.
3.4. Produzione di acido formico da biomassa
Praticamente qualsiasi biomassa vegetale può essere ossidata ad acido formico, CO2 e acqua con elevata selettività all’acido formico utilizzando poliossometallati come catalizzatori per la produzione di ossigeno.
L’idrolisi acida minerale di cellulosa ed emicellulosa a circa 200 °C produce una miscela di acido levulinico, acido formico e furfurale. La reazione totale degli zuccheri C6 ad acido levulinico e acido formico è mostrata nello Schema 1.
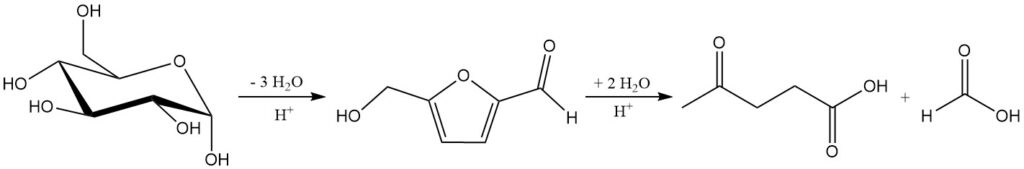
3.5. Recupero dell’acido formico
3.5.1. Distillazione azeotropica
Le miscele di acido formico e acqua non possono essere concentrate oltre la composizione azeotropica mediante distillazione semplice. La concentrazione di acido formico nella miscela azeotropica aumenta se la distillazione viene effettuata sotto pressione, ma il punto di ebollizione più elevato ad alta pressione aumenta anche la velocità di decomposizione dell’acido formico.
Una combinazione di distillazione sotto pressione seguita da distillazione sotto vuoto può produrre praticamente tutte le concentrazioni desiderate.
3.5.2. Estrazione
Sono state sviluppate diverse tecnologie in cui l’estrazione reattiva viene utilizzata per trasferire l’acido formico in una fase organica separata oppure l’acido formico è legato a un debole agente complessante in fase acquosa. In entrambi i casi, è possibile evitare l’azeotropo.
Quando si prevede la separazione di fase, è possibile ridurre la quantità totale di acqua da evaporare. Solitamente si utilizzano ammidi secondarie o ammine terziarie.
Nella distillazione estrattiva, l’acido formico viene estratto in una colonna di distillazione mediante un agente estraente basico introdotto in controcorrente e immesso sul fondo della colonna. Se questa miscela viene riscaldata in una colonna a valle, l’acido formico viene liberato dall’addotto salino e distillato.
4. Usi dell’acido formico
Grazie alla sua acidità, alla sua natura aldeidica e alle proprietà riducenti, l’acido formico viene utilizzato in una varietà di campi. A differenza degli acidi minerali, l’acido formico evapora senza lasciare residui. In Europa, la maggior parte dell’acido formico viene utilizzata nell’industria mangimistica e come coadiuvante per l’insilamento.
4.1. Usi dell’acido formico nella conservazione della biomassa
4.1.1. Insilato
Il termine insilato si riferisce tradizionalmente all’insilamento di foraggi (principalmente erbe) per l’alimentazione dei bovini negli allevamenti. Il consumo dipende dal clima; l’insilamento a base di acido formico è particolarmente adatto in condizioni di umidità. L’Europa settentrionale è la principale area di consumo.
L’insilamento si basa sulla fermentazione in condizioni anaerobiche, dove l’acido lattico prodotto dai batteri lattici preserva l’insilato. L’acido lattico abbassa il pH e quindi previene la crescita microbica indesiderata.
L’aggiunta di acido formico determina un rapido calo iniziale del pH, che favorisce la crescita dei batteri lattici e inibisce la crescita dei batteri che producono composti indesiderati come l’acido butirrico. Quando l’abbassamento del pH viene aumentato con l’acido formico, la fermentazione spontanea viene inibita.
Tra i vantaggi figurano un maggior contenuto di zuccheri residui e proteine. È noto che la limitazione della fermentazione ha un effetto positivo sull’assunzione volontaria di cibo nell’alimentazione delle vacche da latte, migliorando così la produzione di latte.
Le colture foraggere come erba, mais, trifoglio ed erba medica vengono tagliate, sminuzzate e poi fermentate in silos o balle coperte con pellicola ermetica. L’acido formico è particolarmente indicato per l’insilamento di materiali difficili da insilare, in particolare foraggi umidi o a basso contenuto di zuccheri, che possono anche avere un’elevata capacità tampone.
L’acido formico viene utilizzato anche per limitare la fermentazione durante l’insilamento di cereali arricciati ad alto contenuto di umidità.
I sottoprodotti dell’industria alimentare e delle bevande, come il mosto esausto dei birrifici, possono essere conservati con soluzioni di acido formico per ottenere mangimi per animali a lunga conservazione.
L’acido formico viene utilizzato in diverse formulazioni, a volte in miscele con altri acidi organici a catena corta come l’acido propionico, ed è spesso tamponato con un sale di formiato per garantire la sicurezza nella manipolazione e ridurre la corrosione.
4.1.2. Biomassa animale
Anche la biomassa animale può essere conservata con l’acido formico. L’utilizzo principale è nella lavorazione dei sottoprodotti dell’industria ittica per la produzione di insilato di pesce. Il trattamento adeguato delle frattaglie di pesce è spesso richiesto dalle leggi ambientali e la produzione di insilato di pesce può rappresentare una soluzione economicamente fattibile.
L’insilato di pesce è un prodotto liquido ricco di proteine, ottenuto abbassando il pH delle parti di pesce macinate con un conservante acido. In queste condizioni, gli enzimi contenuti nelle interiora del pesce producono il prodotto finale a lunga conservazione in pochi giorni.
L’acido formico consente inoltre un’efficiente separazione dell’olio di pesce durante il processo di insilamento. L’acido agisce anche come coadiuvante di processo riducendo la formazione di gas microbico (“ebollizione”). L’insilato di pesce può essere utilizzato come mangime per pesci e suini o come materia prima per farina e oli di pesce.
L’acido formico è l’acido preferito in questa applicazione, solitamente in combinazione con un antiossidante adatto. Questa applicazione è un metodo standard nei principali paesi produttori di salmone, ad esempio la Norvegia, e si prevede che acquisirà maggiore importanza con l’intensificarsi dell’acquacoltura, soprattutto nell’Asia orientale e sud-orientale.
Gli scarti di macellazione possono essere conservati in modo simile alle frattaglie di pesce con acidi, solitamente miscele di acido formico e acido lattico. I prodotti sono adatti per gli animali da pelliccia e, con alcune limitazioni, per gli alimenti per animali domestici.
4.2. Usi dell’acido formico nell’industria conciaria
Uno dei maggiori utilizzatori di acido formico a livello globale è l’industria conciaria. Con il trasferimento dell’industria conciaria in paesi a basso costo, i dati di crescita in Asia sono stati molto elevati, compensando il declino in Europa e Nord America.
La Cina è il maggiore produttore di cuoio, rappresentando circa il 30% della produzione mondiale.
Il pretrattamento delle pelli le lascia in uno stato leggermente alcalino, ma la concia richiede condizioni acide. Pertanto, le pelli vengono trattate con acidi (tipicamente acido solforico e acido formico) prima della concia, in un processo chiamato piclaggio.
Senza questo condizionamento, gli agenti concianti si fisserebbero rapidamente sulla superficie della pelle, mentre lo strato interno rimarrebbe grezzo.
L’acido solforico riduce il pH del bagno di lavaggio, mentre l’acido formico è in grado di penetrare rapidamente e omogeneamente attraverso le fibre di collagene. Garantisce che l’agente conciante (solitamente solfato di cromo basico) penetri in tutto lo spessore della pelle.
Nella tintura delle pelli, l’acido formico viene utilizzato come agente livellante per favorire il trasferimento del colore da una zona all’altra della pelle, con conseguente distribuzione più uniforme e liscia.
4.3. Usi dell’acido formico nel settore tessile
Nell’industria tessile, l’acido formico viene utilizzato come agente regolatore del pH nella tintura di lana, nylon e altre fibre naturali e sintetiche con coloranti acidi e al cromo. Inoltre, l’acido formico viene utilizzato per neutralizzare le soluzioni alcaline e facilitare il risciacquo durante il lavaggio.
Si prevede che il miglioramento del tenore di vita e l’aumento della produzione di fibre, soprattutto per i mercati di esportazione, aumenteranno la domanda di acido formico nella tintura e finitura tessile in Asia.
4.4. Usi dell’acido formico come additivi per mangimi
Acidi e sali organici hanno una lunga storia nell’industria mangimistica, che li utilizza comunemente come conservanti e per l’acidificazione delle diete dei suinetti. Dal 2006, anno in cui l’UE ha vietato gli antibiotici promotori della crescita (AGP), l’uso di acidi organici nei mangimi è aumentato.
L’acido formico ha un forte effetto acidificante, ma anche effetti antimicrobici, che vengono utilizzati per proteggere i mangimi e l’acqua potabile dalla contaminazione batterica. L’acido formico è molto efficace contro Salmonella, Escherichia coli e Campylobacter a pH 4,0.
Agisce positivamente sulla flora intestinale degli animali e può migliorare sia la digeribilità apparente di energia e proteine, sia l’assorbimento e la ritenzione di alcuni minerali. Sembra migliorare le prestazioni di crescita dei suinetti svezzati e dei suini da ingrasso a dosaggi inferiori rispetto ad altri acidi e sali organici.
Nell’industria avicola, l’acido formico è da tempo utilizzato per prevenire la crescita di patogeni nei mangimi e nelle materie prime per mangimi. Le miscele di acido formico con acido propionico, acido lattico o acidi grassi a catena media hanno effetti antimicrobici più ampi rispetto al solo acido formico.
4.5. Usi dell’acido formico in prodotti farmaceutici e additivi alimentari
Si stima che i prodotti farmaceutici e i prodotti chimici alimentari rappresentino il settore con il maggiore utilizzo di acido formico in Asia (principalmente in Cina).
L’acido formico è utilizzato come intermedio di sintesi per vari prodotti farmaceutici e prodotti chimici alimentari, tra cui insulina sintetica (purificazione dell’insulina ricombinante), caffeina, aspartame e vitamina B1. È anche ampiamente utilizzato per la regolazione del pH durante la produzione di vari prodotti chimici.
Altre applicazioni alimentari includono la decontaminazione da Salmonella e l’uso come conservante (E236, consentito negli Stati Uniti ma non nell’UE, in Australia e in Nuova Zelanda) e come aromatizzante.
L’acido formico viene utilizzato nella conservazione degli alimenti anche per la fumigazione di frutta come mele e ciliegie, al fine di ridurre il deterioramento post-raccolta. L’acido formico è particolarmente efficace nel distruggere le spore fungine sulle superfici e sui contenitori in cui viene conservata la frutta.
In alcune applicazioni per la conservazione degli alimenti, l’acido formico viene miscelato con acido lattico e/o propionico. La miscela è minimamente corrosiva, ma grazie al suo basso pH, contribuisce a distruggere i microrganismi nocivi e ne impedisce la propagazione, prolungando così la durata di conservazione del prodotto.
4.6. Altri usi
4.6.1. Coagulazione della gomma
L’acido formico è la scelta preferita per la coagulazione del lattice, una sospensione di particelle microscopiche di gomma naturale (poliisoprene) in un mezzo acquoso. Le superfici delle particelle di lattice sono caricate, il che crea una repulsione tra loro, impedendo la coagulazione.
Nel processo di coagulazione, l’acido formico neutralizza queste cariche, eliminando la repulsione. Il processo si traduce in un prodotto in gomma naturale omogeneo e di alta qualità. L’uso di acidi più forti fa sì che il pH scenda troppo rapidamente e in modo disomogeneo. Di conseguenza, il lattice coagula in modo non uniforme, il che può influire sulle sue proprietà meccaniche.
Gli acidi più deboli, come l’acido acetico, sono meno efficienti dell’acido formico e comportano un consumo di acido molto maggiore.
4.6.2. Desolforazione dei gas
L’acido formico viene utilizzato come catalizzatore di desolforazione nella desolforazione dei gas di combustione nelle centrali elettriche a carbone. Lo zolfo, il cui contenuto nel carbone può raggiungere il 5%, viene rilasciato come anidride solforosa durante il processo di cottura.
La cattura dell’anidride solforosa mediante il passaggio dei gas di combustione attraverso una sospensione acquosa di calcare produce gesso (solfato di calcio). L’aggiunta di acido formico al ciclo di desolforazione aumenta l’efficienza della separazione dello zolfo.
4.6.3. Acidificanti di pozzo
L’acido formico viene utilizzato per la stimolazione di pozzi ad alta temperatura nei giacimenti di petrolio e gas quando i sistemi convenzionali a base di acido cloridrico (HCl) non possono essere adeguatamente inibiti.
L’acidificazione del pozzo si ottiene pompando acido nel pozzo per sciogliere il cemento di calcare, dolomite e calcite tra i granuli di sedimento delle rocce del serbatoio.
L’acido formico offre il vantaggio di una buona inibizione contro la corrosione delle tubazioni a temperature fino a 200 °C (probabilmente causata da uno strato protettivo di prodotti di decomposizione).
La miscela di HCl e acido formico può offrire ulteriori vantaggi. L’acido formico non si dissocia in presenza di HCl, quindi non si verifica alcuna reazione con il carbonato fino a quando l’HCl non è praticamente esaurito. Le miscele di HCl e acido formico possono quindi ottenere una maggiore penetrazione.
4.6.4. Acido formico come fonte di idrogeno e monossido di carbonio
In condizioni di idrolisi, lo ione formiato può formare uno ione bicarbonato e idrogeno.
HCO2– + H2O → HCO3– + H2
Sia il palladio che il carbone vegetale sono risultati attivi come catalizzatori.
La reazione di deidrogenazione è promossa da catalizzatori metallici.
HCOOH → CO2 + H2
C’è un crescente interesse per la generazione di idrogeno a base di acido formico o formiato di potassio nelle celle a combustibile. I vantaggi dell’applicazione in dispositivi portatili sono i lunghi tempi di funzionamento e la ricarica istantanea senza necessità di una presa elettrica.
La decomposizione dell’acido formico in presenza di acidi forti come l’acido solforico rappresenta una fonte pulita di CO per la chimica basata sul monossido di carbonio.
L’acido formico o i suoi sali possono essere utilizzati come fonte di idrogeno nelle reazioni chimiche senza la formazione di H2 come intermedio (meccanismo di reazione di Leuckart). La reazione, nota come idrogenazione per trasferimento, è selettiva ed è catalizzata da molti metalli, persino dalla polvere di zinco.
Quando si utilizzano complessi catalitici chirali, l’acido formico può fungere da fonte di idrogeno nell’idrogenazione asimmetrica, una fase di reazione comune nella sintesi di molti prodotti chimici fini e farmaceutici.
4.6.5. Detergenti
L’acido formico trova impiego come principio attivo in prodotti per la pulizia commerciali come disincrostanti, sverniciatori, detergenti e sgrassatori multiuso e prodotti per il bucato per uso pubblico. Nella disincrostazione, il sale di calcio si forma quando il carbonato di calcio viene sciolto da un acido.
Più questo sale è facilmente solubile, minore è il rischio di depositi di sale che ne riducono l’efficacia. Nei detergenti per il bagno, si sostiene che combini le proprietà di un efficace agente disincrostante con quelle di un biocida biodegradabile.
4.6.6. Uso dei solventi
L’acido formico può essere utilizzato per sciogliere poliammidi (ad esempio, nylon 66 e nylon 46) o seta per preparare fibre e membrane. È anche un componente utile nelle soluzioni detergenti per semiconduttori.
5. Tossicologia dell’acido formico
L’acido formico presenta una serie di effetti tossici a seconda della via di esposizione (inalazione, ingestione o contatto cutaneo) e della concentrazione.
Tossicità acuta:
- Pelle e mucose: L’acido formico è corrosivo e può causare necrosi (morte dei tessuti) a contatto con la pelle e irritazione/corrosione delle mucose nel punto di ingresso (occhi, bocca, vie nasali).
- Ingestione: Il metabolismo del metanolo può generare livelli tossici di acido formico, portando ad acidosi metabolica. L’ingestione orale di soluzioni di acido formico può causare grave irritazione e corrosione del tratto gastrointestinale.
- Inalazione: L’inalazione di vapori di acido formico irrita le vie respiratorie, con intensità crescente con la concentrazione. Concentrazioni elevate possono essere fatali.
- Assorbimento cutaneo: l’acido formico può essere facilmente assorbito attraverso la pelle, causando effetti sistemici.
La DL50 dopo somministrazione orale è stata riportata essere di 730 mg/kg nei ratti.
Nei ratti, la LC50 è di 7,85 mg/L dopo 4 ore di inalazione del vapore. I sintomi predominanti dell’assunzione per via inalatoria sono irritazione oculare, irritazione e corrosione delle mucose nasali e opacità corneale.
Nei conigli, la somministrazione endovenosa di acido formico tamponato in dosi comprese tra 0,46 e 1,25 g per chilogrammo di peso corporeo provoca depressione del SNC; dosaggi più elevati causano convulsioni. Dosi somministrate per via sottocutanea di 0,8 g/kg nei cani e superiori a 0,4 g/kg nei gatti causano barcollamento, mentre un dosaggio di 0,4 g/kg provoca sonnolenza nei gatti.
Nei cani, dosi letali somministrate per via endovenosa provocano convulsioni tonico-cloniche.
L’esposizione cronica all’acido formico a basse concentrazioni in studi su animali non ha mostrato effetti significativi sul peso corporeo o sul peso degli organi. Tuttavia, può ridurre i livelli di glutatione nel fegato e nei reni.
L’acido formico non ha mostrato potenziale genotossico in vari test in vitro e in vivo. Tuttavia, alcuni studi suggeriscono un effetto confondente del basso pH ad alte concentrazioni, che richiede ulteriori indagini.
Riferimento
- Acido formico, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/full/10.1002/14356007.a12_013.pub3
