Acetilene: proprietà, reazioni e tossicologia
Cos’è l’acetilene?
L’acetilene, noto anche come etino, è un gas incolore e infiammabile con formula chimica C2H2. È l’idrocarburo più semplice con un triplo legame. Trova un uso diffuso come combustibile nella saldatura e nel taglio ossiacetilenico grazie alla sua fiamma incredibilmente calda e come elemento chimico di base per vari prodotti chimici organici e plastiche.
L’acetilene era l’elemento fondamentale per la chimica organica industriale prima dell’adozione diffusa del petrolio come materia prima principale. Il processo carburo di calcio ha dominato esclusivamente la produzione di acetilene fino agli anni ’40, quando sono emersi metodi di cracking termico che utilizzavano metano e altri idrocarburi.
Le implementazioni iniziali impiegavano archi elettrici, ma gli anni ’50 hanno assistito allo sviluppo di processi di ossidazione parziale e rigenerativi.
Nonostante iniziative promettenti come il processo a fiamma sommersa di BASF, l’HTP di Hoechst e il processo al plasma di Hüls, la tendenza verso l’etilene come sostanza chimica fondamentale è rimasta incrollabile.
Tutti i processi dell’acetilene, compresi i metodi al carburo, sono ad alta intensità energetica, richiedono una notevole generazione e trasferimento di calore. Differiscono principalmente nel modo in cui questa energia viene generata e applicata.
- Per un articolo completo sulla produzione industriale di acetilene, visita il seguente link.
- Per informazioni dettagliate sugli usi dell’acetilene, visita il seguente link.
Sommario
1. Proprietà fisiche dell’acetilene
L’acetilene ha un triplo legame carbonio-carbonio (C≡C), caratterizzato da una breve lunghezza (0,1205 nm) e da un’elevata energia di formazione. Questa configurazione rende l’acetilene altamente instabile e reattivo a causa della sua natura insatura.
L’idrogeno acido dei legami C-H (pKa=25) contribuisce alla reattività dell’acetilene. È più acido dell’etilene (pKa=44) e può formare acetiluri con basi forti.
In condizioni standard, l’acetilene è un gas incolore e non tossico con proprietà narcotiche. Leggermente più leggero dell’aria, possiede distinte proprietà fisiche descritte nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Massa molecolare | 26,0379 g/mol |
| Temperatura critica | 308,32 K (35,17 °C) |
| Pressione critica | 6,139 MPa |
| Volume critico | 0,113 m3/kmol |
| Punto triplo | 192,4 K (−80,75 °C) |
| Pressione del punto triplo | 128,3 kPa |
| Punto di sublimazione normale e punto di ebollizione normale | 189,15 K (−84,0 °C) |
| Punto di transizione cristallina | 133,0 K (−140,15 °C) |
| Entalpia di transizione | 2,54 kJ/mol |
| Densità |
760,2 kg/m3 (131 K) 764,3 kg/m3 (141 K) |
| Densità (C2H2 liquido) | 465,2 kg/m3 (273,15 K) |
| Densità (C2H2 gassoso a 1 bar) | 1,095 kg/m3 (288,15 K) |
| Volume molecolare (0 °C, 1,013 bar) | 22,223 m3/kmol |
| Entalpia di vaporizzazione (calcolata) | 10,65 kJ/mol (273,15 K) |
| Entalpia di sublimazione | 21,168 kJ/mol (5,55 K) |
| Entalpia di formazione | 227,5 ± 1,0 kJ/mol (298,15 K) |
| Energia libera di Gibbs di formazione | 209,2 ± 1,0 kJ/mol (298,15 K) |
| Entropia di formazione | 200,8 J mol−1 K−1 (298,15 K) |
| Entalpia di combustione | −1255,6 kJ/mol (298,15 K) |
| Potere calorifico superiore | 50 400 kJ/kg |
| Potere calorifico inferiore | 48 700 kJ/kg |
| Pressione di vapore | 2,6633 MPa (273,15 K) |
| Conduttività termica (0 °C, 1,013 bar) | 0,0184 W m−1 K−1 |
| Capacità termica (stato di gas ideale) | 43,990 J mol−1 K−1 (298,15 K) |
2. Reazioni chimiche dell’acetilene
L’acetilene è altamente reattivo verso vari elementi e composti a causa della sua elevata insaturazione e dell’energia libera positiva di formazione. Questa caratteristica lo rende una materia prima versatile per numerose sostanze. I principali tipi di reazione includono reazioni di addizione, sostituzioni di idrogeno, polimerizzazione e ciclizzazione.
L’acetilene è più suscettibile all’attacco nucleofilo rispetto all’etilene. Inoltre, il suo legame C-H polarizzato (pKa ≈ 25) gli conferisce proprietà acide, facilitando la solubilità in solventi basici e la formazione di legami idrogeno. Questo comportamento si discosta dalla legge di Raoult per le soluzioni contenenti acetilene.
Lo sviluppo delle reazioni di pressione dell’acetilene da parte di W. Reppe ha segnato una svolta nella chimica dell’acetilene. I gruppi di reazione degni di nota includono vinilazione, etinilazione, carbonilazione e polimerizzazione ciclica e lineare.
2.1. Reazioni di importanza industriale
1. Vinilazione:
La vinilazione comporta l’aggiunta di composti con atomi di idrogeno mobili (acqua, alcoli, tioli, ammine, ecc.) all’acetilene, producendo derivati vinilici utilizzati principalmente per la polimerizzazione.
Esistono due tipi: eterovinalazione (idrogeno da O, S o N) e C-vinilazione (idrogeno carbonioso legato direttamente). Esempi includono la dimerizzazione dell’acetilene, la trimerizzazione, la sintesi dell’acrilonitrile e l’aggiunta a idrocarburi insaturi reattivi come il ciclopentadiene.
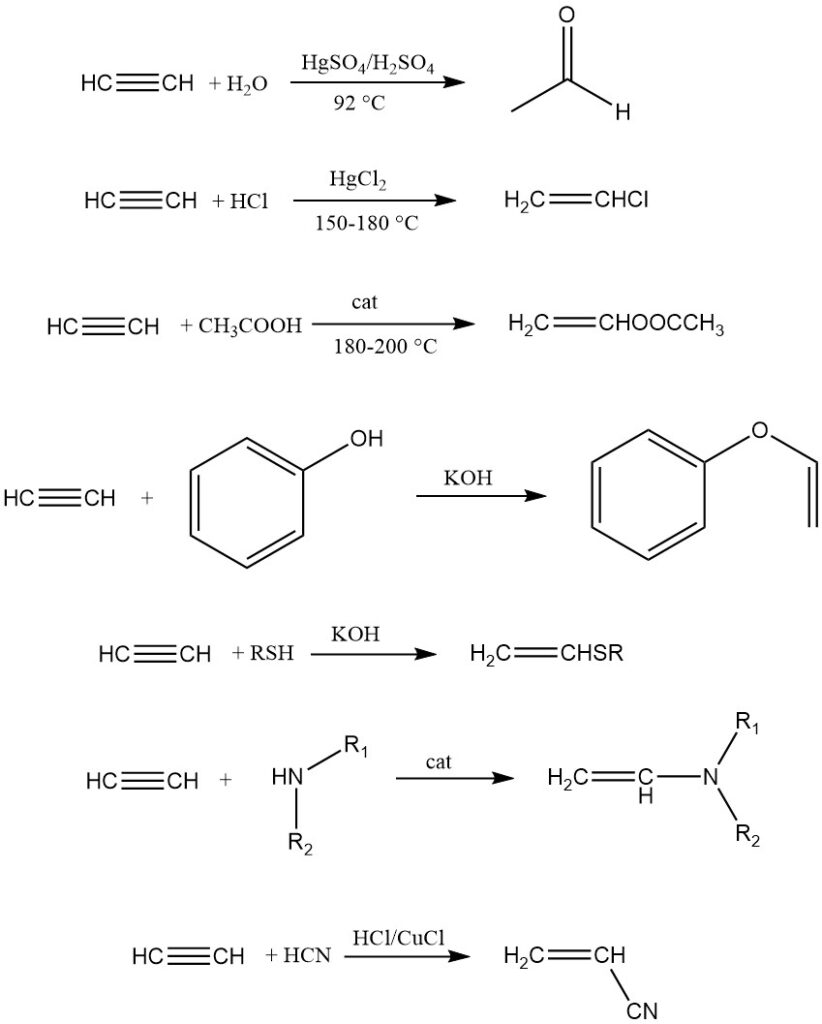
2. Etinilazione:
L’etinilazione aggiunge composti carbonilici all’acetilene preservando il triplo legame. Reppe ha scoperto che gli acetiluri di metalli pesanti, in particolare Cu2C2·2 H2O·2 C2H2, catalizzano efficacemente la reazione con le aldeidi.
L’etinilazione dei chetoni è catalizzata con catalizzatori alcalini. Lo schema generale della reazione è:

L’alcol propargilico e il butynediolo sono i prodotti chiave di questa reazione.

3. Carbonilazione:
La carbonilazione comporta la reazione di acetilene e monossido di carbonio con composti che possiedono atomi di idrogeno mobili, catalizzata da carbonili metallici (ad esempio, Ni(CO)4). Possono essere utilizzati anche alogenuri metallici in grado di formare carbonili.
L’acido acrilico è un prodotto di spicco ottenuto da acetilene, acqua e monossido di carbonio utilizzando il catalizzatore Ni(CO)4. Altri prodotti della carbonilazione dell’acetilene includono tioesteri dell’acido acrilico, ammidi acriliche, anidridi di acido carbossilico e idrochinone.

4. Ciclizzazione e polimerizzazione:
L’acetilene, sotto opportuni catalizzatori, può subire ciclizzazione e polimerizzazione lineare. Berthelot osservò per primo la ciclizzazione, producendo una miscela di composti aromatici come benzene e naftalene. Reppe in seguito sintetizzò 1,3,5,7-cicloottatetraene con elevata resa (70%).
La polimerizzazione lineare avviene con sali di rame (I), dando origine a vinilacetilene, divinilacetilene, ecc. Un esempio notevole è il cuprene, formato riscaldando l’acetilene con spugna di rame. I catalizzatori Ziegler-Natta facilitano la formazione di poliacetilene, che esibisce proprietà uniche come la conduttività al momento del drogaggio.

2.2. Altre reazioni e derivati
1. Acetiluri metallici:
L’acetilene forma acetiluri metallici sostituendo i suoi atomi di idrogeno con atomi metallici (M). Gli acetiluri alcalini e alcalino-terrosi vengono preparati tramite ammidi metalliche o reazione diretta con metalli fusi o finemente suddivisi.

Gli acetiluri di rame esplosivi (Cu2C2·H2O) si formano per reazione di sali di rame (I) con acetilene in ammoniaca liquida o sali di rame (II) con acetilene in soluzione basica con agenti riducenti come idrossilammina.
Inoltre, gli ossidi di rame e altri sali di rame possono facilmente convertirsi in acetiluri. A causa di questa reattività, le tubature in rame dovrebbero essere rigorosamente evitate nei sistemi ad acetilene. Esistono altri acetiluri metallici esplosivi per argento, oro e mercurio.
2. Alogenazione:
Il cloro si aggiunge all’acetilene con FeCl3 come catalizzatore per produrre 1,1,2,2-tetracloroetano, un importante intermedio nella produzione di solventi. Anche il bromo e lo iodio possono partecipare alle reazioni di addizione, con lo iodio che si ferma a 1,2-diiodoetilene.
3. Idrogenazione:
L’acetilene subisce un’idrogenazione parziale o completa su catalizzatori di Pt, Pd o Ni, con conseguente formazione di etilene o etano.
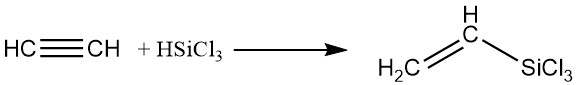
4. Composti organici di silicio:
I silani possono essere aggiunti all’acetilene utilizzando catalizzatori di platino nella fase liquida, producendo derivati contenenti silicio.
5. Ossidazione:
L’acetilene è resistente all’ossidazione a temperatura ambiente, ma forma miscele esplosive con aria o ossigeno. Agenti ossidanti come l’ozono o l’acido cromico lo convertono in acido formico, anidride carbonica e altri prodotti. La reazione con ozono diluito produce gliossale.
6. Idrati:
Sotto pressione e temperature inferiori a circa 15 °C, l’acetilene forma idrati cerosi con la composizione C2H2·6 H2O. Queste strutture simili a clatrati incorporano molecole d’acqua nel loro reticolo cristallino, influenzando lo stoccaggio e la manipolazione dell’acetilene. La formazione di idrati può causare blocchi delle apparecchiature e presentare rischi di decomposizione dovuti alle onde d’urto.
7. Cloroacetileni:
7.1. Monocloroacetilene (HC≡CCl):
Il monocloroacetilene è un gas dall’odore nauseabondo che irrita le mucose. Si ottiene facendo reagire 1,2-dicloroetilene con NaOH alcolico in presenza di Hg(CN)2. È altamente infiammabile ed esplode facilmente in presenza anche di tracce di ossigeno o aria ed è estremamente velenoso.
7.2. Dicloroacetilene (ClC≡CCl):
Il dicloroacetilene è un olio incolore dall’odore sgradevole che esplode nell’aria o quando riscaldato. Si prepara dall’acetilene in una soluzione fortemente alcalina di ipoclorito di potassio o facendo reagire il vapore di tricloroetilene con alcali caustici. È altamente esplosivo e si decompone facilmente, presentando notevoli problemi di sicurezza.
3. Tossicologia dell’acetilene
L’acetilene puro agisce come un semplice asfissiante spostando l’ossigeno nell’atmosfera. Tuttavia, l’acetilene commerciale non contiene più quantità significative di impurità tossiche come arsina, idrogeno solforato e fosfina, che storicamente hanno contribuito a effetti negativi sulla salute derivanti dall’esposizione all’acetilene prodotto dal carburo di calcio.
La più bassa concentrazione letale (LC) documentata per i ratti è del 9% in volume nell’aria. I cani mostrano una maggiore tolleranza, richiedendo l’80% di acetilene per indurre narcosi con aumento della pressione sanguigna e diminuzione della frequenza cardiaca (indicando stimolazione vasomotoria e del nervo vago).
Negli esseri umani, l’inalazione del 10% di acetilene produce una lieve intossicazione, mentre il 20% causa un’intossicazione significativa e il 30% porta a mancanza di coordinazione. L’incoscienza si verifica entro 5 minuti con un’esposizione del 35%.
L’inalazione letale comporta il 35% per 5-10 minuti o il 10% per 30-60 minuti. I sintomi di intossicazione includono eccitazione, coma, cianosi, polso debole/irregolare e perdita di memoria.
Nessuna prova suggerisce effetti dannosi sulla salute derivanti da ripetute esposizioni a livelli tollerabili di acetilene. È interessante notare che studi sull’uomo hanno rivelato una ridotta suscettibilità in caso di ripetute esposizioni.
Mentre inizialmente l’acetilene al 33% induceva incoscienza entro 6 minuti, le esposizioni successive nella stessa settimana richiedevano durate più lunghe (9 minuti la seconda e oltre 33 minuti la terza) per ottenere lo stesso effetto.
A differenza di altri gas, l’acetilene non irrita le mucose. In particolare, non è stato stabilito alcun valore limite di soglia (TLV) o concentrazione massima ammissibile (MAK) per l’acetilene.
L’attuale limite di esposizione ammissibile (PEL) dell’Amministrazione per la sicurezza e la salute sul lavoro (OSHA) e del National Institute for Occupational Safety and Health (NIOSH) è di 2500 ppm (parti per milione) nell’aria.
Riferimento
- Acetylene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_097.pub4
