Production et utilisations du chlorure d’ammonium

Le chlorure d’ammonium, NH4Cl, est naturellement présent dans les matériaux volcaniques, mais son extraction à partir de sources naturelles revêt une importance minime. La production industrielle de NH4Cl est étroitement liée à l’avancement de l’industrie de la soude et à la synthèse à grande échelle de NH3 synthétique.
Initialement destiné à être utilisé comme engrais, le chlorure d’ammonium trouve aujourd’hui des applications dans divers domaines. Ses procédés de production présentent un intérêt particulier pour le génie chimique en raison de leur importance historique en tant qu’exemple précoce de traitement chimique comprenant les trois phases : solide, liquide et gazeuse.
Table des matières
1. Propriétés du chlorure d’ammonium
La masse molaire du chlorure d’ammonium est de 53,49 g / mol et c’est un solide avec une densité spécifique de 1,530 à 20 ° C. Sa chaleur spécifique moyenne, cp, comprise entre 298 K et 372 K, est mesurée à 1,63 kJ/kg. Le chlorure d’ammonium a deux formes cristallines réversibles, la transformation entre elles se produisant à 457,6 K (184,5 ° C).
La forme stable à température ambiante est la forme α, tandis que le β-NH4Cl (cubique ; type NaCl) fond à 793,2 K sous 3,45 MPa et se sublime à pression atmosphérique. À des températures plus basses, NH4Cl est relativement volatil et se dissocie en NH3 et HCl.
La solubilité du NH4Cl dans l’eau augmente avec l’augmentation de la température. La chaleur intégrale de la solution à saturation est de +15,7 kJ/mol et la chaleur différentielle de la solution à saturation est de +15,2 kJ/mol.
L’ajout d’ammoniac peut améliorer la solubilité dans l’eau, tandis que la présence de NaCl a tendance à précipiter le NH4Cl des solutions ammoniacales. NH4Cl présente également de faibles propriétés hygroscopiques.
L’humidité peut provoquer l’agglutination du produit, et il n’est pas certain que des teneurs en humidité inférieures à 0,1 % en poids soient à elles seules responsables de l’agglutination du chlorure d’ammonium. La sublimation pourrait être une autre explication potentielle de ce phénomène.
Le chlorure d’ammonium est très soluble dans le NH3 liquide mais pratiquement insoluble dans l’acétone et la pyridine. À 292,7 K, il présente une solubilité de 3,24 % en poids dans le méthanol et de 0,64 % en poids dans l’éthanol.
La forme cristalline obtenue à partir de solutions aqueuses de NH4Cl peut être influencée par d’autres substances, qui ont été exploitées pour produire de gros cristaux et aident à identifier les impuretés lors de la production de NH4Cl.
2. Production de chlorure d’ammonium
La production commerciale de chlorure d’ammonium implique deux procédés principaux :
1. Procédé Solvay modifié (Ammonia – Soda Ash Process ou ASAP) : C’est l’une des méthodes largement utilisées pour la production commerciale de NH4Cl. Il s’agit de la réaction entre l’ammoniac et le carbonate de soude (carbonate de sodium) pour produire du bicarbonate d’ammonium, qui est ensuite converti en chlorure d’ammonium par chauffage.
2. Réaction directe entre HCl et NH3 : Dans ce processus, le chlorure d’ammonium est directement formé par la réaction entre l’acide chlorhydrique (HCl) et l’ammoniac (NH3).
De plus, il existe un troisième processus connu sous le nom de réaction de paires réciproques de sels, qui est toujours intéressant d’un point de vue scientifique, mais il n’a pas encore été appliqué commercialement pour la production de chlorure d’ammonium.
2.1. Procédé Solvay modifié (ammoniac – carbonate de soude)
Dans le procédé Solvay, la production de chlorure d’ammonium et de carbonate de sodium est réalisée par une série de réactions. L’ammoniac et le dioxyde de carbone sont dissous dans une solution aqueuse de chlorure de sodium, ce qui entraîne la formation de bicarbonate de sodium peu soluble.
Ce bicarbonate de sodium est ensuite chauffé (calciné) pour donner du carbonate de sodium. L’ammoniac est récupéré du liquide restant (liqueur mère) en le faisant réagir avec de la chaux, qui génère également du chlorure de calcium.
Les principales sources de chaux et de dioxyde de carbone sont le calcaire. La réaction globale implique la conversion du sel gemme et du calcaire en carbonate de sodium et en chlorure de calcium comme sous-produits.
Pour compenser les pertes des plantes, seules les quantités nécessaires d’eau, de dioxyde de carbone et d’ammoniac sont ajoutées. Le choix des matières premières et les produits qui en résultent déterminent l’emplacement d’une usine Solvay, faisant de ces usines des unités largement indépendantes.
Le procédé Solvay modifié, connu sous le nom de procédé chlorure d’ammonium – carbonate de soude, est un exemple précoce de production industrielle intégrée impliquant deux substances. Dans ce procédé modifié, le chlorure d’ammonium est en outre précipité à partir de la liqueur mère. La réaction globale de ce processus est :
2NH3 + CO2 + H2O + 2NaCl → 2NH4Cl + Na2CO3
Les quantités de chlorure d’ammonium et de carbonate de sodium produites sont presque égales : deux moles (107 g) de NH4Cl sont générées pour chaque mole (106 g) de Na2CO3. Le procédé modifié nécessite du NH3 et du CO2 externes et doit être intégré dans un système d’usines interconnectées.
De plus, le traitement des gaz résiduaires contenant de l’ammoniac est effectué à des fins environnementales, plutôt que simplement pour réduire les pertes de NH3 et de CO2. Le bilan énergétique du procédé modifié diffère considérablement de celui du procédé Solvay traditionnel en raison des charges d’alimentation et des produits distincts impliqués.
2.1.1. Description du processus
Dans le processus de fabrication de NH4Cl et de Na2CO3, un processus de recyclage à fonctionnement continu est utilisé, les concentrations étant ajustées selon que le chlorure d’ammonium ou le carbonate de sodium est le produit principal. Il a été initialement développé par BASF, ce procédé se concentre sur le NH4Cl comme produit principal (Figure 1).
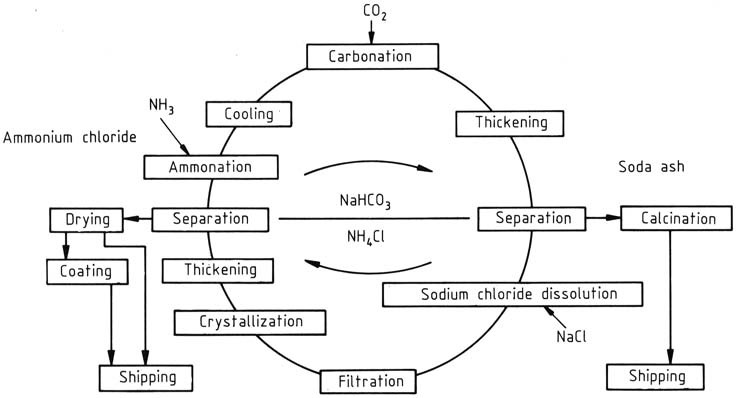
Le cycle commence par l’ajout d’ammoniac et de dioxyde de carbone à une solution aqueuse de recyclage. Le bicarbonate d’ammonium formé réagit ensuite avec le chlorure de sodium dans la solution, conduisant à la génération de chlorure d’ammonium et de bicarbonate de sodium peu soluble. Ce dernier est séparé et lavé à l’aide d’une centrifugeuse puis calciné pour produire du carbonate de sodium.
Le chauffage du bicarbonate de sodium restant dans la liqueur mère à 337,2 K le décompose. Le carbonate de sodium hautement soluble n’interfère pas avec la cristallisation du chlorure d’ammonium.
La température élevée de la solution est utilisée pour dissoudre rapidement la charge de sel gemme, introduite à travers des réservoirs de mélange, la quantité étant ajustée en fonction du bilan matière sur l’ensemble du cycle.
Les impuretés insolubles, telles que les sulfates, les sels de fer, de calcium et de magnésium, sont filtrées. L’élimination des résidus, une préoccupation croissante, est abordée en utilisant du sel plus pur comme matière première au lieu du sel gemme.
Le chlorure d’ammonium est récupéré par cristallisation en deux étapes utilisant un refroidissement indirect. La suspension résultante du cristalliseur est épaissie dans des hydrocyclones et le solide est séparé et lavé dans une centrifugeuse.
Le solide avec une teneur en eau d’environ 5 à 7 % en poids est ensuite séché dans un séchoir à courant pour réduire la teneur en humidité à moins de 0,1 %. Le produit final peut recevoir un revêtement d’agent anti-agglomérant. Après l’élimination du chlorure d’ammonium, le cycle est terminé et la liqueur mère peut être réutilisée.
Asahi Glass a développé un procédé alternatif qui produit du carbonate de sodium comme produit principal. Dans ce procédé, l’ammoniac est ajouté à la liqueur mère avant la cristallisation du chlorure d’ammonium. Le sel brut broyé peut être ajouté avec ou sans lavage et est dissous dans la solution.
Le refroidissement de la solution en dessous de 20°C provoque la cristallisation du chlorure d’ammonium. Les cristaux sont séparés à l’aide d’un séparateur centrifuge et la liqueur mère est recyclée vers la section de carbonatation. Les cristaux de chlorure d’ammonium sont séchés pour réduire la teneur en humidité à moins de 0,3 % dans un séchoir à lit rotatif ou fluidisé. La taille des cristaux peut être contrôlée pour diverses applications.
Dans la section de carbonatation, la solution est passée dans une tour de carbonatation, où le bicarbonate de sodium précipite par réaction avec le dioxyde de carbone à 30 – 40°C.
La bouillie résultante est séparée en cristaux de bicarbonate de sodium et en liqueur mère. La liqueur mère est dirigée vers la section d’absorption d’ammoniac. Les cristaux séparés sont calcinés et transformés en carbonate de soude dense.
Le procédé Asahi Glass comprend toutes les étapes du procédé BASF illustrées à la figure 1 avec une séquence différente. L’ammoniac est ajouté après la séparation du bicarbonate de sodium. La chaleur dégagée lors de l’ajout d’ammoniac fournit l’énergie nécessaire pour décomposer le bicarbonate de sodium restant.
Bien que des économies d’énergie soient observées grâce à cette approche, la demande énergétique plus élevée dans l’étape de cristallisation compense certains des avantages, car le chlorure d’ammonium est plus soluble dans les solutions riches en ammoniac.
Le procédé peut comprendre une étape de lavage de l’alimentation en sel gemme avant la mise en solution pour éliminer le besoin de filtration avant la cristallisation. Avec ou sans lavage, ce processus maximise l’utilisation du sel brut, une considération importante au Japon où le sel doit être importé.
2.1.2. Problèmes de pollution
Les problèmes de pollution liés au fonctionnement des centrales ne sont pas graves et peuvent être efficacement gérés par une exploitation prudente. Avec des mesures appropriées, la production de flux d’eaux usées peut être considérablement réduite, voire entièrement éliminée. Cependant, toute eau usée produite en raison de sa forte teneur en ammoniac nécessitera un traitement approprié.
Pour lutter contre les émissions gazeuses, une solution pratique consiste à épurer les gaz résiduaires avec de l’acide chlorhydrique, ce qui entraîne la production de chlorure d’ammonium supplémentaire.
En règle générale, des conversions élevées d’ammoniac d’environ 98 % et des conversions de sel gemme d’environ 95 % sont atteintes, bien que les valeurs exactes puissent varier en fonction du type de processus spécifique et des mesures environnementales mises en œuvre. Cette approche permet de minimiser les émissions gazeuses et contribue à la durabilité environnementale globale du processus de fabrication.
2.1.3. Grades et capacité
En 1997, après la fermeture de plusieurs usines de production en raison d’une demande réduite du marché, la capacité estimée de production de NH4Cl par le procédé Solvay modifié dans l’hémisphère occidental et au Japon était d’environ 100 000 tonnes par an.
En Asie, la production d’un produit granulaire contenant plus de 97 % de NH4Cl est courante. Ce NH4Cl de qualité engrais contient généralement plus de 25 % en poids d’azote ammoniacal. Ces usines se concentrent principalement sur la production de carbonate de soude, le NH4Cl étant un sous-produit.
Cependant, si l’intérêt principal est la production de NH4Cl, le processus peut être adapté pour atteindre des puretés plus élevées. Des niveaux de pureté supérieurs à 99,7 % en poids de NH4Cl, avec moins de 0,25 % en poids de NaCl et moins de 3 ppm de Fe, peuvent être atteints, ce qui convient à la plupart des applications industrielles.
Pour les applications spéciales nécessitant du NH4Cl de qualité réactif, une production à grande échelle est possible en utilisant des techniques d’exploitation spécifiques sans nécessiter d’étapes de traitement supplémentaires.
Du chlorure d’ammonium de qualité réactif contenant moins de 0,01 % en poids de NaCl et répondant à la spécification ACS (American Chemical Society) peut être obtenu. Ce NH4Cl de pureté supérieure convient aux applications qui exigent une qualité et une précision exceptionnelles dans les processus chimiques.
2.2. Réaction directe entre HCl et NH3
La synthèse de NH4Cl à partir de HCl et de NH3 peut être économiquement avantageuse, en particulier lorsque HCl est disponible comme charge d’alimentation à faible coût ou gratuitement.
Le procédé Engeclor, développé par la société brésilienne Engeclor, réalise la réaction en solution aqueuse. L’ammoniac est introduit dans la section conique d’un saturateur, tandis que HCl, dilué avec de l’air, est passé dans la suspension NH4Cl.
La réaction a lieu à 353 K sous pression réduite, avec un excès de NH3 pour maintenir un pH de 8. La suspension résultante est prélevée à la base du saturateur, épaissie à l’aide d’hydrocyclones, et NH4Cl est séparé du mélange dans une centrifugeuse et puis séché.
La liqueur mère est recyclée vers le saturateur. Pour contrôler les émissions, les gaz résiduaires du saturateur sont lavés avec de l’eau.
Des schémas alternatifs ont été proposés où des charges d’alimentation gazeuses sont introduites dans des solvants non aqueux. Dans ces cas, la chaleur de réaction (-176 kJ/mol) est évacuée par évaporation des solvants qui sont ensuite condensés.
Certains procédés en lit fluidisé ont également été décrits à cet effet. Pour éviter la formation d’aérosols, le dioxyde de carbone est suggéré comme gaz porteur dans les lits fluidisés.
La production annuelle mondiale estimée de NH4Cl par le procédé HCl-NH3 était de 50 000 tonnes en 1997. Le NH4Cl produit à l’aide de cette méthode contient moins de 0,1 % en poids de NaCl.
La teneur en métaux, en particulier la teneur en métaux lourds, peut varier en fonction de la plante spécifique. Généralement, les niveaux de métaux dans le NH4Cl produit par ce procédé sont plus élevés que ceux du procédé Solvay modifié.
2.3. Réaction des paires réciproques de sels
La réaction de paires réciproques de sels reste une méthode d’intérêt. Certaines paires de sels appropriées comprennent (NH4)2SO4 – KCl, ce qui entraîne la formation de NH4Cl – K2SO4 et (NH4)2SO4 – NaCl, ce qui conduit à la production de NH4Cl – Na2SO4.
Le défi avec ces paires de sels est la plus faible pureté du NH4Cl en raison de la teneur relativement élevée en sulfate. NH4Cl et KNO3 peuvent être obtenus par la réaction de NH4NO3 et KCl. Le KNO3 de haute pureté peut être utilisé dans la production d’explosifs, tandis que le NH4Cl d’une pureté minimale de 96 % convient comme engrais.
De plus, la préparation de NaNO3 et NH4Cl à partir de NaCl et NH4NO3 a fait l’objet de recherches. Ce procédé explore la possibilité d’obtenir ces deux sels à partir de leurs sels précurseurs respectifs.
3. Utilisations du chlorure d’ammonium
Le chlorure d’ammonium trouve de nombreuses applications agricoles et industrielles :
3.1. Utilisation agricole
Au Japon, en Chine et en Asie du Sud-Est, le chlorure d’ammonium est largement utilisé comme engrais azoté très efficace pour le riz paddy et pluvial, le blé et diverses autres cultures.
Au Japon, une partie importante de la production annuelle de NH4Cl est utilisée pour les engrais composés de haute qualité, tels que le phosphate de chloro-ammonium, le phosphate de chloro-potasse-ammonium, le phosphate de magnésie-chloro-potasse-ammonium et les mélanges azote-potasse. Cependant, son utilisation comme engrais est limitée en raison de son acidité et de sa forte teneur en chlore.
3.2. Usage industriel
Le chlorure d’ammonium de qualité technique est utilisé dans diverses applications industrielles :
- Électrolytes solides : Il sert de composant vital dans les piles sèches.
- Explosifs de carrière : Une forme fine de chlorure d’ammonium est utilisée comme composant dans les explosifs à des fins d’extraction.
- Durcisseurs pour adhésifs : Il agit comme agent de durcissement dans les adhésifs à base de formaldéhyde.
- Solutions de gravure : Le chlorure d’ammonium, ainsi que d’autres produits chimiques, est utilisé dans la production de cartes de circuits imprimés.
- Flux dans le placage : C’est un composant, avec le chlorure de zinc, dans les flux utilisés pour le placage d’étain et de zinc.
- Photographie : Il sert d’additif fixateur rapide en photographie.
- Additifs de nettoyage : Le chlorure d’ammonium est utilisé comme additif dans les produits de nettoyage.
- Nutriment dans les cultures de levure: Il est utilisé comme nutriment dans les cultures de levure pour diverses applications.
- Tannage : Dans l’industrie du tannage, le chlorure d’ammonium trouve des applications.
- Raffinage des métaux précieux : Il est utilisé dans le processus de raffinage des métaux précieux.
- Impression et teinture de textiles : Le chlorure d’ammonium est utilisé dans l’impression et la teinture de textiles.
- Industrie du caoutchouc : Il trouve des applications dans l’industrie du caoutchouc.
- Tuiles et briques : du chlorure d’ammonium peut être ajouté aux tuiles et aux briques avant la cuisson pour contrôler la porosité et accélérer le processus de cuisson.
3.3. Applications de haute pureté
Le chlorure d’ammonium de haute pureté est utilisé dans les industries alimentaires et pharmaceutiques, ainsi que dans des synthèses chimiques spécifiques.
Il est à noter que l’utilisation de NH4Cl comme durcisseur pour les adhésifs à base de formaldéhyde a considérablement diminué en raison de sa substitution par des produits sans chlorure.
Références
- Ammonium Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
Process of making ammonium chloride. – https://patents.google.com/patent/US2133513A/en
FAQ
Le chlorure d’ammonium (NH4Cl) est un composé chimique composé d’ammoniac (NH3) et d’acide chlorhydrique (HCl). Il existe sous la forme d’un solide cristallin blanc au goût salé caractéristique et est communément appelé sal ammoniac.
Oui, le chlorure d’ammonium est un sel. Il est formé par la réaction d’un acide (HCl) et d’une base (NH3).
NH4Cl est un acide. Il est formé par la réaction d’un acide fort, à savoir l’acide chlorhydrique (HCl) avec une base faible, à savoir l’hydroxyde d’ammonium (NH4OH) .
Le chlorure d’ammonium a diverses applications :
- Il sert d’engrais azoté efficace pour diverses cultures, notamment le riz, le blé, etc.
- Dans le secteur industriel, il est utilisé dans les batteries sèches, les explosifs, les adhésifs, la fabrication de circuits imprimés et les processus de placage.
- Il trouve une utilisation dans la photographie, les additifs de nettoyage, les cultures de levure, le tannage, le raffinage des métaux précieux, l’impression textile et l’industrie du caoutchouc.
- Le chlorure d’ammonium de haute pureté est utilisé dans l’alimentaire, la pharmacie et certaines synthèses chimiques.
Le chlorure d’ammonium peut être produit par diverses méthodes, dont l’une consiste à faire réagir du gaz ammoniac (NH3) avec de l’acide chlorhydrique (HCl) dans une solution aqueuse. Le chlorure d’ammonium résultant est ensuite séparé et séché pour être utilisé.
Le chlorure d’ammonium doit être éliminé conformément aux réglementations et directives locales relatives à l’élimination des déchets chimiques. Il est essentiel de suivre les procédures appropriées pour éviter la contamination de l’environnement.
Lorsqu’il est chauffé, le chlorure d’ammonium subit une sublimation, ce qui signifie qu’il passe directement d’un solide à un gaz sans fondre. Il se décompose en gaz ammoniac (NH3) et chlorure d’hydrogène (HCl).
Le chlorure d’ammonium se présente sous la forme d’un solide cristallin blanc ou d’une poudre à texture granuleuse. Il est inodore et a un goût salé distinctif.
