Production d’acides nitrobenzoïques
Table des matières
Acide 2-nitrobenzoïque ou acide o-nitrobenzoïque

L’acide 2-nitrobenzoïque est un acide mononitrobenzoïque où le groupe nitro est en position ortho par rapport au groupe carboxylique. C’est un solide insoluble dans l’eau et soluble dans l’alcool comme le méthanol.
Propriétés physiques de l’acide 2-nitrobenzoïque
Les propriétés physiques de l’acide 2-nitrobenzoïque sont énumérées ci-dessous :
- Masse molaire = 167,12 g/mol
- Point de fusion = 148 °C
- Densité = 1,575
- Solubilité dans l’eau = 0,75 g/100 ml (à 25 °C)
- Solubilité dans le méthanol = 42,72 g/100 ml (à 10 °C)
- Solubilité dans le benzène = 0,294 g/100 ml (à 10 °C)
- Constante de dissociation, Ka (à 18 °C) = 6,1 × 10-3
- Température de décarboxylation = 180 °C
Réactions chimiques de l’acide 2-nitrobenzoïque
L’acide 2-nitrobenzoïque subit les réactions typique des acides carboxyliques aromatiques et des composés nitroaromatiques :
L’acide anthranilique peut être produit par la réduction du groupe nitro en une amine.
Le groupe carboxylique forme des esters avec des alcools et du chlorure de 2-nitrobenzoyle avec des agents de chloration.
À des températures supérieures à 180 ° C, l’acide 2-nitrobenzoïque forme du nitrobenze par décarboxylation.
Le cycle aromatique peut subir des réactions de substitution, mais cela est difficile en raison de la présence de groupes désactivants.
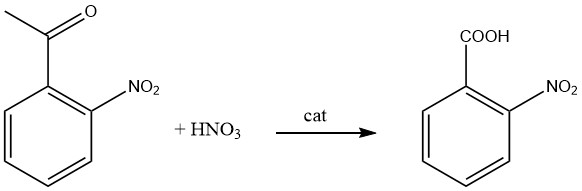
Production d’acide 2-nitrobenzoïque
L’acide 2-nitrobenzoïque est préparé par oxydation du 2-nitrotoluène avec de l’acide nitrique.

Monsanto Chemicals Ltd. avait développé une méthode de production d’acide 2-nitrobenzoïque par oxydation de 2-nitroacétphénone avec de l’acide nitrique aqueux en présence de métavanadate d’ammonium comme catalyseur sous reflux.
Huit moles d’acide nitrique sont nécessaires pour convertir une mole de 2-nitroacétophénone à une température allant de 60 °C à la température de reflux du mélange.
En refroidissant le mélange réactionnel, les cristaux d’acide 2-nitrobenzoïque brut se forment et sont récupérés par filtration, puis purifiés par recristallisation dans des solvants tels que le benzène, l’éthanol, les mélanges benzène-éthanol, l’hexane, etc.
Acide 3-nitrobenzoïque ou acide m-nitrobenzoïque

L’acide 3-nitrobenzoïque est un solide blanc dont les substituants carboxylique et nitro sont en position méta l’un par rapport à l’autre, c’est pourquoi on l’appelle aussi acide m-nitrobenzoïque. C’est un précurseur important dans la production de colorants.
Propriétés physiques de l’acide 3-nitrobenzoïque
Les propriétés physiques de l’acide 3-nitrobenzoïque sont énumérées ci-dessous :
- Masse molaire = 167,12 g/mol
- Point de fusion = 142 °C
- Densité = 1,494
- Solubilité dans l’eau = 0,24 g/100 ml (à 15 °C)
- Solubilité dans le méthanol = 47,34 g/100 ml (à 10 °C)
- Solubilité dans le benzène = 0,795 g/100 ml (à 10 °C)
- Constante de dissociation, Ka (à 25 °C) = 3,48 × 10-4
- Température de décarboxylation = 238 °C
Réactions chimiques de l’acide 3-nitrobenzoïque
L’acide 3-nitrobenzoïque subit les réactions typiques des acides carboxyliques aromatiques et des composés nitroaromatiques :
L’acide 3-aminobenzoïque peut être produit par la réduction du groupe nitro en une amine.
Le groupe carboxylique forme des esters avec des alcools et du chlorure de 3-nitrobenzoyle avec des agents de chloration.
À des températures supérieures à 238 ° C, l’acide 3-nitrobenzoïque forme du nitrobenze par décarboxylation.
Le cycle aromatique peut subir des réactions de substitution, mais cela est difficile en raison de la présence de groupes désactivants.
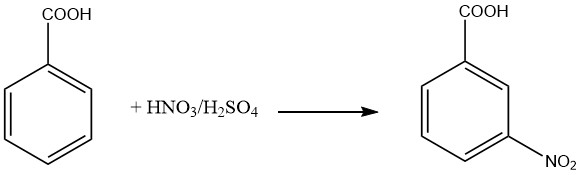
Production d’acide 3-nitrobenzoïque
L’acide 3-nitrobenzoïque est préparé par nitration de l’acide benzoïque dans des conditions de basse température. Au cours de ce processus, environ 20% de l’isomère 2-nitro et 1,5% de l’isomère 4-nitro sont produits aux côtés de l’acide 3-nitrobenzoïque souhaité. Pour obtenir de l’acide 3-nitrobenzoïque purifié, la recristallisation du sel de sodium peut être employée.
Un rendement plus élevé en 3-nitrobenzaldéhyde, un précurseur de l’acide 3-nitrobenzoïque, peut être obtenu par l’oxydation contrôlée du benzaldéhyde. L’acide 3-nitrobenzoïque sert d’intermédiaire dans la synthèse de l’acide 3-aminobenzoïque et des colorants azoïques. Son dérivé, l’acide 4-chloro-3-nitrobenzoïque, agit comme intermédiaire dans la production de colorants.
Acide 4-nitrobenzoïque ou acide p-nitrobenzoïque
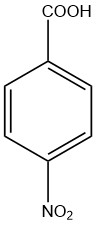
L’acide 4-nitrobenzoïque est un acide mono nitrobenzoïque avec les deux groupes en position para l’un avec l’autre. Il est aussi appelé acide para-nitrobenzoïque. C’est un solide jaune pâle insoluble dans l’eau et légèrement soluble dans le méthanol.
Propriétés physiques de l’acide 4-nitrobenzoïque
Les propriétés physiques de l’acide 4-nitrobenzoïque sont les suivantes :
- Masse molaire = 167,12 g/mol
- Point de fusion = 240 °C
- Densité = 1,61
- Solubilité dans l’eau = 0,02 g/100 ml (à 15 °C)
- Solubilité dans le méthanol = 9,6 g/100 ml (à 10 °C)
- Solubilité dans le benzène = 0,017 g/100 ml (à 12,5 °C)
- Constante de dissociation, Ka (à 25 °C) = 3,93 × 10-4
- Température de décarboxylation > 240 °C
Réactions chimiques de l’acide 4-nitrobenzoïque
L’acide 4-nitrobenzoïque subit la réaction typique des acides carboxyliques aromatiques et des composés nitroaromatiques :
L’acide 4-aminobenzoïque peut être produit par la réduction du groupe nitro en une amine.
Le groupe carboxylique forme des esters avec des alcools et du chlorure de 4-nitrobenzoyle avec des agents de chloration qui est une matière de départ pour le chlorhydrate de procaïne et l’acide folique.
À des températures supérieures à 240 ° C, l’acide 4-nitrobenzoïque forme du nitrobenze par décarboxylation.
Le cycle aromatique peut subir des réactions de substitution, mais cela est difficile en raison de la présence de groupes désactivants.
Production d’acide 4-nitrobenzoïque
L’acide 4-nitrobenzoïque est produit commercialement par oxydation du 4-nitrotoluène avec de l’oxygène moléculaire. L’oxydation avec de l’acide nitrique à 15 % à 175 °C produit l’acide avec un rendement de 88,5 %.

Monsanto Chemicals Ltd. avait développé une méthode de production d’acide 4-nitrobenzoïque par oxydation de 4-nitroacétphénone avec de l’acide nitrique aqueux en présence de métavanadate d’ammonium comme catalyseur sous reflux.
Huit moles d’acide nitrique sont nécessaires pour convertir une mole de 4-nitroacétophénone à une température allant de 60 °C à la température de reflux du mélange.
En refroidissant le mélange réactionnel, les cristaux d’acide 4-nitrobenzoïque brut se forment qui sont récupérés par filtration, puis purifiés par recristallisation dans des solvants tels que le benzène, l’éthanol, les mélanges benzène-éthanol, l’hexane, etc.

Une méthode intéressante implique la nitration et l’oxydation subséquente du polystyrène. Cette méthode utilise l’encombrement stérique de la chaîne polymère pour améliorer le rapport para à ortho du produit.
Référence
- Benzoic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_555
Preparation of 2-and 4-nitrobenzoic acid. – https://patents.google.com/patent/US2695311A/en
