Acide sulfamique : propriétés, réactions, production et utilisations
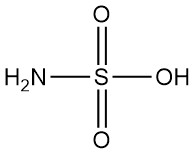
Qu’est-ce que l’acide sulfamique ?
L’acide sulfamique, également connu sous le nom d’acide amidosulfurique, est un acide inorganique fort dont la formule chimique est H3NSO3. Il s’agit d’un solide blanc, inodore, cristallin et non hygroscopique qui est fortement dissocié dans l’eau.
L’acide sulfamique est fabriqué industriellement depuis environ un demi-siècle. Entre 1950 et 1980, des installations de production ont été créées dans plusieurs pays industrialisés en prévision d’une demande accrue du marché.
Cependant, les baisses ultérieures de la demande de produits, ainsi que les défis de production et les difficultés liées à l’élimination des sous-produits, ont conduit à la fermeture de toutes les usines de fabrication en Europe et aux États-Unis. La production se poursuit au Japon (Nissan) et à Taiwan (plusieurs constructeurs).
Table des matières
1. Propriétés physiques de l’acide sulfamique
L’acide sulfamique est un solide blanc, cristallin et non volatil à température ambiante. Il forme une solution aqueuse acide forte avec un pH de 1,18 pour seulement 1 % de solution. La solubilité de l’acide sulfamique dans l’eau est augmentée par l’ajout d’autres acides ou sels et présente une solubilité limitée dans les acides inorganiques concentrés et la plupart des solvants organiques.
La solubilité dans l’eau dépend de la température, comme indiqué dans le tableau 1.
| Température (°C) | Solubilité (g/100 g) | Concentration (% en poids) |
|---|---|---|
| 0 | 14,7 | 12,8 |
| 10 | 18,5 | 15,6 |
| 20 | 21,3 | 17,5 |
| 30 | 26,1 | 20,7 |
| 40 | 29,5 | 22,8 |
| 50 | 32,8 | 24,7 |
| 60 | 37,1 | 27,0 |
| 70 | 41,9 | 29,5 |
| 80 | 47,0 | 32,0 |
Les propriétés physiques importantes de l’acide sulfamique sont présentées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [5329-14-6] |
| Formule chimique | H3NSO3 |
| Poids moléculaire | 97,1 g/mol |
| Point de fusion | 205 °C |
| Constante de dissociation | 1,10 x 10-1 |
| Densité à 25 °C | 2,126 g/cm3 |
| Chaleur spécifique | 1,1467 J/g |
| Pression de vapeur à 20 °C | 0,8 Pa |
| Pression de vapeur à 100 °C | 0,25 Pa |
2. Réactions chimiques de l’acide sulfamique
En chauffant l’acide sulfamique au-dessus de 209 °C, il se décompose en trioxyde de soufre, dioxyde de soufre, eau, ammoniac et azote.
Les solutions aqueuses d’acide sulfamique s’hydrolysent pour former de l’hydrogénosulfate d’ammonium :
NH2SO3H + H2O → NH4HSO4
Le taux d’hydrolyse dépend de la concentration, du pH et de la température. Les solutions aqueuses diluées sont stables à température ambiante. Une solution à 10 % d’acide sulfamique est hydrolysée à 50 % à une température de 80 °C pendant 10 heures.
L’acide sulfamique peut être oxydé en présence de chlore, de brome et de chlorates pour produire de l’acide sulfurique.
2 NH2SO3H + KClO3 → 2 H2SO4 + N2 + KCl + H2O
En chauffant de l’acide nitrique concentré avec de l’acide sulfamique, on obtient de l’oxyde de diazote.
NH2SO3H + HNO3 → H2SO4 + N2O + H2O
L’acide nitreux réagit complètement avec l’acide sulfamique pour produire de l’azote et de l’acide sulfurique, cette réaction peut donc être utilisée pour une analyse quantitative.
NH2SO3H + HNO2 → H2SO4 + H2O + N2
La réaction avec le chlorure de thionyle entraîne la formation de chlorure de sulfamyle :
NH2SO3H + SOCl2 → ClSO2NH2 + SO2 + HCl
L’acide sulfamique dissout les hydroxydes, les oxydes et les carbonates métalliques.
Les alcools primaires et secondaires réagissent avec l’acide sulfamique pour former des sulfates d’alkylammonium.
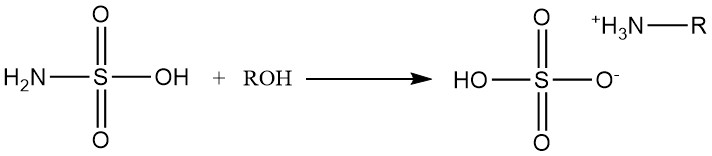
Les réactions des alcools secondaires nécessitent la présence de catalyseurs aminés, et les alcools tertiaires ne réagissent pas avec l’acide sulfamique.
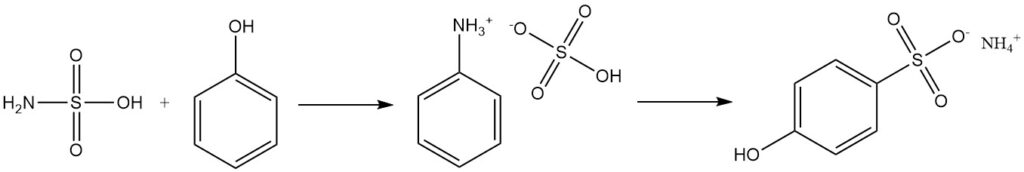
Les alcools aromatiques comme le phénol réagissent avec l’acide sulfamique pour produire des sulfonates, avec le sulfate de phénylammonium comme intermédiaire.
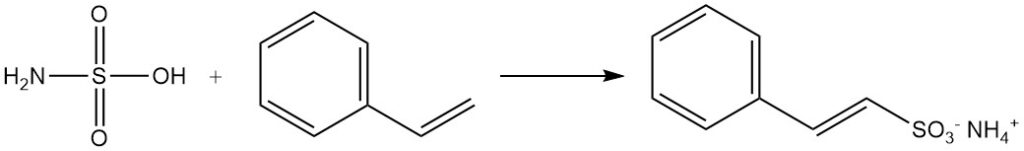
Les aldéhydes forment des produits d’addition avec les sels d’acide sulfamique. Les composés aromatiques à chaînes latérales insaturées, comme le styrène, subissent une sulfonation par l’acide sulfamique tout en préservant la double liaison de la chaîne latérale.
3. Production d’acide sulfamique
La production d’acide sulfamique utilise exclusivement le procédé à l’urée, les usines utilisant de l’ammoniac et du trioxyde de soufre ayant cessé leurs activités.
L’acide sulfamique est produit directement par réaction de quantités équimolaires d’urée, de trioxyde de soufre et d’acide sulfurique.
NH2CONH2 + SO3 + H2SO4 → 2 NH2SO3H + CO2
Cette réaction est fortement exothermique et implique un processus en deux étapes, selon les réactions suivantes :
NH2CONH2 + SO3 → NH2CONHSO3H
NH2CONHSO3H + H2SO4 → 2 NH2SO3H + CO2
Dans la première étape, l’urée est agitée avec un excès d’acide sulfurique et de trioxyde de soufre. La température est maintenue en dessous de 40 °C pour inhiber la formation de dioxyde de carbone. La deuxième étape consiste à faire réagir le produit de la première étape en présence d’un excès de trioxyde de soufre à une température comprise entre 50 et 80 °C pour produire de l’acide sulfamique et du dioxyde de carbone.
Après élimination de l’excès de trioxyde de soufre, on obtient de l’acide sulfamique d’une pureté supérieure à 95 %, et un produit de haute pureté est obtenu par recristallisation.
Selon un brevet de Nissan, l’acide sulfamique est produit en faisant réagir de l’urée avec de l’oléum (xH2SO4 · ySO3).
Le produit de réaction est recristallisé par voie humide, suivi d’une séparation et d’un séchage de l’acide cristallisé. Le broyage à haute pression avec une pression comprise entre 600 et 1500 kg/m2 donne un produit cristallin fin avec un diamètre moyen des particules ≤ 500 μm.
4. Utilisations de l’acide sulfamique
L’acide sulfamique est principalement utilisé pour synthétiser le cyclamate (1) qui est un édulcorant artificiel.
L’acide sulfamique est également utilisé dans les produits de nettoyage pour éliminer les dépôts de carbonate et de phosphate, tels que le tartre des chaudières, en raison de sa capacité à former des sels solubles et de sa corrosivité relativement faible envers les métaux.
Il est utilisé dans le nettoyage des machines et des instruments dans des industries telles que le papier, le sucre, les produits laitiers et la brasserie, ainsi que pour éliminer les dépôts dans les usines d’évaporation, les échangeurs de chaleur et les systèmes de refroidissement.
Certains pays utilisent l’acide sulfamique pour traiter les alcools gras ou éthoxylés dans un processus à l’échelle industrielle pour produire des précurseurs de cire.
L’acide sulfamique est également utilisé comme stabilisateur de chlore, dans la production de colorants, dans les processus de galvanoplastie et dans les industries du papier et du textile.
Dans les laboratoires, il est utilisé en chimie analytique.
5. Toxicologie de l’acide sulfamique
L’acide sulfamique est généralement considéré comme ayant une faible toxicité. Ses propriétés physiologiques sont caractéristiques d’un acide minéral fort.
La poussière d’acide sulfamique peut irriter les muqueuses du nez et du pharynx, ainsi que la conjonctive des yeux. Il s’agit d’un effet courant de nombreux acides forts.
L’administration orale de 1,6 g/kg d’acide sulfamique à des rats s’est avérée mortelle. Cela indique un certain niveau de toxicité, mais il est essentiel de considérer qu’il s’agit d’une dose relativement élevée et que l’étude a été menée sur des rats. La toxicité humaine peut différer.
L’acide sulfamique, comme d’autres acides forts, est corrosif pour la peau, les yeux et les voies respiratoires. Le contact direct doit être évité.
Des procédures de manipulation appropriées, notamment l’utilisation d’équipements de protection individuelle (EPI) tels que des gants, des lunettes de protection et une protection respiratoire, sont essentielles lors de la manipulation de l’acide sulfamique.
Référence
- Sulfamic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a25_439
