Acide nitrilotriacétique : propriétés, production, utilisations et toxicologie
Qu’est-ce que l’acide nitrilotriacétique ?
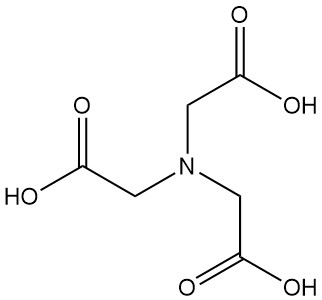
L’acide nitrilotriacétique, également connu sous le nom de NTA ou N,N-bis(carboxyméthyl)glycine, est un acide tricarboxylique de formule C6H9NO6. Il s’agit d’un solide incolore qui appartient à la famille des acides aminopolycarboxyliques et qui est l’un des agents chélatants les plus importants, avec l’EDTA.
Il a été synthétisé pour la première fois en 1861 par Heintz en faisant réagir de l’ammoniac avec de l’acide chloroacétique. La production industrielle à grande échelle a commencé à Ludwigshafen en 1936. Depuis lors, l’acide nitrilotriacétique s’est imposé comme agent chélateur utilisé dans divers procédés industriels.
Table des matières
1. Propriétés physiques de l’acide nitrilotriacétique
L’acide nitrilotriacétique est un triacide qui forme des cristaux incolores en forme d’aiguilles lorsqu’il est cristallisé à partir d’une solution aqueuse. Il est insoluble dans l’eau et dans la plupart des solvants organiques. Cependant, les nitrilotriacétates de métaux alcalins ont une solubilité élevée dans l’eau. Par exemple, le nitrilotriacétate trisodique se dissout jusqu’à 640 g/L dans l’eau.
Les propriétés physiques les plus importantes de l’acide nitrilotriacétique sont présentées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [139-13-9] |
| Formule chimique | C6H9NO6 |
| Masse moléculaire | 191,14 g/mol |
| Point de fusion | 242 °C (décomposition) |
| Solubilité dans l'eau | 0,13 g/100 g à 5 °C 0,13 g/100 g à 22,5 °C 0,95 g/100 g à 80 °C 3,3 g/100 g à 100 °C |
| pH de la solution saturée | 2,3 |
| pK1 à 25 °C | 1,80 |
| pK2 à 25 °C | 2,48 |
| pK3 à 25 °C | 9,65 |
2. Propriétés chimiques de l’acide nitrilotriacétique
L’acide nitrilotriacétique (NTA) est principalement caractérisé par la formation de chélates hydrosolubles avec des cations métalliques multivalents. Les groupes carboxyle et l’azote tertiaire agissent tous deux comme sites ligands. Les positions de coordination des ions métalliques inoccupées peuvent être occupées par des molécules d’eau.
Alors que la géométrie octaédrique (numéro de coordination 6) représente souvent des chélates métal-NTA, des études structurelles récentes par diffraction des rayons X indiquent le potentiel de nombres de coordination plus élevés dans certains complexes métalliques. Par exemple, le Ca2+ dans le complexe CaNTA– affiche un nombre de coordination de 7.
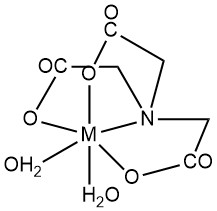
En général, les complexes métalliques se forment dans un rapport molaire métal/NTA de 1:1, et un excès de NTA peut conduire à des complexes de 1:2. Les constantes de stabilité (K1 pour 1:1, K2 pour 1:2) quantifient la stabilité du complexe. La polarisation de la liaison H-O dans le chélate donne une propriété d’acide faible aux complexes 1:1, caractérisée par la constante de dissociation Kd.
K1 = [MNTA]/[M][NTA]
K2 = [MNTA2]/[M][NTA]2
Kd = [MNTAOH][H+]/[MNTA]
Où M est l’ion métallique multivalent, NTA représente l’anion N(CH2COO–)3.
Le tableau 2 répertorie certaines des constantes de stabilité des chélates NTA.
| Ion métallique | log K1 | log K2 | pKd |
|---|---|---|---|
| Al3+ | 11,4 | - | 5,09 |
| Ca2+ | 6,39 | 8,76 | - |
| Cd2+ | 9,78 | 14,39 | 11,25 |
| Co2+ | 10,38 | 14,33 | 10,80 |
| Cu2+ | 12,94 | 17,42 | 9,14 |
| Fe2+ | 8,33 | 12,80 | 10,60 |
| Fe3+ | 15,90 | 24,30 | 4,1-7,8 |
| Hg2+ | 14,60 | - | - |
| Mg2+ | 5,47 | - | - |
| Mn2+ | 7,46 | 10,94 | - |
| Ni2+ | 11,50 | 16,32 | 10,86 |
| Pb2+ | 11,34 | - | - |
| Zn2+ | 10,66 | 14.24 | 10.06 |
La complexation de l’acide nitrilotriacétique et du métal entre en compétition avec d’autres réactions. Les cations métalliques peuvent former des précipités peu solubles avec des anions tels que le carbonate, le sulfure, le sulfate ou l’oxalate. De plus, les ions hydrogène entrent en compétition avec les cations métalliques pour les sites de liaison des trianions nitrilotriacétiques. Par conséquent, de multiples équilibres contrôlent les systèmes d’acide nitrilotriacétique.
Les chélates de nitrilotriacétate sont stables dans une large gamme de pH qui dépend de la concentration en chélate et de l’excès d’agent complexant ; par exemple, Ca2+ (pH 9–12), Mg2+ (pH 7–10), Cu2+ (pH 3–12) et Fe2+ (pH 1,5–3).
3. Production d’acide nitrilotriacétique
La production historique d’acide nitrilotriacétique à partir d’ammoniac et d’acide chloroacétique n’est plus utilisée. L’oxydation de la triéthanolamine n’a pas d’importance industrielle.
Aujourd’hui, l’acide nitrilotriacétique est produit par des procédés alcalins en une étape ou par des procédés de cyanométhylation acide en deux étapes utilisant de l’ammoniac (ou du sulfate d’ammonium), du formaldéhyde et du cyanure de sodium (ou du cyanure d’hydrogène).
3.1. Le procédé alcalin
Le procédé alcalin est un procédé établi de longue date dans lequel le nitrilotriacétate trisodique est produit par la réaction de l’ammoniac, du formaldéhyde et du cyanure de sodium. L’hydrolyse du nitrilotriacétate donne le sel de nitrilotriacétate.
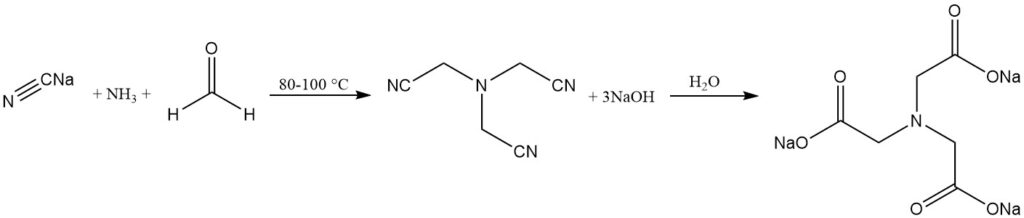
NH3 + 3 HCHO + 3 NaCN → N(CH2CN)3 + 3 NaOH
N(CH2CN)3 + 3 NaOH + 3 H2O → N(CH2COONa)3 + 3 NH3
Ce procédé peut être réalisé par lots ou en continu et se déroule à 80–100 °C. À un pH élevé (environ 14), la triscyanométhylamine est hydrolysée in situ en nitrilotriacétate trisodique.
Dans un procédé industriel continu, la solution aqueuse de cyanure de sodium est introduite dans un système de réacteur en cascade avec une solution de formaldéhyde. Cette méthode génère un excès d’ammoniac trois fois supérieur, qui doit être limité pour éviter la production de sous-produits à faible degré de carboxyméthylation, tels que la glycine et l’acide iminodiacétique.
L’élimination de l’excès d’ammoniac au cours du procédé est réalisée en distillant en continu l’ammoniac avec de la vapeur ou de l’air tout au long du procédé ; cependant, la formation de petites quantités de produits indésirables comme l’acide glycolique et d’autres mentionnés précédemment est inévitable.
La solution finale est vendue sous forme de solution à 40 %, transformée en poudre ou acidifiée pour former de l’acide nitrilotriacétique.
3.2. Le procédé acide
Pour limiter la formation de sous-produits dans le procédé alcalin, certains producteurs ont construit des usines basées sur le procédé acide ; cependant, cette méthode exige des protocoles de sécurité stricts en raison de l’utilisation de cyanure d’hydrogène, et il y a aussi le problème de la corrosion.
Tout d’abord, l’ammoniac et le formaldéhyde produisent initialement de l’hexaméthylènetétramine, qui réagit ensuite avec le cyanure d’hydrogène dans l’acide sulfurique pour former la triscyanométhylamine.
La triscyanométhylamine solide est insoluble dans le milieu réactionnel, elle est donc filtrée, lavée, puis saponifiée avec de l’hydroxyde de sodium pour produire une solution de nitrilotriacétate trisodique avec un minimum de sous-produits.
Cette solution est également vendue sous forme de produit à 40 % ou utilisée dans la production d’acide nitrilotriacétique en poudre ou solide.
L’acide nitrilotriacétique commercial est vendu sous différents noms commerciaux, notamment les grades Dissolvine A (Akzo), Masquol NTA (Protex), Rexene NTA (Akzo), Trilon A (BASF) et Versene NTA (Dow).
4. Utilisations de l’acide nitrilotriacétique
L’utilisation principale de l’acide nitrilotriacétique et de ses sels repose sur leur capacité à former des complexes avec des ions métalliques. Ces propriétés de complexation sont utilisées dans divers domaines pour séquestrer les ions métalliques interférents, dissoudre les précipités, moduler les potentiels redox des ions métalliques ou créer des tampons d’ions métalliques.
4.1. Utilisations de l’acide nitrilotriacétique dans l’adoucissement de l’eau
L’acide nitrilotriacétique adoucit efficacement l’eau en complexant les ions calcium (Ca2+) et magnésium (Mg2+) dans une plage de pH neutre à alcaline. La quantité d’acide nitrilotriacétique ou de nitrilotriacétate trisodique requise pour l’adoucissement de l’eau varie en fonction de la dureté de l’eau.
Les industries telles que le papier, les textiles, le savon, les cosmétiques, les détergents, le traitement de l’eau d’alimentation des chaudières et le traitement chimique (par exemple, la photographie, la galvanoplastie) utilisent l’acide nitrilotriacétique pour l’adoucissement de l’eau.
4.2. Utilisations de l’acide nitrilotriacétique comme substitut du phosphate dans les détergents
Le nitrilotriacétate trisodique est utilisé comme substitut du triphosphate pentasodique dans les détergents à faible teneur en phosphate ou sans phosphate, souvent en association avec des zéolites ou des polycarboxylates.
Contrairement au triphosphate pentasodique, le nitrilotriacétate trisodique résiste à l’hydrolyse et reste pleinement efficace après séchage par atomisation et pendant le lavage. Bien que le rapport d’équivalence du nitrilotriacétate trisodique au triphosphate pentasodique soit d’environ 0,6 pour 1, il ne compromet pas la détergence primaire ou secondaire.
4.3. Utilisations de l’acide nitrilotriacétique comme substitut du diphosphate tétrapotassique dans les nettoyants
Le nitrilotriacétate trisodique remplace le diphosphate tétrapotassique dans les nettoyants à un rapport d’équivalence favorable de 1:3, éliminant souvent le besoin d’hydrotropes ou de solubilisants. Des effets synergétiques se produisent avec une substitution partielle du phosphate.
4.4. Utilisations de l’acide nitrilotriacétique dans le masquage des ions de métaux lourds
Bien que moins efficace que l’EDTA, l’acide nitrilotriacétique est utilisé pour masquer les ions de métaux lourds comme Fe3+, Cu2+ et Mn2+. Des industries telles que la fabrication de savon, le blanchiment des textiles, le nettoyage de surface et divers processus chimiques l’utilisent à cette fin.
4.5. Applications spécialisées
L’acide nitrilotriacétique est également utilisé dans des applications spécialisées comme la séparation des éléments des terres rares, les titrages complexométriques et la formulation de micronutriments agricoles.
5. Toxicologie de l’acide nitrilotriacétique
L’acide nitrilotriacétique est hautement biodégradable et se minéralise facilement en produits finaux inorganiques sans métabolites organiques persistants.
Des études environnementales, notamment suite à l’introduction de détergents contenant de l’acide nitrilotriacétique, confirment sa biodégradation rapide dans les stations d’épuration des eaux usées (> 98 %) et les eaux de surface (demi-vie < 1 jour). Des traces minimes d’acide nitrilotriacétique sont détectables dans les eaux souterraines après une infiltration limitée.
Bien que la capacité complexante de l’acide nitrilotriacétique puisse potentiellement mobiliser les métaux lourds, sa biodégradation rapide minimise ce risque. Des études sur les stations d’épuration des eaux usées et les sédiments fluviaux indiquent une remobilisation négligeable des métaux lourds dans des conditions réalistes.
L’acide nitrilotriacétique présente une faible toxicité aiguë pour les organismes aquatiques, avec des valeurs de CL50 allant d’environ 100 à plus de 10 000 mg/L, influencées par la dureté de l’eau. Les études de toxicité chronique sur divers organismes ne révèlent aucun effet nocif en dessous de 1 mg/L, avec des seuils de toxicité significatifs à des concentrations beaucoup plus élevées.
La toxicité aiguë chez les mammifères varie selon les espèces. La valeur orale DL50 du nitrilotriacétate trisodique chez les rongeurs est d’environ 2000 mg/kg ; cette dose provoque des vomissements chez les chiens et les singes.
Les études d’inhalation et les tests d’irritation de la peau/des yeux/des voies respiratoires montrent des effets minimes, sans indication de sensibilisation ou d’allergie. L’acide nitrilotriacétique n’a pas d’effets tératogènes, seul ou en association avec des métaux lourds comme le cadmium et le mercure. De plus, les tests de mutagénicité donnent des résultats négatifs.
Les mammifères ne métabolisent pas l’acide nitrilotriacétique ; au lieu de cela, les reins l’excrètent inchangé. Les cellules des tubules rénaux et de l’uretère accumulent des concentrations plus élevées d’acide nitrilotriacétique.
Les études subchroniques et chroniques lient l’acide nitrilotriacétique à la toxicité rénale en raison de perturbations du métabolisme des électrolytes et du fer. Des doses élevées peuvent endommager les cellules épithéliales des reins, de l’uretère et de la vessie, ce qui peut conduire à la formation de tumeurs.
Cependant, un seuil significatif existe en dessous du développement tumoral, dépassant de loin la dose sans effet nocif (NOEL) de 14 mg/kg de poids corporel par jour.
Référence
- Acide nitrilotriacétique ; Encyclopédie de chimie industrielle d’Ullmann. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_377.pub3
