Acide malique : propriétés, production et utilisations
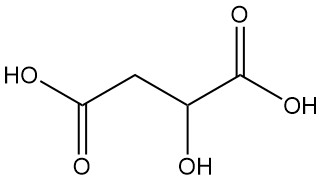
Qu’est-ce que l’acide malique ?
L’acide malique, également connu sous le nom d’acide hydroxysuccinique ou acide hydroxybutanedioïque, est un acide dicarboxylique dont la formule chimique est C4H6O5. Il s’agit d’un composé organique naturel caractérisé par un goût acidulé.
Il a été décrit pour la première fois par Sheele qui, en 1785, a isolé cet acide à partir de pommes vertes. Le nom malique vient du latin malum, qui signifie pomme.
L’acide malique est un constituant de divers fruits, notamment des pommes. Dans les systèmes biologiques, l’acide malique, sous sa forme ionisée, le malate, sert d’intermédiaire dans le cycle de l’acide tricarboxylique. Cette voie métabolique est cruciale pour la production d’énergie.
L’isomère L de l’acide malique est la forme prédominante trouvée dans la nature et possède une activité biologique. Bien qu’il soit principalement connu pour son rôle dans l’aromatisation des aliments, de nouvelles preuves suggèrent des avantages potentiels pour la santé humaine.
L’acide malique est impliqué dans le métabolisme énergétique, en particulier dans les conditions d’hypoxie. Des études indiquent son potentiel à améliorer les performances physiques et à soulager les symptômes associés à la fibromyalgie.
Le métabolisme de l’acide malique est influencé par des enzymes telles que l’enzyme malique. Cette enzyme catalyse la décarboxylation oxydative du malate en pyruvate. Le pyruvate généré peut subir d’autres transformations métaboliques, notamment la conversion en glucose ou en oxaloacétate.
L’acide malique présente des propriétés antimicrobiennes. Sa nature acide contribue à la conservation des aliments en inhibant la croissance microbienne. Cependant, son efficacité est influencée par des facteurs tels que le pH et les espèces microbiennes spécifiques.
Table des matières
1. Propriétés physiques de l’acide malique
L’acide malique est une poudre cristalline blanche, inodore et au goût acide. Il est très soluble dans l’eau, le méthanol, l’éthanol, l’acétone, l’éther et d’autres solvants polaires.
Certaines propriétés physiques de l’acide malique sont résumées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [617-48-1] |
| Formule chimique | C4H6O5 |
| Masse moléculaire | 134,09 g/mol |
| Point de fusion | 131 °C |
| Densité | 1,60 g/cm3 |
| Viscosité d'une solution aqueuse à 50 % à 25 °C | 6,5 mPa.s |
| Chaleur de combustion à 20 °C | -1,340 MJ/mol |
| pKa1 à 20 °C | 3,51 |
| pKa2 à 20 °C | 5,03 |
| Propriété | Valeur |
|---|---|
| Numéro CAS | [97-67-6] |
| Point de fusion | 100 °C |
| Densité à 20 °C | 1,595 g/cm3 |
| Rotation spécifique à 18 °C (7 % en poids dans H2O) | -2,3° |
| Solubilité dans l'eau à 20 °C | 36,4 g/100 g |
2. Réactions chimiques de l’acide malique
En raison de la présence d’acide carboxylique et de groupes fonctionnels hydroxyles dans l’acide malique, celui-ci est capable de subir diverses réactions chimiques.
En tant qu’acide carboxylique, l’acide malique réagit avec les bases pour former des sels, tels que le malate de sodium ou le malate de potassium.
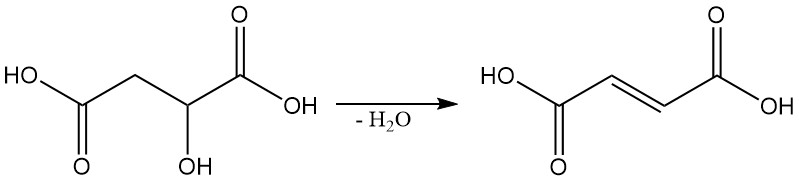
Dans des conditions spécifiques, l’acide malique peut être déshydraté pour produire de l’acide fumarique.
La décarboxylation de l’acide malique produit de l’acide pyruvique.
L’acide malique peut réagir avec des alcools pour former des esters, qui sont souvent utilisés comme agents aromatisants.
L’acide malique peut être oxydé pour produire divers produits, tels que l’acide oxaloacétique, l’acide oxalique et le dioxyde de carbone, selon les conditions.
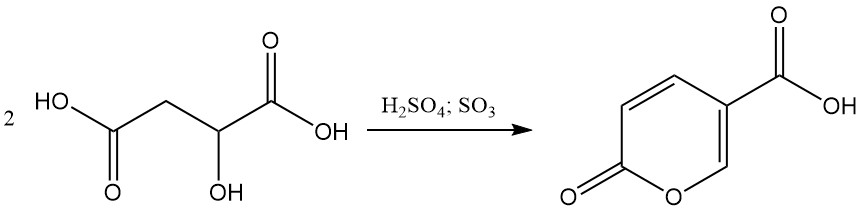
En présence de 20 à 30 % d’acide sulfurique fumant, l’acide malique subit une autocondensation pour former de l’acide coumalique.
L’acide malique peut former des complexes avec des ions métalliques tels que le calcium et le magnésium.
La fermentation malolactique est un processus courant dans la vinification où l’acide malique est converti en acide lactique par des bactéries. C’est également un intermédiaire dans le cycle de Krebs, dans lequel il subit une oxydation en acide oxaloacétique.
3. Production d’acide malique
3.1. Production chimique d’acide malique
La synthèse de l’acide malique repose principalement sur des processus chimiques, donnant de l’acide D,L-malique racémique. Le précurseur, l’anhydride maléique, est dérivé d’hydrocarbures fossiles, principalement du n-butane. Le benzène, une ancienne matière première, reste utilisé, notamment dans les pays asiatiques.
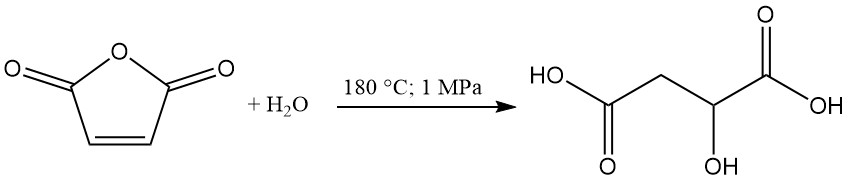
L’acide (R,S)-malique est produit industriellement aux États-Unis et au Canada par hydratation de l’anhydride maléique. Alberta Gas est le seul fabricant américain avec une capacité de production d’environ 5 000 tonnes métriques par an.
Dans ce procédé, l’anhydride maléique est chauffé à 180 °C sous une pression de 1 MPa pour former l’acide malique comme produit principal. L’acide maléique et l’acide fumarique sont générés comme sous-produits. L’acide fumarique, en raison de sa faible solubilité dans l’eau, est séparable par filtration et recyclé.
La concentration ultérieure du filtrat donne de l’acide malique. L’acide brut est purifié par lavages répétés, évaporation et recristallisation pour réduire les impuretés d’acide fumarique et d’acide maléique à 7,5 et <500 ppm, respectivement.
Pour obtenir de l’acide malique de qualité pharmaceutique, des étapes de purification supplémentaires sont nécessaires.
3.2. Production enzymatique d’acide L-malique
L’acide L-malique énantiopur, qui est préféré pour les produits pharmaceutiques et les polymères, est difficile à obtenir par résolution d’acide D,L-malique racémique. La synthèse enzymatique offre une alternative sélective et plus douce.
L’hydratation catalysée par la fumarase de l’acide fumarique en acide L-malique est le principal processus enzymatique. Cela peut être réalisé en utilisant des enzymes purifiées, des cellules perméabilisées ou lyophilisées, ou des cellules entières.
Les micro-organismes tels que Saccharomyces cerevisiae, Brevibacterium flavus, Brevibacterium ammoniagenes et Rhizopus oryzae présentent des taux de conversion élevés, compris entre 80 % et ≈100 % dans la catalyse à cellules entières. L’immobilisation rend le processus plus économique en permettant la réutilisation du catalyseur.
3.3. Biosynthèse de l’acide malique par les micro-organismes
La production microbienne d’acide malique offre des avantages par rapport à la synthèse chimique, notamment la formation exclusive d’acide L-malique et l’utilisation de substrats divers et renouvelables.
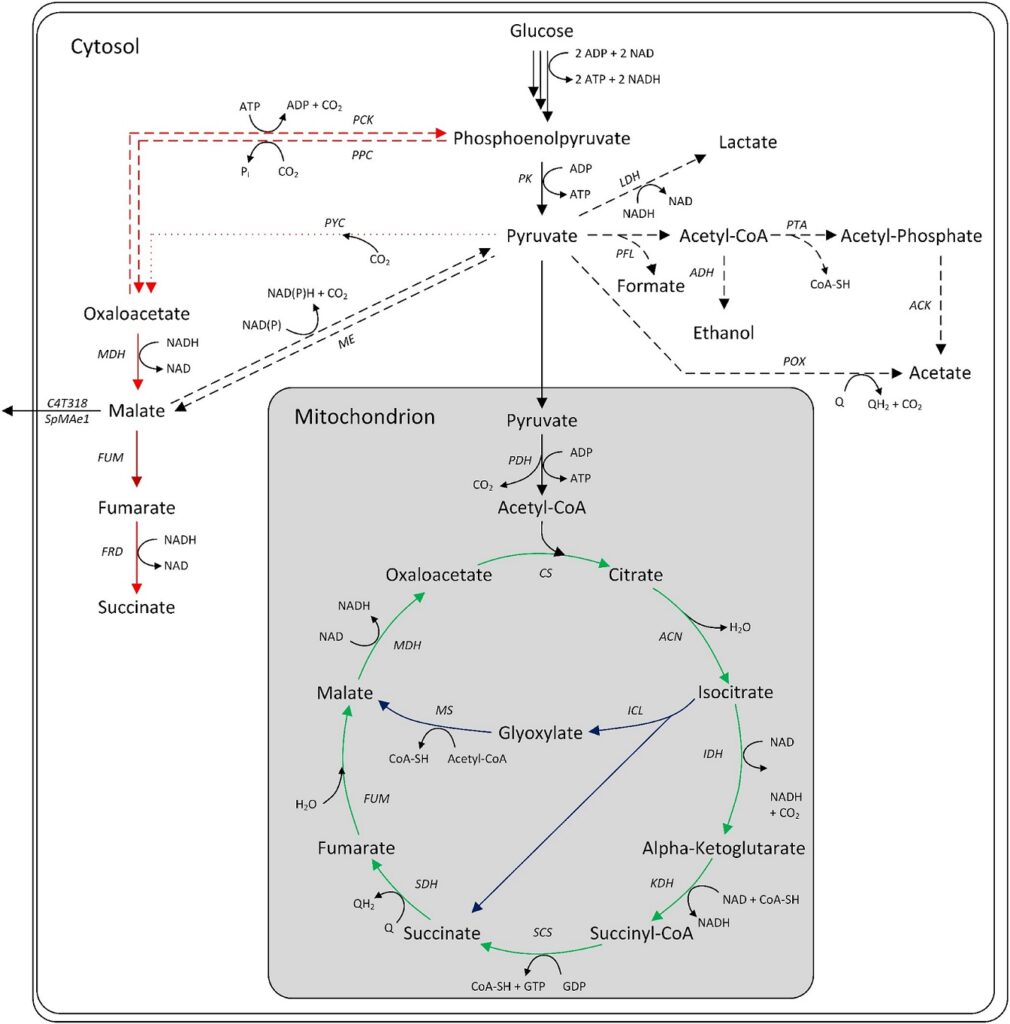
Il existe trois voies intracellulaires principales pour la production d’acide malique microbien : le cycle oxydatif de l’acide tricarboxylique (TCA), le cycle réductif du TCA (rTCA) et le cycle du glyoxylate. Le TCA oxydatif, situé dans la mitochondrie, convertit l’acétyl-CoA en citrate, qui est ensuite oxydé en L-malate avec perte de dioxyde de carbone.
Le rendement théorique maximal est de 1 mol/mol. Certaines espèces d’Aspergillus possèdent des isoformes de TCA cytosoliques, ce qui permet une voie de TCA réductrice. Cette voie neutre en ATP carboxyle le pyruvate en oxaloacétate, qui est converti en L-malate par la malate déshydrogénase. Un rendement théorique de 2 mol/mol de glucose est possible.
Le cycle du glyoxylate convertit le citrate en succinate et en glyoxylate, avec condensation ultérieure en L-malate. Le rendement maximal est de 1 mol/mol, qui peut augmenter jusqu’à 1,33 mol/mol si l’oxaloacétate consommé est reconstitué par la carboxylation du pyruvate.
Les micro-organismes utilisés dans la production d’acide L-malique comprennent des micro-organismes naturels (tels que Aspergillus flavus, Aspergillus oryzae, Ustilago trichophora et Rhizopus delemar) et des champignons et bactéries génétiquement modifiés.
4. Utilisations de l’acide malique
L’acide (R,S)-malique partage des propriétés physicochimiques avec l’acide citrique et l’acide tartrique, mais possède un profil de goût plus doux. Cette caractéristique favorise son application dans les produits alimentaires où l’acidité de l’acide citrique est indésirable. Les exemples incluent l’emballage alimentaire et la pâtisserie.
Dans l’industrie alimentaire, l’acide malique est largement utilisé (environ 85 à 90 %) comme acidulant et régulateur d’acidité. Sa saveur diffère de celle de l’acide citrique, offrant une acidité moins intense mais plus durable. Cette propriété permet de masquer l’arrière-goût des édulcorants artificiels et de créer des profils de saveur équilibrés dans les boissons.
Les interactions synergétiques entre l’acide malique et les édulcorants permettent une réduction des édulcorants jusqu’à 20 % et des économies potentielles. L’utilisation de poudre d’acide malique anhydre offre des avantages économiques supplémentaires.
Les principales applications comprennent la confiserie, les confitures, les gelées et les fruits et légumes en conserve. Les réglementations sur les additifs alimentaires dans la plupart des pays autorisent son utilisation.
Les acides maliques énantiomères, (R)-(+)-acide malique et (S)-(-)-acide malique, peuvent être obtenus par résolution de l’acide (R,S)-malique ou par fermentation microbienne de l’acide fumarique.
Au-delà de l’industrie alimentaire, l’acide malique est utilisé comme tampon et agent chélateur dans les produits de soins personnels et de nettoyage. Les applications pharmaceutiques incluent son utilisation comme composant de médicament, tandis que la fabrication de semi-conducteurs l’utilise dans les processus de polissage et de nettoyage.
De plus, l’acide malique est utilisé dans l’alimentation animale et comme composant dans les mélanges à basse température de transition.
L’acide malique est un acide dicarboxylique, ce qui permet son utilisation comme élément constitutif de polymère. Les copolymères et homopolymères d’acide malique présentent des propriétés telles que l’hydrophilie, la biocompatibilité et la biodégradabilité, trouvant des applications potentielles dans des domaines tels que l’administration de médicaments et la science des matériaux.
Les principaux fabricants d’acide malique sont Bartek (Canada), les sociétés japonaises Fuso Chemical et Mitsubishi Corporation Life Sciences, Isegen (Afrique du Sud), Polynt (Italie), Thirumalai Chemicals (Inde), les sociétés chinoises Changmao Biochemical Engineering Company, Anhui Sealong Biotechnology et Jinhu Lile Biotechnology Industry, ainsi que Tate & Lyle (Royaume-Uni) et Yongsan Chemicals (Corée).
5. Toxicologie de l’acide malique
L’acide malique présente une faible toxicité aiguë dans les tests sur les animaux. Les valeurs de DL50 orales varient de 1,6 à 5 g/kg selon les espèces. Les valeurs de DL50 intraveineuses et intrapéritonéales sont nettement inférieures.
Les études orales chroniques sur les rats et les chiens ont révélé des effets indésirables minimes, notamment des modifications mineures du poids corporel et de la consommation d’aliments. Les études de toxicité pour la reproduction ont donné des résultats négatifs.
Les études dermatologiques indiquent une irritation cutanée modérée chez les lapins et une irritation oculaire sévère chez les lapins. L’acide malique est un irritant puissant pour la peau du cobaye.
Les évaluations de mutagénicité ont donné des résultats incohérents. L’acide malique lui-même n’était pas mutagène dans divers tests, mais ses pyrolysats et ses dérivés chlorés ont montré des propriétés mutagènes.
Les études d’irritation cutanée ont rapporté des effets dose-dépendants, un pH plus élevé étant corrélé à une irritation accrue. Des tests prédictifs chez des patients atteints de dermatite atopique ont indiqué une réactivité cutanée potentielle aux régimes riches en acide malique. L’acide malique a également influencé les taux de renouvellement cellulaire en fonction des valeurs de pH.
Les essais cliniques d’efficacité et de sécurité n’ont rapporté aucune toxicité.
Les études de toxicité chronique sur l’acide malique chez le rat et le chien ont établi des niveaux sans effet observé (NOEL) de 5000 ppm et 50000 ppm, respectivement.
Les données de toxicité chronique de l’acide fumarique chez le rat indiquent un niveau sans effet nocif observé (NOAEL) d’environ 600 mg/kg de poids corporel/jour. Étant donné la conversion métabolique de l’acide fumarique en acide malique dans le cycle de Krebs, l’extrapolation inter-espèces est considérée comme valide.
L’évaluation de l’exposition à l’acide malique à partir de la concentration alimentaire en mg/kg/jour a donné des résultats incertains. Les plages estimées variaient entre 2 et 200 mg/kg/jour et 25 et 2 500 mg/kg/jour. L’application des facteurs de conversion de l’EFSA a permis de remédier à cette incertitude, ce qui a donné lieu à une NOAEL de 260 mg/kg/jour.
Références
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- https://scijournals.onlinelibrary.wiley.com/doi/10.1002/jctb.6269
- https://pubmed.ncbi.nlm.nih.gov/11358110/
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse9535
- https://onlinelibrary.wiley.com/doi/10.1002/9780470995327.ch157
- https://echa.europa.eu/registration-dossier/-/registered-dossier/11511/7/6/1
- https://www.orgsyn.org/demo.aspx?prep=cv4p0201
