Acide éthylènediaminetétraacétique (EDTA) : propriétés, production et utilisations
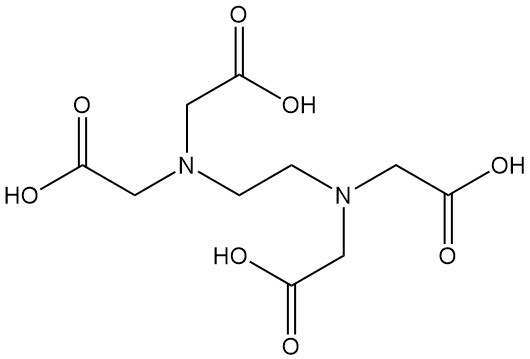
Qu’est-ce que l’acide éthylènediaminetétraacétique ?
L’acide éthylènediaminetétraacétique, plus connu sous le nom d’EDTA, est un acide aminopolycarboxylique de formule C10H16N2O8. Il s’agit d’un solide blanc insoluble dans l’eau et l’un des agents chélatants les plus couramment utilisés dans diverses industries.
L’acide éthylènediaminetétraacétique (EDTA), acide nitrilotriacétique (NTA) et leurs sels respectifs ont été synthétisés pour la première fois dans les années 1930 par Ferdinand Munz des laboratoires I.G. Farbenindustrie. Depuis lors, ils ont acquis une importance significative en tant qu’agents chélatants industriels.
Les acides aminopolycarboxyliques (tels que l’EDTA), similaires aux acides aminés, peuvent former des sels avec des acides et des bases forts. De plus, ils possèdent la capacité de former des complexes solides et solubles dans l’eau avec des cations divalents et trivalents. Ces complexes modifient considérablement la réactivité de l’ion métallique, ce qui en fait des composés précieux dans divers processus industriels.
La principale application industrielle de l’EDTA est de prévenir ou d’éliminer le tartre et les dépôts insolubles contenant du calcium, du baryum, du fer et d’autres cations.
Table des matières
1. Propriétés physiques de l’acide éthylènediaminetétraacétique (EDTA)
L’acide éthylènediaminetétraacétique est un solide cristallin incolore légèrement soluble dans l’eau. Les propriétés physiques importantes de l’EDTA sont répertoriées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [60-00-4] |
| Formule chimique | C10H16N2O8 |
| Poids moléculaire | 292,24 g/mol |
| Point de fusion | 245 °C (décomposition) |
| Densité relative | 0,86 g/cm3 |
| Solubilité dans l'eau à 20 °C | 0,1 g/L |
| pKa1 | 2 |
| pKa2 | 2,7 |
| pKa3 | 6,16 |
| pKa4 | 10,26 |
| Point d'éclair | > 100 °C |
2. Propriétés chimiques de l’acide éthylènediaminetétraacétique
L’EDTA forme des complexes hydrosolubles avec des cations métalliques divalents et trivalents. Ces complexes présentent une structure cyclique appelée chélate (du grec « chele », qui signifie griffe), où l’ion métallique est étroitement lié par le ligand dissocié EDTA4-.
La force de ce complexe est quantifiée par la constante de stabilité, qui reflète les concentrations d’équilibre de l’ion métallique (M) et de l’agent chélatant (EDTA4-).
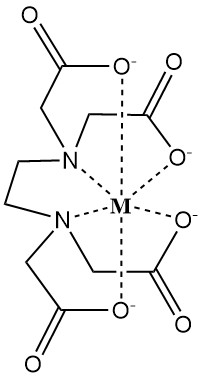
Les facteurs affectant la force de chélation sont le pH, les anions concurrents et les anions précipitants.
Un pH plus élevé favorise la chélation car il augmente la concentration d’anions chélatés entièrement dissociés (par exemple, EDTA4-), améliorant ainsi leur capacité de liaison. Cependant, cet effet peut être contrecarré par les ions hydroxyles (OH–) à pH élevé, qui peuvent perturber les chélates métalliques si le métal forme des hydroxydes insolubles (par exemple, précipitation de Fe3+ au-dessus de pH 5,5).
Les anions comme le carbonate, le phosphate et l’oxalate peuvent entrer en compétition avec l’agent chélatant, réduisant la force effective du complexe métal-agent chélatant.
En général, les agents chélatants comme l’EDTA forment des complexes 1:1 avec les ions métalliques. Cependant, l’augmentation de la concentration en agent chélatant au-delà de 1:1 peut encore améliorer la stabilité.
La conversion des cations métalliques en complexes métalliques anioniques modifie leur interaction avec d’autres espèces. Par exemple, le complexe [Fe(III)(EDTA)]– chargé négativement peut se déplacer plus facilement dans le sol que le cation Fe3+ absorbé.
La chélation diminue la concentration d’ions métalliques libres (M) par formation de complexe, augmentant ainsi efficacement le potentiel d’oxydation effectif. Ce principe est à la base de divers processus industriels importants.
3. Production d’acide éthylènediaminetétraacétique (EDTA)
L’acide éthylènediaminetétraacétique (EDTA) a été produit commercialement par la réaction de l’éthylènediamine, de l’acide chloroacétique et de l’hydroxyde de sodium. Ce procédé a donné lieu à un produit contaminé par du chlorure de sodium et a été abandonné en raison de problèmes de purification.
D’autres méthodes, comme l’oxydation catalytique de matières premières spécifiques, ont été explorées mais n’ont jamais été adoptées commercialement.
Aujourd’hui, deux procédés principaux dominent la production d’EDTA et d’agents chélatants associés, tous deux impliquant la cyanométhylation de la polyamine mère.
3.1. La cyanométhylation alcaline de l’éthylènediamine
La cyanométhylation alcaline de l’éthylènediamine est le procédé le plus largement utilisé pour synthétiser l’acide éthylènediaminetétraacétique.
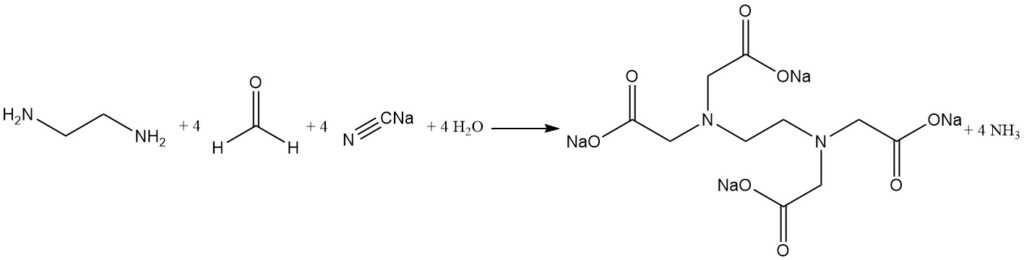
Le cyanure de sodium et le formaldéhyde réagissent avec l’éthylènediamine pour produire de l’EDTA avec des rendements élevés (plus de 90 %). L’ammoniac est le sous-produit principal et est continuellement éliminé pendant la réaction. Cependant, de petites quantités d’ammoniac réagissent pour former des sels de sous-produits indésirables comme l’acide nitrilotriacétique et la glycine.
Des sels d’acide glycolique peuvent également être formés à partir de la réaction entre les matières de départ. Ces impuretés ont un impact minimal sur la plupart des applications d’agents chélatants.
3.2. La synthèse Singer en deux étapes
La synthèse Singer en deux étapes sépare l’étape de cyanométhylation de la réaction d’hydrolyse. Ici, le cyanure d’hydrogène et le formaldéhyde réagissent avec l’éthylènediamine pour former un produit intermédiaire à haut rendement (plus de 96 %), l'(éthylènedinitrilo)tétraacétonitrile.
Cet intermédiaire insoluble est isolé, lavé, puis hydrolysé avec de l’hydroxyde de sodium pour produire de l’EDTA tétrasodique pur avec de l’ammoniac comme sous-produit. La séparation de la réaction en deux étapes minimise la formation d’impuretés et produit un agent chélatant hautement purifié.
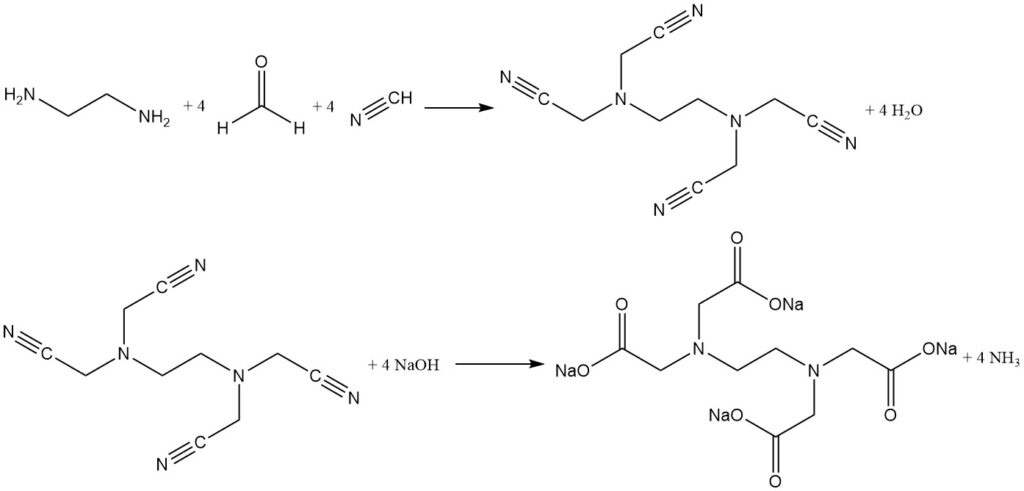
Cette approche en deux étapes est également utilisée pour la production efficace d’acide nitrilotriacétique pur à l’aide d’ammoniac.
4. Utilisations de l’acide éthylènediaminetétraacétique (EDTA)
Les agents chélatants comme l’EDTA, avec leur capacité unique à lier et à inactiver les ions métalliques, trouvent des applications dans diverses industries.
Les agents chélatants de type EDTA empêchent les changements de couleur indésirables des colorants en complexant les traces de contaminants métalliques provenant des fibres, des produits chimiques et de l’eau.
L’EDTA améliore la brillance de la pâte à papier blanchie au peroxyde d’hydrogène ou au dithionite. Il agit comme stabilisateur et agent de contrôle des ions métalliques pendant les étapes de réduction en pâte et de blanchiment.
L’EDTA est utilisé pour nettoyer les dépôts de tartre des chaudières et empêcher la formation de tartre de calcium et de magnésium en complexant ces ions métalliques. Cependant, un contrôle approprié du dosage est important pour éviter un excès d’agents chélatants entraînant la corrosion.
Les polymères sont parfois utilisés en conjonction avec des agents chélatants pour minimiser leur potentiel corrosif.
L’EDTA peut être utilisé pour aider à nettoyer les surfaces métalliques en dissolvant les films d’oxyde adhérents, ce qui permet un rinçage complet. Les solutions de placage métallique ajoutent souvent des agents chélateurs comme l’EDTA pour former des ions métalliques complexes, ce qui donne des revêtements métalliques plus lisses et plus uniformes.
Les détergents à lessive, les nettoyants pour surfaces dures et les nettoyants pour salle de bain ajoutent de l’EDTA, ce qui améliore leur pouvoir nettoyant.
L’EDTA perturbe la paroi cellulaire externe de certaines bactéries, en particulier les bactéries à Gram négatif, augmentant l’efficacité des agents assainissants. Il agit également comme un booster de conservation dans les cosmétiques, les shampooings et les produits ophtalmiques en augmentant leur activité bactéricide.
L’acide éthylènediaminetétraacétique empêche le rancissement oxydatif dans les émulsions grasses comme la mayonnaise et les vinaigrettes en complexant les ions métalliques qui peuvent accélérer la détérioration. De plus, il empêche la décoloration causée par le fer dans les aliments comme les pommes de terre.
La chélation avec l’EDTA est utilisée commercialement dans la polymérisation en émulsion du caoutchouc styrène-butadiène et le blanchiment des films photographiques. Les chélates de fer sont utilisés pour contrôler les émissions industrielles de sulfure d’hydrogène et comme absorbants réversibles pour les oxydes d’azote.
Les traces d’ions métalliques peuvent interférer avec les processus chimiques. Les agents chélatants comme l’EDTA éliminent ces métaux indésirables pour garantir l’efficacité du processus et répondre aux spécifications du produit.
Les micronutriments comme le fer, le zinc, le manganèse et le cuivre sont ajoutés aux engrais sous forme chélatée. Cela les empêche d’interagir avec les phosphates et d’autres composants du sol qui peuvent provoquer des précipitations et réduire leur absorption par les plantes.
La chélation permet à ces micronutriments de se déplacer plus facilement dans le sol jusqu’à la zone racinaire pour être absorbés par les plantes.
L’EDTA est largement utilisé dans les méthodes titrimétriques en raison du changement rapide de la concentration en ions métalliques libres au point d’équivalence. Il est également utilisé comme agent masquant dans certaines méthodes spectrophotométriques pour éliminer l’interférence des ions métalliques.
L’EDTA est l’agent chélateur dominant, représentant près de la moitié de la consommation totale en Europe occidentale (78 000 tonnes métriques en 2004). Les principaux producteurs sont Dow Chemical, BASF et AkZO.
5. Toxicologie de l’EDTA
L’EDTA et ses sels sont utilisés depuis longtemps en toute sécurité dans diverses applications, notamment dans les additifs alimentaires, les produits pharmaceutiques et les cosmétiques. Les premières études toxicologiques suggèrent une toxicité relativement faible.
Les études sur les rats indiquent une dose létale élevée (DL50) pour le Na2EDTA (sel disodique), allant de 2,0 à 2,2 grammes par kilogramme de poids corporel.
Les études utilisant du Na2EDTA à 0,5 % à 5,0 % dans l’alimentation n’ont montré aucun effet indésirable significatif, à l’exception de la diarrhée et d’une réduction de l’apport alimentaire à la dose la plus élevée. L’EDTA trisodique ne semble pas être un sensibilisant cutané.
Bien que l’EDTA puisse interagir avec le matériel génétique, sa pertinence pour la génotoxicité humaine (causant des dommages génétiques) semble minime. Les études sur le Na3EDTA (sel trisodique) n’ont montré aucune cancérogénicité liée au composé.
Référence
- Ethylenediaminetetraacetic Acid and Related Chelating Agents; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a10_095.pub2
