Acide chlorhydrique : Propriétés, Production et Utilisations
L’acide chlorhydrique est une solution d’acide inorganique fort de formule chimique HCl. C’est un liquide incolore avec une odeur âcre qui est très corrosif pour la peau, les yeux et les métaux.
Histoire de la découverte
Au XVe siècle, un alchimiste allemand du nom de VALENTIN appliqua de la chaleur à une substance appelée vitriol vert (FeSO4·7 H2O) avec du sel commun. En conséquence, il a obtenu une substance appelée esprit de sel.
Au 17ème siècle, GLAUBER synthétise l’acide chlorhydrique en associant le sel commun à l’acide sulfurique. C’est en 1790 que DAVY établit la composition du chlorure d’hydrogène par la synthèse de l’hydrogène et du chlore.
Au cours de la même année, LEBLANC découvre un procédé qui porte son nom pour la production de soude. Ce processus impliquait de faire réagir du sel commun avec de l’acide sulfurique, entraînant la libération de chlorure d’hydrogène. Initialement considéré comme un sous-produit indésirable, il a été rejeté dans l’atmosphère en quantités importantes.
Cependant, en 1863, l’Alkali Act obligea les producteurs anglais de soude à dissoudre le chlorure d’hydrogène dans l’eau, conduisant à l’utilisation industrielle généralisée de l’acide produit. Tout chlorure d’hydrogène en excès qui ne pouvait pas être utilisé comme acide chlorhydrique était oxydé en chlore.
La synthèse industrielle du chlorure d’hydrogène a émergé parallèlement au développement du procédé électrolytique chlore-alcali au début du XXe siècle. Cette méthode, en plus de celle basée sur la réaction entre les chlorures et l’acide sulfurique ou l’hydrogénosulfate de sodium, a donné un produit plus pur.
Ces procédés perdent progressivement en importance en raison des quantités substantielles de chlorure d’hydrogène générées comme sous-produits dans les procédés de chloration comme la production de chlorure de vinyle à partir d’éthylène.
De plus, l’acide chlorhydrique peut être récupéré à partir des gaz produits lors de l’incinération des déchets contenant du chlore, ce qui correspond à l’attention croissante portée à la protection de l’environnement.
Table des matières
1. Propriétés physiques de l’acide chlorhydrique
Le chlorure d’hydrogène (HCl) existe dans des conditions standard sous la forme d’un gaz transparent caractérisé par sa forte odeur et son impact très corrosif sur les muqueuses du système respiratoire.
Certaines propriétés physiques du chlorure d’hydrogène sont présentées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Masse molaire | 36,461 g/mol |
| Point de fusion (mp) | -114,22 °C |
| Point d'ébullition (pb) | -85,05 °C |
| Densité de vapeur | 1,639 g/L |
| Densité du liquide | 1,18 g/mL |
| Température critique | 51 °C |
| Pression critique | 81,6 bars |
2. Propriétés chimiques de l’acide chlorhydrique
Le chlorure d’hydrogène présente une stabilité thermique jusqu’à environ 1500 °C, au-delà de laquelle il subit une dissociation importante. Sous sa forme complètement sèche, le chlorure d’hydrogène démontre une réactivité limitée, montrant une attaque négligeable sur l’acier doux.
De plus, les réactions impliquant du chlorure d’hydrogène anhydre nécessitent généralement la présence de catalyseurs. Inversement, lorsque le chlorure d’hydrogène est dissous dans un solvant polaire, tel que l’eau, il se transforme en un acide puissant et devient par conséquent un réactif hautement réactif.
La solubilité du chlorure d’hydrogène dans l’eau est importante, accompagnée d’un dégagement de chaleur important. Il en résulte la formation d’acide chlorhydrique, qui possède une nature redoutable et extrêmement agressive.
Il présente la capacité de corroder la plupart des métaux et alliages disponibles dans le commerce à des degrés divers. Par conséquent, les métaux nécessitent une protection par l’utilisation de revêtements non métalliques appropriés ou de matériaux de construction non métalliques.
Dans des conditions bien définies, le tantale ou des alliages de nickel très résistants comme l’Hastelloy B peuvent être utilisés. Cependant, moins de métaux nobles se dissolvent, entraînant la libération d’hydrogène gazeux.
3. Production d’acide chlorhydrique
La présence de chlorure d’hydrogène libre dans la nature est limitée, n’apparaissant qu’à de faibles concentrations. Il a été détecté dans la stratosphère à des niveaux d’environ 10 à 11 % en volume.
D’autre part, les chlorures inorganiques ont une large distribution, le chlore étant le onzième élément chimique le plus abondant. Les chlorures de métaux alcalins et alcalino-terreux, en particulier le sel gemme, servent de matières premières primaires pour diverses méthodes de production de chlorure d’hydrogène ou d’acide chlorhydrique.
Ces méthodes comprennent des procédés impliquant des substances intermédiaires comme le chlore ou des composés organiques chlorés.
Dans les événements naturels, du chlorure d’hydrogène est libéré lors d’éruptions volcaniques ou d’autres rejets de gaz souterrains. La quantité de chlorure d’hydrogène produite peut être comparable à celle du dioxyde de soufre.
L’acide chlorhydrique est naturellement présent dans le suc gastrique des mammifères, avec une concentration d’environ 0,1 mol/L dans l’estomac humain.
3.1. Procedure de Preparation de HCl
Le chlorure d’hydrogène peut être préparé par plusieurs réactions :
1. Synthèse à partir des éléments :
La combinaison d’hydrogène gazeux (H2) et de chlore gazeux (Cl2) conduit à la formation de chlorure d’hydrogène gazeux (HCl) :
H2 + Cl2 → 2 HCl
2. Réaction des chlorures métalliques avec l’acide sulfurique :
Les chlorures métalliques, en particulier le chlorure de sodium, peuvent réagir avec l’acide sulfurique (H2SO4) ou le sulfate d’hydrogène pour produire du chlorure d’hydrogène :
Chlorure métallique + H2SO4 → HCl + Sulfate métallique
3. Sous-produit de chloration :
Lors de la production de divers composés organiques chlorés comme le dichlorométhane, le trichloroéthylène, le perchloroéthylène ou le chlorure de vinyle, le chlorure d’hydrogène se forme comme sous-produit par une série de réactions :
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
4. Décomposition thermique des chlorures de métaux lourds hydratés :
Le chlorure d’hydrogène peut être dérivé de la décomposition thermique des chlorures de métaux lourds hydratés présents dans la liqueur de décapage usée utilisée pour le traitement des métaux.
5. Incinération des déchets organiques chlorés :
Lors de l’incinération des déchets organiques chlorés, du chlorure d’hydrogène est produit :
C4H6Cl2 + 5 O2 → 4 CO2 + 2 H2O + 2 HCl
De nos jours, la principale source de chlorure d’hydrogène est le sous-produit obtenu à partir des procédés de chloration. Le niveau de purification requis dépend de l’application envisagée. Actuellement, la récupération de chlorure d’hydrogène à partir de déchets est en augmentation.
De plus, du chlorure d’hydrogène peut se former dans des réactions indésirables comme l’hydrolyse des catalyseurs de Friedel-Crafts :
AlCl3 + 3 H2O → Al(OH)3 + 3 HCl
3.2. Production industrielle d’acide chlorhydrique
3.2.1. De l’hydrogène et du chlore
La méthode la plus simple pour produire du chlorure d’hydrogène implique la synthèse directe à partir de ses composants élémentaires, résultant en un produit très pur. Cette réaction est hautement exothermique, avec une enthalpie standard de réaction (ΔH) de -184 kJ.
Il est important de noter que les mélanges d’hydrogène et de chlore peuvent être extrêmement explosifs dans une large gamme de compositions. La lumière peut servir d’initiateur pour une explosion. Par conséquent, des précautions doivent être prises pour éviter la formation de mélanges réactifs de chlore et d’hydrogène dans les procédés industriels.
Dans la production industrielle, un brûleur est utilisé, où le chlore et l’hydrogène sont introduits séparément à travers des tubes concentriques dans la chambre de combustion. Une fois enflammé, le chlore brûle en présence d’hydrogène, générant une flamme chaude et silencieuse à des températures dépassant 2000 °C.
La silice a démontré son efficacité en tant que matériau de construction approprié pour le brûleur. La fonte ou l’acier, parfois refroidi à l’eau, ou le graphite ont également été utilisés.
Typiquement, le brûleur est positionné au fond d’une chambre de combustion cylindrique, avec la flamme dirigée verticalement vers le haut. La chambre de combustion elle-même est en acier et revêtue de brique réfractaire. Une section de refroidissement, de taille et de forme appropriées, est reliée à la chambre de combustion.
Si les réactifs sont très humides ou contaminés, des matériaux de construction résistants à la corrosion tels que la silice ou le graphite doivent être utilisés.
Les usines de fabrication existantes sont principalement construites en acier au carbone et le chlorure d’hydrogène produit est refroidi à l’eau uniquement à une température à laquelle l’acide chlorhydrique aqueux ne peut pas se condenser.
Les principaux contaminants sont l’humidité dans l’hydrogène et l’oxygène dans le chlore, bien que les composés oxygénés tels que l’oxyde de dichlore (Cl2O) ou le dioxyde de carbone puissent également poser des problèmes en formant de l’eau.
Le rapport de mélange des matières premières est ajusté en fonction de l’utilisation prévue du chlorure d’hydrogène produit. Un léger excès d’hydrogène ou de chlore peut être utilisé.
Travailler avec des mélanges précisément équimolaires n’est pas recommandé car la réaction n’est pas complètement quantitative et il devient plus difficile d’empêcher les mélanges explosifs.
Les écarts de contrôle peuvent entraîner des décalages intermittents entre l’excès d’hydrogène et l’excès de chlore, entraînant l’apparition occasionnelle de mélanges explosifs.
En règle générale, l’hydrogène dans le chlorure d’hydrogène présente moins de défis que le chlore, de sorte qu’un léger excès de 1 à 2 % d’hydrogène est couramment utilisé. Selon la pureté des matières premières, il est possible d’obtenir du chlorure d’hydrogène complètement exempt de chlore, l’excès d’hydrogène étant la seule impureté.
Ce chlorure d’hydrogène très pur peut être utilisé pour produire de l’acide chlorhydrique exceptionnellement pur ou peut être liquéfié ou fourni directement aux utilisateurs sous forme de gaz sec via des conduites en acier.
L’utilisation de l’acier pour les fours et les refroidisseurs de synthèse est une option intéressante. Cela permet un fonctionnement sous haute pression, qui est déterminée par la pression de chlore et d’hydrogène, ainsi que la température et la pression dans la canalisation.
Il est important de maintenir une pression suffisamment basse ou une température suffisamment élevée pour empêcher la condensation de l’acide chlorhydrique aqueux. Les fours sidérurgiques exploités à H€uls, par exemple, peuvent produire chacun 30 à 40 tonnes par jour de chlorure d’hydrogène.
Le chlorure d’hydrogène gazeux généré a une pression allant jusqu’à 0,7 MPa et une teneur en eau inférieure à 50 ppm (en volume), ce qui nécessite l’utilisation de tuyaux en acier pour le transport depuis l’usine.
Les procédés chimiquement apparentés comprennent la réaction du chlore avec le carbone (sous forme de coke) et la vapeur d’eau :
C + 2 H2O + 2 Cl2 → 4 HCl + CO2
Un autre processus connexe implique la réaction du chlore avec le dioxyde de soufre et l’eau :
SO2 + 2 H2O + Cl2 → 2 HCl + H2SO4
3.2.2. Réaction des chlorures métalliques avec l’acide sulfurique
Le procédé au sulfate se caractérise par une forte consommation d’énergie. Par conséquent, son importance a progressivement diminué par rapport à d’autres procédés, notamment la chloration organique, qui génère des quantités importantes de chlorure d’hydrogène comme sous-produit.
De plus, l’argument selon lequel le sulfate d’acide chlorhydrique donne un produit de pureté supérieure n’est plus valable. L’acide sous-produit peut désormais être purifié de manière adéquate pour répondre aux exigences des normes de haute qualité. Par conséquent, seul le processus sulfate-acide chlorhydrique le plus important sera discuté ici.
La réaction entre le sel commun et l’acide sulfurique concentré se produit à des températures relativement basses (150-300 °C), entraînant la formation de chlorure d’hydrogène et d’hydrogénosulfate de sodium.
Ce dernier réagit avec le chlorure de sodium en excès à une température minimale de 550-600 °C, produisant du sulfate de sodium neutre. Bien que l’utilisation d’hydrogénosulfate de sodium comme matière de départ soit techniquement faisable, elle a été abandonnée en raison de la nature non économique du procédé causée par les températures élevées (600-800 ° C) et la consommation d’énergie impliquée.
Actuellement, l’acide sulfurique est la matière première exclusive. Dans le procédé de Mannheim, le sulfate de sodium est produit, tandis que dans le procédé à l’acide chlorhydrique de Berlin, l’hydrogénosulfate de sodium est utilisé.
Dans le procédé de Mannheim, des fours à moufle à chauffage externe doublés de briques sont utilisés. Ces fours comportent un mécanisme d’agitation avec une action de raclage pour éviter la formation de grumeaux dans la masse pâteuse et pour éliminer le sulfate de sodium produit.
Le chlorure d’hydrogène est évacué par le côté du moufle et propulsé par un ventilateur vers l’étage suivant, le four étant maintenu à une pression légèrement réduite.
Le mélange de gaz d’échappement du four contient jusqu’à 85 % de chlorure d’hydrogène, ainsi que de l’air, du brouillard d’acide sulfurique et de fines particules de sel. En règle générale, le gaz subit plusieurs étapes de purification, notamment une filtration à travers du coke et du charbon actif, un épuration par voie humide ou des réactions chimiques.
Le procédé à l’acide chlorhydrique de Berlin produit du chlorure d’hydrogène gazeux d’une pureté nettement supérieure à celle du procédé de Mannheim. La réaction entre le sel commun et l’acide sulfurique se produit dans l’hydrogénosulfate de sodium fondu à environ 300 ° C dans des autoclaves en fonte.
Alternativement, le chlorure de potassium peut être utilisé, entraînant la production de chlorure d’hydrogène et d’hydrogénosulfate de potassium. Ce processus conserve une certaine importance commerciale en raison du fait que les produits primaires sont les sels de potassium formés (c’est-à-dire KHSO4 et K2S2O7), le chlorure d’hydrogène étant considéré comme un sous-produit.
Le gaz des autoclaves est plus concentré en raison de la nature étanche améliorée de l’équipement, ce qui entraîne des niveaux inférieurs de brouillard d’acide sulfurique en raison de la température de travail réduite.
3.2.3. Récupération en tant que sous-produit de la chloration
La principale source de chlorure d’hydrogène et d’acide chlorhydrique est le sous-produit des processus de chloration. Le craquage du 1,2-dichloroéthane pour produire du chlorure de vinyle se distingue comme le principal contributeur à la production de chlorure d’hydrogène.
Les quantités de chlorure d’hydrogène générées et consommées peuvent être importantes, de nombreuses installations produisant environ 10 000 m3/h (16 t/h ou 140 000 t/a) ou plus.
Par conséquent, le chlorure d’hydrogène est souvent fourni directement aux usines chimiques qui l’utilisent comme matière première. Les capacités de stockage du chlorure d’hydrogène sont généralement relativement faibles. Par conséquent, il est crucial de maintenir un rythme équilibré de production et de consommation.
En cas de problèmes de production ou de fluctuations du marché affectant une usine ou un produit, l’autre usine ne peut continuer à fonctionner que s’il existe une capacité de production de réserve (qui n’est généralement pas pleinement utilisée) en place.
Le stockage tampon du chlorure d’hydrogène liquide est utilisé pour remédier aux déséquilibres à court terme entre la production et la consommation.
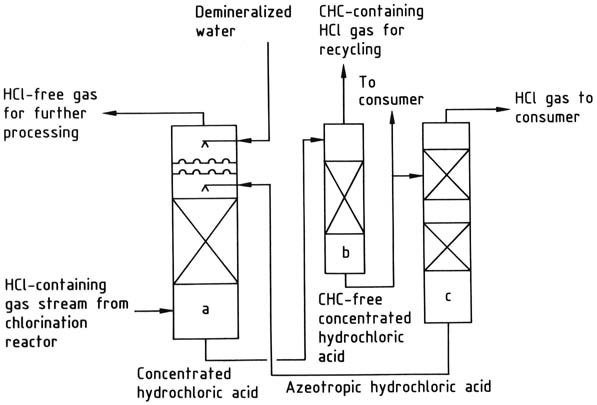
Le chlorure d’hydrogène produit par chloration organique peut subir différents traitements :
1. Condensation simple des hydrocarbures chlorés : Cette approche est utilisée lorsque la présence d’hydrocarbures chlorés résiduels ou d’autres sous-produits du processus de chloration ne pose aucun problème pour le chlorure d’hydrogène, qui est fourni sous forme de gaz.
Le niveau de purification atteint dépend de la pression et de la température de condensation. Par exemple, dans la chloration du chlorométhane en dichlorométhane, le chlorure d’hydrogène résultant est uniquement utilisé pour convertir le méthanol en chlorométhane, qui est ensuite utilisé pour produire du dichlorométhane.
2. Isolation et purification du chlorure d’hydrogène par distillation : La distillation fractionnée du gaz liquéfié peut être utilisée lorsqu’un produit plus pur est requis. Par exemple, les produits gazeux issus du craquage du 1,2-dichloroéthane sont liquéfiés puis séparés par distillation en chlorure de vinyle et chlorure d’hydrogène.
La liquéfaction de ces gaz à des températures extrêmement basses est économiquement irréalisable, de sorte que la condensation et la distillation sont effectuées sous pression élevée. Un avantage de cette méthode est que le chlorure d’hydrogène gazeux est produit à une pression suffisamment élevée (généralement 1-2 MPa) pour un traitement ultérieur, éliminant ainsi le besoin d’une compression mécanique supplémentaire.
3. Absorption aqueuse de chlorure d’hydrogène : Cette méthode entraîne la production d’acide chlorhydrique comme produit intermédiaire mais présente des défis liés aux matériaux de construction.
Cependant, l’introduction de fluoropolymères a atténué ces problèmes dans une large mesure. Néanmoins, de nombreuses installations ont remplacé le traitement aqueux par des méthodes non aqueuses, telles que la distillation fractionnée.
Le chlorure d’hydrogène peut être absorbé à l’aide d’eau ou d’une solution d’acide chlorhydrique à 20 % en poids. L’eau convient lorsque l’objectif principal est de produire 30 à 35 % en poids d’acide chlorhydrique comme produit final.
Si la demande d’un tel acide est insuffisante, l’azéotrope à 20 % est utilisé pour l’absorption du chlorure d’hydrogène, concentrant ainsi l’acide à une concentration de 30 à 35 % en poids.
L’acide chlorhydrique concentré est purifié si nécessaire puis distillé pour donner du chlorure d’hydrogène gazeux et de l’acide chlorhydrique azéotropique. Le chlorure d’hydrogène est séché et livré au consommateur, tandis que l’azéotrope est recyclé vers l’étape d’absorption.
Si la présence d’hydrocarbures chlorés dans l’acide chlorhydrique n’est pas souhaitable, une étape de stripage peut être mise en œuvre pour les éliminer.
Pour éliminer le chlorure d’hydrogène d’un flux gazeux, une petite quantité d’eau est introduite dans la colonne d’absorption. Cette addition d’eau garantit que le courant gazeux devient exempt de chlorure d’hydrogène. Cependant, une quantité correspondante d’acide doit être séparée à d’autres fins.
Plusieurs paramètres de procédé et d’équipement sont cruciaux pour évaluer l’économie de l’absorption aqueuse de chlorure d’hydrogène à partir d’un flux de gaz de production :
1. La concentration de chlorure d’hydrogène dans le flux gazeux détermine la pression et la température maintenues dans la colonne d’absorption.
2. L’énergie nécessaire pour libérer le chlorure d’hydrogène gazeux pur diminue à mesure que la concentration de l’acide concentré formé augmente.
3. La production d’acide chlorhydrique concentré à partir d’un courant gazeux à faible concentration en chlorure d’hydrogène nécessite des efforts considérables. Cela peut impliquer d’augmenter la pression, de réduire la température ou les deux.
4. La présence d’une concentration élevée de vapeur d’eau dans le flux de gaz de production peut rendre la production d’acide chlorhydrique concentré impossible dans certaines circonstances.
Une approche proposée pour absorber de faibles niveaux de chlorure d’hydrogène à partir de gaz contenant des niveaux élevés de vapeur d’eau consiste à utiliser une solution de chlorure de magnésium.
Le choix des matériaux de construction pour les équipements d’absorption de chlorure d’hydrogène est limité en raison de l’attaque potentielle par l’acide chlorhydrique concentré et les hydrocarbures chlorés. Des échangeurs de chaleur en graphite sont utilisés pour refroidir l’acide.
Pour les pompes, un matériau céramique spécial a traditionnellement été le choix économiquement viable. La colonne de distillation est revêtue de briques résistantes aux acides ou de blocs de graphite, les briques étant cimentées à l’aide de résine phénolique.
Un revêtement en caoutchouc résistant aux acides est souvent appliqué entre le boîtier en acier et le mur de briques pour empêcher l’attaque de l’acide par les pores et les fissures.
L’équipement entièrement en résine phénolique présente une excellente résistance chimique mais est cassant et mécaniquement fragile, nécessitant généralement un support, tel qu’une coque extérieure en résine polyester renforcée de fibres de verre. Ce type d’équipement est adapté à un fonctionnement à pression atmosphérique ou légèrement supérieure.
Des considérations similaires s’appliquent à la colonne de rectification des hydrocarbures chlorés. Si la concentration d’hydrocarbures chlorés est faible ou s’ils ont été efficacement éliminés de l’acide, d’autres matériaux comme le poly(chlorure de vinyle) peuvent être utilisés pour les récipients de stockage.
La colonne de désorption, cependant, est en graphite en raison de la température de fonctionnement élevée. Alternativement, des colonnes revêtues de caoutchouc avec des revêtements intérieurs en briques peuvent être utilisées.
Les colonnes en acier revêtues de perfluoropolymère, en particulier de polytétrafluoroéthylène (PTFE), ont montré d’excellents résultats, bien que des variations de produits entre différents fabricants puissent exister concernant la microporosité, la résistance à la déchirure et les propriétés d’écoulement.
Les colonnes en acier revêtu offrent des avantages par rapport aux colonnes en graphite car elles peuvent fonctionner à une pression élevée, mais une défaillance du revêtement en PTFE entraînerait une destruction rapide du tubage en acier. Ces colonnes peuvent être construites à l’aide de petits éléments individuels qui peuvent être remplacés rapidement, minimisant ainsi les temps d’arrêt pour maintenance.
Les échangeurs de chaleur sont dans tous les cas en graphite. Un revêtement en tantale et des évaporateurs sont également possibles, mais des précautions doivent être prises pour éviter la fragilisation due à l’absorption d’hydrogène. De plus, le fluorure d’hydrogène doit être absent.
Le chlorure d’hydrogène complètement sec ne corrode pas les tuyaux en acier ni les compresseurs. Autrefois, l’acide sulfurique concentré était utilisé pour sécher le chlorure d’hydrogène gazeux. Une autre approche utilise les propriétés du système HCl-H2O.
À basse température, la pression de vapeur partielle de l’eau sur de l’acide chlorhydrique hautement concentré est très faible, ce qui permet de sécher le chlorure d’hydrogène en le refroidissant à des températures inférieures à zéro suffisamment basses.
À une pression légèrement élevée (p ≈ 0,3 MPa), atteindre -10 °C est généralement suffisant pour obtenir des résultats satisfaisants. Cependant, le brouillard d’acide chlorhydrique doit être complètement éliminé pour éviter une corrosion sévère.
3.2.4. Récupération de l’incinération des déchets
Tous les processus de chloration entraînent inévitablement la formation d’hydrocarbures chlorés indésirables à côté des produits souhaités. Ces substances inutilisables et souvent nocives doivent être éliminées pour des raisons environnementales.
Une méthode possible est l’incinération, qui convertit les hydrocarbures chlorés en chlorure d’hydrogène, en eau et en dioxyde de carbone. La récupération du chlorure d’hydrogène est essentielle tant pour des considérations économiques qu’environnementales.
Bien que les techniques spécifiques employées puissent varier, le principe sous-jacent reste le même. La combustion a lieu dans un four garni de matériaux réfractaires à des températures supérieures à 1000 °C.
Les hydrocarbures chlorés résiduaires contenant typiquement jusqu’à 70 % en poids de chlore ont tendance à présenter de bonnes propriétés de combustion. Cependant, des augmentations supplémentaires de la teneur en chlore diminuent la valeur calorifique à un point tel que le processus de combustion nécessite l’ajout de mazout ou de gaz pour le soutenir.
Les conditions de réaction optimales se situent dans la plage suivante :
1. Un excès d’oxygène doit être présent pour assurer une décomposition complète des hydrocarbures chlorés. Le chlorure d’hydrogène gazeux résultant peut alors réagir avec cet oxygène selon l’équation de Deacon :
2 HCl + 0,5 O2 ↔ Cl2 + H2O
L’augmentation de la température déplace l’équilibre vers la gauche, favorisant la formation de chlorure d’hydrogène. La température est maintenue aussi élevée que possible pour les matériaux de construction afin d’éviter la formation de chlore.
Même avec une pression partielle d’eau élevée et un faible excès d’oxygène, une température supérieure à 1000 °C est nécessaire pour obtenir le changement d’équilibre souhaité. Cette approche aide à maintenir les niveaux de chlore dans une plage acceptable et assure une combustion complète.
2. La température de réaction ne doit pas dépasser 1200 °C pour éviter la formation d’oxydes d’azote. Ces oxydes contamineraient le produit d’acide chlorhydrique et poseraient des problèmes pour la purification des gaz résiduaires. Utiliser de l’oxygène pur au lieu de l’air peut être une solution possible.
Pour ces raisons, l’incinération des déchets d’hydrocarbures chlorés se produit généralement entre 1000 et 1200 °C. Le refroidissement des gaz de combustion et la production de vapeur peuvent poser des problèmes liés aux matériaux de construction. Il est important de s’assurer de l’absence de produits de combustion corrosifs.
Les déchets traités doivent avoir une composition bien connue, y compris des traces de contaminants, pour prédire avec précision les produits de combustion attendus, leurs concentrations et leur comportement. Un refroidissement rapide est préférable pour empêcher la reformation du chlore, car un refroidissement lent peut conduire à sa reformation.
Le chlorure d’hydrogène est récupéré des gaz de combustion par absorption. Le procédé de récupération est similaire à celui utilisé dans les procédés de chloration, à quelques exceptions près :
1. Un procédé à sec n’est pas possible car la vapeur d’eau est toujours présente.
2. Les gaz doivent être condensés de manière à permettre la formation d’acide chlorhydrique le plus concentré possible. Cela permet de récupérer soit du chlorure d’hydrogène gazeux, soit de l’acide chlorhydrique concentré. L’acide chlorhydrique dilué a une valeur commerciale limitée.
3. Des problèmes particuliers de corrosion doivent être relevés au niveau des points de condensation acide potentiels, qui peuvent ne pas se produire régulièrement mais peuvent néanmoins présenter des risques.
4. Si les produits de combustion gazeux sont utilisés directement, la température de fonctionnement doit toujours être maintenue au-dessus de la température de condensation de l’acide chlorhydrique.
L’une des plus anciennes usines produisant des quantités commerciales d’acide chlorhydrique à 33 % en poids par incinération d’hydrocarbures chlorés est située à Saint-Auban, en France, exploitée par Atochem. Cette usine, créée en 1975, consomme environ 16 000 tonnes d’hydrocarbures chlorés par an.
3.3. Purification de l’acide chlorhydrique
Le charbon actif peut éliminer efficacement diverses impuretés dans le chlorure d’hydrogène gazeux, y compris le SO2, l’As et le Cl2, par adsorption. Au fur et à mesure que l’importance du procédé au sulfate diminue, l’élimination des hydrocarbures chlorés du chlorure d’hydrogène gazeux ou de l’acide chlorhydrique devient plus pertinente dans la pratique.
Le chlorure d’hydrogène gazeux peut subir une purification par épuration à basse température à l’aide d’un solvant à point d’ébullition élevé, qui peut être un autre hydrocarbure chloré (par exemple, l’hexachlorobutadiène ou le tétrachloroéthane) ou des fractions d’huile spécifiques. Suite à un tel traitement, l’utilisation de charbon actif est souvent inutile.
Le chlore peut être éliminé en utilisant du tétrachlorure de carbone, car il est nettement plus soluble dans le tétrachlorure de carbone que dans le chlorure d’hydrogène gazeux.
L’acide chlorhydrique, qu’il soit utilisé directement ou pour la génération de chlorure d’hydrogène, contient principalement des impuretés volatiles telles que des hydrocarbures chlorés. Dans de tels cas, ces impuretés peuvent être éliminées de l’acide par stripage.
Le stripage avec un flux de gaz inerte est une option réalisable qui se traduit par une consommation d’énergie moindre. Cependant, dans la plupart des cas, le chauffage du gaz est préféré pour des raisons environnementales. Les impuretés inorganiques, en particulier le fer, peuvent être éliminées par échange d’ions.
4. Utilisations de l’acide chlorhydrique
L’acide chlorhydrique et le chlorure d’hydrogène sont des produits chimiques vitaux dans divers processus industriels.
La majorité du chlorure d’hydrogène est généralement utilisée immédiatement par le producteur, car le sous-produit des procédés de chloration organique doit être pleinement utilisé. Ceci est réalisé par des techniques d’oxychloration ou d’hydrochloration, ou dans certains cas, des méthodes de récupération du chlore telles que le procédé KEL, le procédé Deacon modifié ou l’électrolyse de l’acide chlorhydrique.
L’acide chlorhydrique aqueux trouve de nombreuses applications en tant qu’acide inorganique fort. Il est utilisé dans la fabrication de chlorures, la dissolution de minéraux, le décapage et l’attaque de métaux, la régénération de résines échangeuses d’ions pour le traitement de l’eau, la neutralisation de produits alcalins ou de déchets, l’acidification de la saumure dans l’électrolyse chlore-alcali et de nombreux autres procédés industriels. processus.
5. Toxicologie et santé au travail
Le chlorure d’hydrogène est connu pour provoquer une grave irritation des yeux, des voies respiratoires et de la peau, quoique dans une moindre mesure. L’exposition à ses vapeurs peut entraîner une kératoconjonctivite et l’inhalation peut entraîner une irritation et des lésions des muqueuses. L’odeur de chlorure d’hydrogène peut typiquement être détectée à des concentrations de 1 à 5 ppm, devenant désagréable à 5 à 10 ppm.
Une exposition professionnelle prolongée à des niveaux élevés de chlorure d’hydrogène peut augmenter le risque de bronchite chronique, de troubles gastriques et intestinaux et de caries dentaires, même à des concentrations apparemment tolérables. Des concentrations supérieures à 10 ppm peuvent provoquer une forte irritation, même avec acclimatation.
Le personnel travaillant avec de l’acide chlorhydrique doit porter des lunettes de protection, des vêtements, des gants en caoutchouc et des bottes appropriés. L’inhalation de la vapeur doit être évitée et des filtres respiratoires conçus pour les gaz inorganiques sont recommandés.
En République fédérale d’Allemagne, la réglementation relative au contrôle des substances dangereuses s’applique au chlorure d’hydrogène et à l’acide chlorhydrique (>10% en poids), conformément aux directives CEE. Ces réglementations spécifient les symboles de danger, les consignes de sécurité et les précautions à prendre pour la manipulation de ces substances.
En cas de contact avec la peau ou les yeux, un rinçage immédiat et abondant à l’eau est indispensable. Les vêtements contaminés doivent être traités de la même manière et des solutions de nettoyage alcalines peuvent être utilisées.
Lorsque vous travaillez avec du chlorure d’hydrogène, en particulier à pression élevée, il est essentiel d’avoir un appareil respiratoire facilement disponible avec une alimentation en air indépendante et des vêtements de protection complets en cas d’accident.
En Allemagne, la concentration maximale autorisée (MAK) pour le chlorure d’hydrogène est de 5 ppm en volume, ce qui équivaut à 7 mg/m3. Les mêmes valeurs servent de valeur limite de seuil (TLV) aux États-Unis. En Union soviétique, la limite établie est de 3 ppm (5 mg/m3).
Les règlements sur la qualité de l’air précisent les limites de concentration de chlorure d’hydrogène dans l’atmosphère, telles que 0,1 mg/m3 en moyenne annuelle et 0,2 mg/m3 pendant de courtes périodes. Différentes espèces de plantes présentent des tolérances variables à l’exposition au chlorure d’hydrogène.
En ce qui concerne les gaz résiduaires industriels, la concentration de chlorure d’hydrogène ne doit généralement pas dépasser 30 mg/m3 selon la réglementation allemande, bien que la limite soit de 50 mg/m3 pour les usines d’incinération des déchets. Le coût du nettoyage des gaz peut donc varier considérablement.
Un lavage à l’eau est souvent suffisant pour éliminer le chlorure d’hydrogène, mais plusieurs étapes peuvent être nécessaires, y compris un lavage final avec une solution alcaline.
Dans certains cas, l’acide chlorhydrique commercial ne peut pas être produit et l’acide dilué est neutralisé avant d’être rejeté dans les eaux usées. La neutralisation à la soude caustique peut parfois produire une solution saline suffisamment pure pour être recyclée dans une usine de chlore.
Référence
- Hydrochloric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_283
FAQ : Acide chlorhydrique
L’acide chlorhydrique (HCl) est un acide fort et hautement corrosif composé d’hydrogène et de chlore. C’est un liquide incolore avec une odeur piquante.
Oui, l’acide chlorhydrique est considéré comme un acide fort. Il s’ionise complètement dans l’eau, libérant des ions hydrogène (H+) et des ions chlorure (Cl-) pour créer une solution acide.
L’acide chlorhydrique a diverses utilisations industrielles et de laboratoire. Il est couramment utilisé dans la synthèse chimique, le nettoyage des métaux, la régulation du pH, le traitement des minerais et la production d’engrais, de colorants et de produits pharmaceutiques. Il est également utilisé dans l’industrie alimentaire pour la transformation des aliments et dans les suppléments d’acide gastrique.
L’acide chlorhydrique n’est pas inflammable. Cependant, il peut réagir avec certaines substances, telles que des matières organiques ou des métaux réactifs, libérant de l’hydrogène gazeux inflammable.
Oui, l’acide chlorhydrique est très corrosif et peut causer de graves brûlures à la peau, aux yeux et au système respiratoire. L’inhalation ou l’ingestion d’acide chlorhydrique concentré peut être extrêmement dangereuse. Les précautions de sécurité et les procédures de manipulation appropriées doivent être suivies.
L’acide chlorhydrique est généralement produit en dissolvant du chlorure d’hydrogène gazeux dans de l’eau. La production industrielle implique souvent la réaction du chlore gazeux avec l’hydrogène gazeux. Ces processus ne doivent être effectués que dans des environnements industriels contrôlés en raison de la nature dangereuse des produits chimiques impliqués.
La force de l’acide chlorhydrique est généralement exprimée par sa concentration. Les concentrations courantes vont de diluées (par exemple, 10 % ou moins) à concentrées (par exemple, 37 % ou plus). L’acide chlorhydrique concentré est très corrosif et nécessite des précautions de manipulation particulières.
En cas de petit déversement d’acide chlorhydrique, contenir immédiatement le déversement en portant un équipement de protection approprié. Neutralisez l’acide à l’aide d’une base appropriée, telle que le bicarbonate de sodium ou le carbonate de calcium, et nettoyez soigneusement la zone en évitant tout contact avec la peau ou les yeux. Éliminer les déchets conformément aux réglementations locales.
L’acide chlorhydrique est un solvant puissant et peut dissoudre de nombreux métaux, oxydes métalliques, carbonates et certains composés organiques. Il est particulièrement efficace pour dissoudre la rouille ou le tartre des surfaces métalliques.
Le contact avec l’acide chlorhydrique peut provoquer de graves brûlures et des lésions tissulaires de la peau. Il est essentiel de rincer immédiatement la zone affectée avec de grandes quantités d’eau et de consulter un médecin.
L’acide chlorhydrique peut être neutralisé en ajoutant une base, telle que le bicarbonate de sodium (bicarbonate de soude) ou le carbonate de calcium (copeaux de marbre). La réaction de neutralisation produit de l’eau et un sel chlorure. Cependant, la neutralisation ne doit être effectuée qu’avec des mesures de sécurité appropriées et dans des conditions contrôlées.
La formule chimique de l’acide chlorhydrique est HCl, indiquant qu’il est composé d’un atome d’hydrogène et d’un atome de chlore.
La réaction entre l’ammoniac (NH3) et l’acide chlorhydrique (HCl) produit le sel chlorure d’ammonium (NH4Cl).
Lorsque le magnésium métallique réagit avec l’acide chlorhydrique, il produit de l’hydrogène gazeux (H2) ainsi que du chlorure de magnésium (MgCl2).
L’acide chlorhydrique doit être stocké dans un endroit frais et bien ventilé, à l’écart des sources d’inflammation, des substances incompatibles et de la lumière directe du soleil. Il doit être conservé dans des contenants hermétiquement fermés et correctement étiquetés faits de matériaux résistants aux produits chimiques.
Divers minéraux peuvent réagir avec l’acide chlorhydrique. Par exemple, les carbonates comme le calcaire (carbonate de calcium) produisent une effervescence ou des bulles lorsqu’ils sont exposés à l’acide chlorhydrique en raison de la libération de gaz carbonique.
L’acide chlorhydrique est un liquide incolore. Il n’a pas de couleur distincte.
