Trimetilamina: propiedades, reacciones, producción y usos
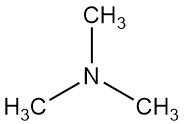
La trimetilamina es un compuesto orgánico con la fórmula N(CH3)3. Es un gas incoloro o líquido comprimido con un fuerte olor a pescado en bajas concentraciones. En concentraciones más altas, el olor se vuelve más parecido al del amoníaco.
La trimetilamina es un compuesto natural que se encuentra en pequeñas cantidades en muchas plantas y animales. También se produce por la descomposición de la materia orgánica, como el pescado y otros mariscos. En el cuerpo humano, lo producen las bacterias intestinales cuando descomponen ciertos alimentos.
Tabla de contenido
1. Propiedades físicas de la trimetilamina
La trimetilamina tiene un olor a pescado más fuerte que las otras metilaminas (metilamina y dimetilamina). La nariz humana puede detectar trimetilamina en una concentración baja de <10 ppb producida a partir de la descomposición de plantas y animales.
El hidrato cristalino (CH3)3N·10 H2O se forma enfriando soluciones acuosas saturadas de trimetilamina. A presión atmosférica, forma azeótropos de punto de ebullición mínimo con amoníaco y otras metilaminas.
La trietilamina es soluble en varios disolventes orgánicos, incluidos metanol, etanol, dimetilformamida y etilenglicol y sus soluciones acuosas pueden disolver muchos compuestos orgánicos e inorgánicos.
Algunas propiedades físicas de la trimetilamina se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Peso molecular, g/mol | 59.11 |
| Punto de ebullición (101,33 kPa), °C | 2.8 |
| Punto de fusión, °C | -117.1 |
| Densidad (a 25 °C, líquido), g/cm3 | 0,6331 |
| pKa (a 25 °C) | 9,80 |
| Índice de refracción a 0 °C | 1,3631 |
| Tensión superficial (25 °C), 10-3 N/m | 13.47 |
| Calor de vaporización a 25 °C, kJ/mol | 22.864 |
| Calor de vaporización en el punto de ebullición, kJ/mol | 27.708 |
| Calor de fusión, kJ/mol | 6.548 |
| Calor de formación estándar a 25 °C (líquido), kJ/mol | -45,80 |
| Calor de formación estándar a 25 °C (gas), kJ/mol | -23,86 |
| Calor de combustión, estado estándar a 25 °C, líquido, kJ/mol | -2422,60 |
| Capacidad calorífica, gas ideal (25 °C), J K-1 mol-1 | 91,8 |
| Temperatura crítica, °C | 160.1 |
| Presión crítica, MPa | 4.07 |
| Constante dieléctrica (25 °C), líquido | 2.44 |
| Momento dipolar en benceno (25 °C), D | 0,87 |
| Punto de inflamación (copa cerrada), °C | -71 |
| Temperatura de ignición en el aire, °C | 190 |
| Límite inferior de explosión en el aire, % vol | 2 |
| Límite superior de explosión en el aire, % vol | 11.6 |
2. Reacciones químicas de la trimetilamina
La trimetilamina es una base débil que forma sales como el cloruro de trimetilamonio con ácido clorhídrico. Esta reacción involucra el par solitario de electrones del átomo de nitrógeno.
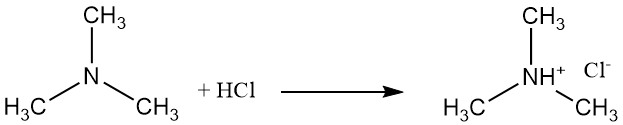
En la fase gaseosa, la basicidad de las metilaminas aumenta según la sustitución del grupo metilo, de la siguiente manera:
(CH3)3N > (CH3)2NH > CH3NH2 > NH3
Sin embargo, en solución acuosa, la basicidad de la trimetilamina es menor que la de la dimetilamina y la metilamina. Esto se atribuye a una solvatación más pobre del ion trimetilamonio, (CH3)3NH+, que tiene solo un hidrógeno disponible para formar enlaces de hidrógeno con moléculas de agua.
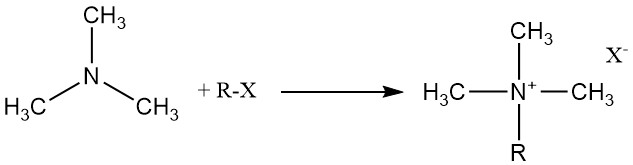
La trimetilamina reacciona con ácidos orgánicos e inorgánicos, haluros de alquilo y epóxidos para formar sales de amonio cuaternario.
La reacción de la trimetilamina con óxido de etileno produce de colina o cloruro de colina cuando se utiliza cloruro de trimetilamonio.

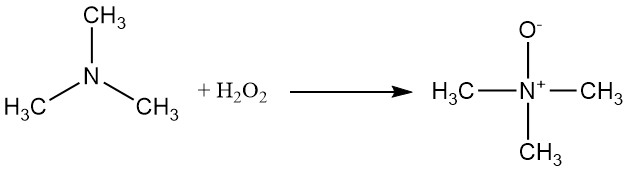
La trimetilamina se puede oxidar con peróxido de hidrógeno o un perácido para producir óxido de trimetilamina.
3. Producción industrial de trimetilamina
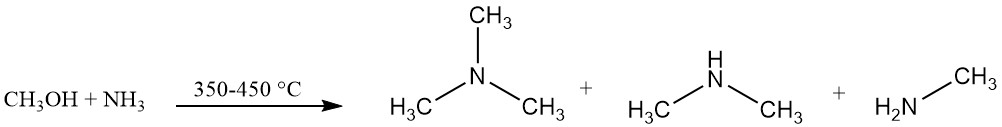
La trimetilamina se produce industrialmente mediante la reacción de amoníaco y metanol en presencia de un catalizador, normalmente un catalizador a base de alúmina, a 350-450 °C. Esta reacción produce trimetilamina junto con dimetilamina y metilamina.
El equilibrio de la reacción favorece la formación de trimetilamina, pero la demanda del mercado es mayor para la monoetilamina y especialmente la dimetilamina.
El uso de catalizadores ácidos sólidos amorfos, incluidas alúminas, sílices y fosfatos, favorece la formación de trimetilamina en contraste con las zeolitas de forma selectiva que son selectivas para la producción de dimetilamina.
La mezcla resultante contiene materiales sin reaccionar (amoníaco, metanol) junto con los productos deseados (monoetilamina, dimetilamina y trimetilamina), agua generada durante la reacción y otros subproductos.
Una serie de cuatro a cinco columnas de destilación separan y purifican los componentes individuales. La trimetilamina anhidra pura se recupera de la mezcla mediante destilación extractiva con agua para romper la mezcla azeotrópica formada con las otras metilaminas.
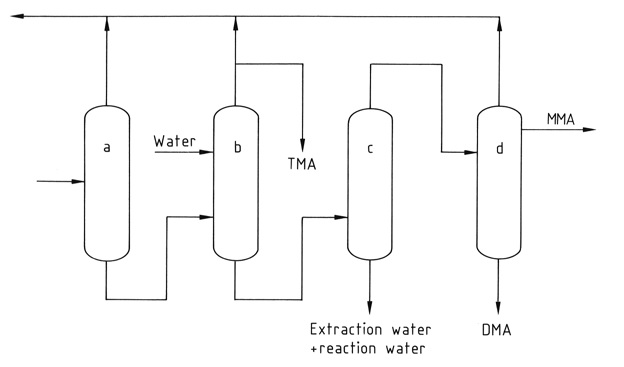
a) Columna de amoniaco; b) Columna de destilación extractiva; c) Columna para eliminación de agua; d) columna de productos MMA y DMA
*MMA: metilamina; DMA: dimetilamina; MAT; trimetilamina
4. Usos de la trimetilamina
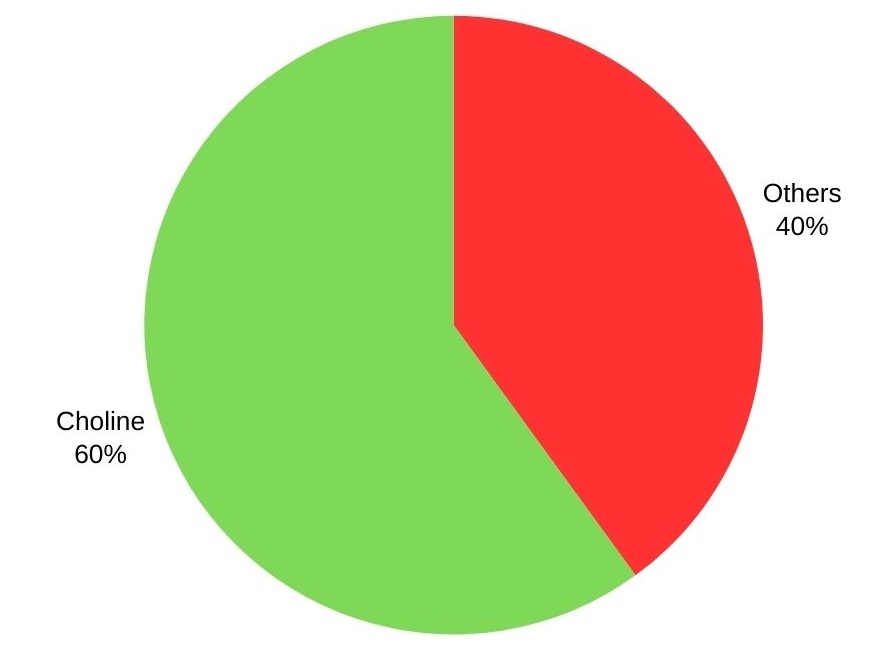
La trimetilamina se utiliza principalmente para producir colina y sus sales, con más del 60%. Otras aplicaciones incluyen la fabricación de almidones catiónicos, desinfectantes, agentes de flotación, edulcorantes intensos y resinas de intercambio iónico.
La trimetilamina se utiliza como catalizador en la producción de hidróxidos y sales de amonio cuaternario.
También se puede utilizar para atraer insectos y se añade al gas natural inodoro como medida de seguridad para detectar fugas.
5. Toxicología de la trimetilamina
La trimetilamina es un líquido o gas altamente inflamable que irrita la piel, los ojos y el tracto respiratorio y causa edema pulmonar (acumulación de líquido en los pulmones).
Límites de exposición
- Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH): 10 ppm (promedio) y 15 ppm (a corto plazo)
- Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH): 5 ppm (promedio) y 15 ppm (a corto plazo)
Efectos sobre la salud
- Agudo (a corto plazo): irritación de la piel y los ojos, irritación del tracto respiratorio, tos, dificultad para respirar. La exposición grave puede provocar edema pulmonar.
- Crónico (a largo plazo): No existe evidencia concluyente de carcinogenicidad o efectos reproductivos. Otros efectos sobre la salud a largo plazo aún no están completamente caracterizados.
Manipulación y almacenamiento
- Almacenar lejos de agentes oxidantes, mercurio, óxido de etileno, ácidos fuertes, metales y bases fuertes.
- Mantenga un área de almacenamiento fresca y bien ventilada.
- Elimine las fuentes de ignición como el humo y las llamas abiertas.
- Contenedores metálicos conectados a tierra y unidos durante la transferencia.
- Utilice herramientas y equipos que no produzcan chispas.
Referencias
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/1927.pdf
