Trietilamina: Propiedades, Producción y Usos
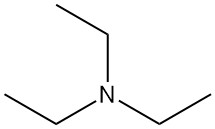
La trietilamina (TEA) es una amina terciaria, representada por la fórmula química N(CH2CH3)3. Es un líquido incoloro, fácilmente inflamable y con olor parecido al amoníaco. Es una de las bases de amina orgánica más utilizadas en la química orgánica.
Tabla de contenido
1. Propiedades físicas de la trietilamina
La trietilamina es un líquido inflamable, incoloro y de olor desagradable. Las propiedades físicas importantes se enumeran en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número de registro CAS | [121-44-8] |
| Fórmula química | (C2H5)3N |
| Color | Incoloro |
| Estado físico | Líquido |
| Peso molecular (Sr.) | 101.19 |
| Punto de fusión (pf), °C | -115 |
| Punto de ebullición (pb), °C | 89,3 |
| Densidad (d) a 20 °C | 0,7275 |
| Índice de refracción (n) a 20 °C | 1.4010 |
| Punto de inflamación, °C | -11 |
| pKB (25 °C) | 3.24 |
| Constante de disociación (pKa) | 10,76 |
| Umbral de olor, ppm; v/v | 0,48 |
| Solubilidad en agua | Miscible en agua (112 g/L a 20 °C) |
| Solubilidad en disolventes orgánicos | Miscible en etanol y éter etílico |
| Densidad de presión de vapor | 3,48 |
| Presión de vapor a 20 °C, torr | 54 |
| Inflamabilidad automática (°C) | 215 |
2. Reacciones químicas de la trietilamina
La trietilamina presenta altos riesgos de incendio y de seguridad cuando se expone al calor, llamas u oxidantes, y se vuelve explosiva en forma de vapor.
La trietilamina sin diluir complejada con tetraóxido de dinitrógeno puede descomponerse explosivamente por debajo de 0°C.
La trietilamina reacciona exotérmicamente con anhídrido maleico por encima de 150 °C, generando calor y potencialmente presentando riesgos de incendio. Al descomponerse debido al calor, emite vapores tóxicos de óxido de nitrógeno (NOx).
Las principales reacciones de la trietilamina son:
1. Formación de sales con ácidos
Debido a sus sustituyentes alquilo, la trietilamina es una base más fuerte que el amoníaco y forma sales altamente solubles en agua con ácidos orgánicos e inorgánicos. La diferencia de solubilidad entre la trietilamina y su sal la convierte en un buen aceptor de ácidos y disolvente para la depuración de gases y para ciertos procesos de extracción como la producción de penicilina semisintética.
Además, actúa como un potente aceptor de protones en diversas reacciones, incluidas oxidaciones, reducciones, eliminaciones, sustituciones y adiciones. Las sales cuaternarias resultantes se eliminan fácilmente una vez finalizado.
2. alquilación
La reacción de trietilamina con haluros de alquilo y sulfatos de dialquilo para dar, en última instancia, compuestos de amonio cuaternario se utiliza en la química farmacéutica preparativa y para la preparación de agentes anticorrosivos y biocidas.
3. Oxidación
La trietilamina se oxida con peróxido de hidrógeno a óxido de trietilamina.

3. Producción de trietilamina
La trietilamina se produce haciendo reaccionar amoníaco con etanol, N,N-dietilacetamida con hidruro de litio y aluminio y cloruro de etilo con amoníaco bajo calor y presión. e hidrogenación catalítica en fase gaseosa de acetonitrilo.
1. Amoníaco y etanol

El método más común consiste en hacer reaccionar amoníaco (NH3) con etanol (CH3CH 2OH) a altas temperaturas y presiones sobre un catalizador de deshidratación o deshidrogenación. Los catalizadores como la alúmina, la sílice-alúmina o la plata promueven eficazmente la reacción, produciendo una mezcla de etilamina, dietilamina y trietilamina.
Las posteriores separaciones mediante extracciones y destilaciones aíslan la trietilamina con alta pureza. Este método ofrece altos rendimientos pero requiere un manejo cuidadoso de los intermedios volátiles y condiciones de reacción que consumen mucha energía.
También se puede sintetizar una mezcla de mono, di y trietilamina a partir de acetaldehído, amoníaco e hidrógeno en presencia de un catalizador de hidrogenación.

a) Vaporizador; b) Intercambiador de calor; c) sobrecalentador; d) Convertidor catalítico; e) Enfriador de productos; f) Separador de gases; g) columna de amoníaco; h) columna de monoetilamina; i) columna de dietilamina; j) Decantador; k) Columna de trietilamina
2. N,N-Dietilacetamida e hidruro de litio y aluminio

Una ruta especializada utiliza N,N-dietilacetamida (CH3CH2CON(CH 2CH3)2) como sustrato. La reducción con hidruro de litio y aluminio (LiAlH4) genera directamente trietilamina. Este método evita la mezcla compleja de productos de amina, pero requiere reactivos especializados y protocolos de seguridad específicos debido a la naturaleza pirofórica del LiAlH4.
3. Cloruro de etilo y amoniaco

Bajo alta temperatura y presión, el cloruro de etilo (CH3CH2Cl) puede reaccionar con amoníaco para formar trietilamina. Sin embargo, este proceso normalmente requiere pasos de purificación adicionales para eliminar subproductos (HCl) y reactivos residuales.
4. Hidrogenación catalítica en fase gaseosa de acetonitrilo

La trietilamina se puede producir de forma continua mediante hidrogenación de acetonitrilo en fase gaseosa, utilizando un metal noble del Grupo VIII del sistema periódico (por ejemplo, platino, paladio) como catalizador.
Se utiliza soporte de espinela de litio y aluminio para mejorar el rendimiento del catalizador. Esta reacción se lleva a cabo a una temperatura de 80°C a 115°C y una presión de 1 a 60 bares (presión relativa).
Se añade hasta un 3% en peso de monoetilamina y/o dietilamina con respecto al acetonitrilo. Estos actúan como promotores, mejorando potencialmente la velocidad de reacción o la selectividad.
4. Usos de la trietilamina
El uso predominante de la trietilamina (TEA) es como catalizador en el curado de sistemas de resina dentro de moldes de fundición, particularmente en la producción de núcleos de arena para procesos de caja fría o isocure. El TÉ se vaporiza hasta convertirlo en gas y se introduce en el sistema.
Además de su papel en aplicaciones de fundición, el TEA encuentra un amplio uso como catalizador de curado en adhesivos para tableros de partículas de fenol-formaldehído, con un consumo anual de alrededor de 5 millones de libras en los EE. UU.
Además, se utiliza en la purificación de antibióticos de penicilina y cefalosporina y en el proceso de polimerización interfacial para la producción de resinas de policarbonato.
La trietilamina también se emplea como eliminador de HCl en reacciones, como durante la fabricación de ftalatos de bencilo, centrándose en la recuperación y el reciclaje.
El TEA sirve como ingrediente en pinturas selladoras (0,5% p/p), en la fabricación de adhesivos para papel y cartón, y como estabilizador para solventes clorados como percloroetileno y tricloroetileno.
Actúa como catalizador en la formación de espumas de uretano y resinas epoxi y participa en reacciones de deshidrohalogenación y neutralización de ácidos para reacciones de condensación. El TEA también encuentra aplicación en la cromatografía líquida de alta resolución (HPLC) de fase inversa como modificador de fase móvil.
En industrias específicas, el TEA se emplea como agente de neutralización para resinas aniónicas estabilizadas a base de agua, incluidos poliésteres, alquídicos, resinas acrílicas y poliuretanos que contienen grupos carboxilo u otros grupos ácidos.
Otros usos de la trietilamina incluyen su uso como activador acelerador para caucho, como inhibidor de la corrosión, como propulsor, como agente emulsionante para tintes, como ingrediente en aceleradores de revelado fotográfico, para secar tintas de impresión, en limpiadores de alfombras, en la producción. de herbicidas y pesticidas, y en la preparación de emulsionantes para pesticidas.
5. Toxicología de la trietilamina
1. Toxicidad aguda
- Inhalación: los voluntarios humanos expuestos a vapores de trietilamina experimentaron alteraciones visuales y cambios en la actividad cerebral. La exposición ocupacional también se ha relacionado con problemas oculares y respiratorios. Los estudios en animales revelan una toxicidad y mortalidad graves tras la inhalación de dosis altas, con valores de DL50 que oscilan entre 420 y 10.000 mg/m³ en ratas.
- Ingestión: La exposición oral en animales resultó en una toxicidad dependiente de la dosis, con valores de LD50 que oscilaron entre 450 y 1000 mg/kg en roedores. En los seres humanos, la trietilamina ingerida se excreta principalmente sin cambios, y una pequeña porción se metaboliza a óxido de trietilamina y dietilamina.
- Dérmica: La trietilamina muestra una irritación dérmica significativa en animales, con valores de LD50 de alrededor de 0,5 a 0,794 ml/kg en conejos.
2. Toxicidad crónica
- Inhalación: La exposición prolongada (meses) a concentraciones moderadas de trietilamina en ratas provocó alteraciones pulmonares, cerebrales y hepáticas. Se observaron cambios en el sistema nervioso, anemia e inflamación pulmonar crónica a niveles de exposición más altos.
- Oral: No se informaron efectos adversos en ratas a las que se les administró trietilamina por vía oral durante 2 meses en una dosis moderada. Sin embargo, dosis más altas provocaron cambios de comportamiento y convulsiones, y las mujeres mostraron una mayor sensibilidad.
- Genotoxicidad: los estudios in vitro e in vivo arrojaron resultados contradictorios con respecto a la genotoxicidad de la trietilamina. Si bien algunos ensayos sugirieron potencial mutagénico en bacterias, otros no mostraron efectos clastogénicos o aneugénicos en ratas.
3. Reproducción y Desarrollo
- Estudios reproductivos: un estudio multigeneracional en ratas no reveló ningún impacto significativo en la fertilidad o la viabilidad de la descendencia, aunque se observó una ligera reducción en el peso corporal promedio en la tercera generación.
- Toxicidad para el desarrollo: La administración de trietilamina a conejas preñadas interrumpió el desarrollo embrionario temprano.
4. Epidemiología humana
- Cáncer: un estudio realizado en una fundición danesa relacionó la exposición ocupacional a la trietilamina con un mayor riesgo de mortalidad por cáncer de vejiga.
- Sensibilización: Los estudios en animales sugieren un bajo potencial de sensibilización cutánea o respiratoria a la trietilamina.
5. Otras observaciones
- La trietilamina inhibe la actividad de la monoaminooxidasa (MAO) y la sulfotransferasa en los tejidos animales, lo que potencialmente afecta el metabolismo de los neurotransmisores y los esteroides.
- Los estudios in vitro sugieren que la trietilamina interactúa con la degradación y síntesis de proteínas celulares y puede inducir inflamación lisosomal.
Referencias
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
- Process for the preparation of triethylamine. – https://patents.google.com/patent/US4297512A/en
- Triethylamine; Review of Toxicological Literature
- Triethylamine. – https://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb12144e0013
- Triethylamine anhydrous(BASF). – https://products.basf.com/global/en/ci/triethylamine-anhydrous.html
