Procesos de producción de dióxido de titanio
El dióxido de titanio comercial se fabrica mediante dos métodos industriales distintos: el proceso del sulfato y el proceso del cloruro.
El proceso del sulfato, una técnica más antigua, comienza con la digestión de materias primas que contienen titanio, como la ilmenita o la escoria de titanio (→ artículo detallado sobre materias primas), en ácido sulfúrico concentrado. Esta reacción ocurre a 150–220 °C, produciendo un licor negro que contiene titanio disuelto, hierro y diversas impurezas.
La hidrólisis posterior de la solución de sulfato de titanilo precipita óxido de titanio hidratado relativamente puro (TiO(OH)2 o TiO2 dihidrato) y otras etapas de purificación eliminan las impurezas restantes. El oxihidrato de titanio se somete posteriormente a calcinación, molienda y, generalmente, a un recubrimiento con compuestos inorgánicos.
El proceso de cloruro implica la cloración de materias primas que contienen titanio, como ilmenita, leucoxeno, rutilo, escoria de titanio o anatasa, a temperaturas de entre 700 y 1200 °C. El tetracloruro de titanio resultante (TiCl4) se oxida a 900-1400 °C para formar dióxido de titanio, que posteriormente se muele y se recubre con compuestos inorgánicos.
Estos dos procesos se emplean exclusivamente para la producción de pigmentos de dióxido de titanio. Existen otros métodos de fabricación de TiO2 sin propiedades pigmentarias, principalmente para la síntesis de nanopartículas de dióxido de titanio. Algunos ejemplos incluyen la hidrólisis de alcoholatos de titanio o la reacción pirolítica de TiCl4 con agua (proceso aerosil).
Tabla de contenido
1. Producción de dióxido de titanio mediante el proceso de sulfato
La producción de dióxido de titanio mediante el proceso de sulfato implica varias etapas secuenciales, como se ilustra en la Figura 1.
1.1. Molienda
Las materias primas que contienen titanio se secan hasta alcanzar un contenido de humedad inferior al 0,1 % para evitar reacciones prematuras y calentamiento al mezclarlas con ácido sulfúrico. Posteriormente, se muelen en molinos de bolas o de cuencos para obtener un tamaño medio de partícula inferior a 40 μm.
1.2. Digestión
La digestión discontinua es el procedimiento estándar en el que las materias primas molidas (ilmenita, escoria de titanio o mezclas) se mezclan con H2SO4 al 80-98 %.
La reacción puede iniciarse añadiendo óleum al ácido sulfúrico al 80 % o añadiendo agua o vapor a la suspensión de la materia prima en ácido sulfúrico concentrado. En ambos casos, la entalpía de mezcla desencadena una digestión química exotérmica que alcanza una temperatura máxima de aproximadamente 200 °C o superior.
La proporción de H2SO4 a materia prima se ajusta para obtener una proporción de 1,8 a 2,2 en peso de ácido sulfúrico a dióxido de titanio en el licor negro resultante (índice de acidez).
La reacción en el recipiente de digestión (f) comienza con la adición de agua, ácido sulfúrico diluido, óleum o vapor. El calor de hidratación del ácido provoca un aumento inicial de la temperatura a 50-70 °C. La posterior formación exotérmica de sulfato eleva la temperatura a 170-220 °C.
El agua añadida y generada por la reacción se evapora completamente para formar un residuo de digestión sólida. Puede requerirse calentamiento externo para el ácido diluido o materias primas poco solubles.
Tras alcanzar la temperatura máxima, la mezcla de reacción sólida requiere de 1 a 12 horas de maduración, cuya duración depende de la materia prima. La maduración maximiza la solubilidad de los componentes que contienen titanio. La agitación con aire durante el aumento de temperatura influye positivamente en el rendimiento de la digestión.
Existen procesos de digestión continua. Un método establecido consiste en la alimentación continua de una mezcla de ilmenita y agua con ácido sulfúrico a un transportador de tornillo de doble paleta. Tras un corto tiempo de residencia (menos de 1 hora), se forma un residuo desmenuzable. Este proceso es adecuado para materias primas altamente reactivas.
1.3. Redigestión
Debido al alto coste de las materias primas titaníferas, se ha intentado reutilizar los residuos sólidos de la digestión (que contienen entre un 40 % y un 65 % de dióxido de titanio). Históricamente, estos avances no se han implementado a gran escala debido a la complejidad y el alto coste de los equipos o las condiciones de procesamiento.
En 2001 se propuso un proceso de redigestión con equipos y tecnología estándar.
1.4. Disolución y reducción
El residuo de digestión se disuelve en agua fría o ácido diluido reciclado a una temperatura inferior a 85 °C para evitar la hidrólisis prematura, especialmente con productos de ilmenita. Se introduce aire para agitar durante la disolución. Con ilmenita, la concentración de la solución de dióxido de titanio es del 8 al 12 % en peso, y con escoria, del 13 al 18 % en peso.
El hierro trivalente (Fe3+) se hidroliza junto con compuestos de titanio y se adhiere al hidrato de óxido de titanio. Por lo tanto, todo el Fe3+ debe reducirse a Fe2+ utilizando chatarra de hierro durante la disolución de la ilmenita o en un paso posterior.
Para evitar la reoxidación del hierro durante el procesamiento posterior, se mantiene una pequeña cantidad de Ti3+ hasta que se complete la hidrólisis. El Ti3+ se forma utilizando el exceso de chatarra de hierro durante la reducción de Fe3+. El Ti4+ también puede reducirse parcialmente a Ti3+ en condiciones optimizadas. Esta solución concentrada de Ti3+ se añade posteriormente a la solución de reacción principal.
Las soluciones obtenidas a partir de escoria de titanio ya contienen mayores cantidades de Ti3+, que deben reducirse mediante oxidación con oxígeno atmosférico para evitar pérdidas de rendimiento durante la hidrólisis. El Ti3+ presente en la digestión de la escoria reduce parcialmente el ácido sulfúrico a SO2 o H2S, lo que requiere una limpieza exhaustiva de los gases de escape, especialmente si la escoria contiene metales pesados.
Es posible la digestión mixta de escoria de ilmenita y titanio, en la que el Ti3+ de la escoria reduce todo el Fe3+ a Fe2+. Esto también puede lograrse mezclando los productos disueltos de las digestiones separadas de ilmenita y escoria de titanio.
1.5. Clarificación
Todo el material sólido no disuelto debe eliminarse completamente de la solución para evitar la contaminación del hidrolizado. El método más económico consiste en la sedimentación preliminar en un espesador (g), seguida de la filtración del sedimento mediante un filtro de tambor rotatorio al vacío (h) o un filtro prensa.
El sobrenadante del espesador también se pasa a través de filtros prensa (i) para eliminar los finos residuales. Debido a sus deficientes propiedades de filtrado, el filtro rotatorio suele funcionar como filtro de precapa. La adición de productos químicos puede promover la floculación y la sedimentación de los finos en el espesador.
También se ha propuesto la clarificación en una sola etapa mediante filtros prensa automatizados.
1.6. Cristalización
Tras la reducción del Fe3+, las soluciones de la digestión de escoria contienen entre un 5 y un 6 % en peso de FeSO4 y las de la digestión de ilmenita, entre un 16 y un 20 % en peso de FeSO4. Las soluciones de ilmenita se enfrían al vacío para cristalizar y separar el FeSO4·7 H2O (copperas) (j) para reducir el FeSO4 que se descarga con el ácido residual tras la hidrólisis. Esto aumenta la concentración de dióxido de titanio en la solución en aproximadamente un 25 %.
La sal de cobre se separa por filtración o centrifugación (k).
El sulfato de hierro se utiliza principalmente en la purificación de agua, como agente reductor de cromato para cemento y como materia prima para pigmentos de óxido de hierro. También puede deshidratarse para formar FeSO4·H2O o descomponerse térmicamente en óxido de hierro(III) y dióxido de azufre.
1.7. Hidrólisis
El hidrato de óxido de titanio se precipita por hidrólisis a 94-110 °C. Otros componentes de la materia prima solubles en ácido sulfúrico, principalmente el niobio como hidrato de óxido, precipitan simultáneamente. La hidrólisis se lleva a cabo en tanques agitados revestidos de ladrillo (n) con inyección de vapor. El hidrolizado resultante carece de propiedades pigmentarias.
Las propiedades del hidrolizado se ven significativamente influenciadas por el grado de floculación de las partículas primarias. El tamaño de partícula primaria del hidrolizado es de aproximadamente 5 nm, mientras que el tamaño de partícula del pigmento TiO2 es de 200-300 nm. Diversos factores afectan las propiedades del hidrolizado:
1. La hidrólisis de soluciones concentradas de sulfato de titanio (170-230 g de TiO2/L) es lenta e incompleta sin núcleos adecuados, lo que acelera la hidrólisis. Los núcleos se producen principalmente mediante el método de Mecklenburg o Blumenfeld.
En el método de Mecklenburg, el hidrato de óxido de titanio coloidal se precipita con hidróxido de sodio a 100 °C. El 1 % de este hidrato se utiliza como material de siembra.
En el método de Blumenfeld, una pequeña porción de la solución de sulfato se hidroliza en agua hirviendo y luego se añade a la solución a granel. El número de núcleos influye en el tamaño de las partículas del hidrolizado y en las características de floculación.
2. El tamaño de las partículas del hidrolizado y el grado de floculación también dependen de la intensidad de la agitación durante la formación de los núcleos de Blumenfeld y la etapa inicial de hidrólisis.
3. La concentración de sulfato de titanio afecta considerablemente la floculación del hidrolizado y se ajusta mediante evaporación al vacío, si es necesario, a 170-230 g/L de dióxido de titanio durante la hidrólisis. Concentraciones más bajas dan lugar a floculados más gruesos.
4. El índice de acidez debe estar entre 1,8 y 2,2. Este influye significativamente en el rendimiento de TiO2, el tamaño de las partículas del hidrolizado y el tamaño del floculado. Un índice de acidez elevado produce un menor rendimiento y un hidrolizado más grueso. Un período de hidrólisis normal (3-6 horas) produce entre un 93 % y un 96 % de dióxido de titanio.
Otras concentraciones de sales, especialmente FeSO4, afectan las propiedades del hidrolizado. Las concentraciones altas suelen dar lugar a floculados más finos.
5. La temperatura influye principalmente en el rendimiento volumen-tiempo y la pureza del hidrolizado.
La estructura del hidrolizado es compleja. Las partículas primarias de anatasa nanocristalina presentan un tamaño aproximado de 5-6 nm (micrografías electrónicas, datos de superficie BET). Las determinaciones convencionales del tamaño de partícula (p. ej., dispersión láser) muestran valores de cientos a miles de nanómetros, dependiendo de la intensidad de la dispersión.
Las partículas primarias se agregan en partículas secundarias de aproximadamente 30 nm (Figura 3). Estas partículas secundarias forman estructuras terciarias de aproximadamente 1 μm de tamaño. Las estructuras terciarias posteriormente forman estructuras cuaternarias de unos pocos micrómetros.
La molienda o la dispersión ultrasónica de alta intensidad pueden descomponer las estructuras cuaternarias. Una energía de dispersión suficiente puede descomponer parcialmente las estructuras terciarias.
Durante la calcinación, se producen transformaciones morfológicas:
- A 300–600 °C, las partículas primarias se sinterizan. Las partículas secundarias anteriores forman nuevas partículas primarias de anatasa cristalina, de aproximadamente 20 nm de tamaño. Este es un tamaño típico para el dióxido de titanio catalítico.
- A 800–1000 °C, las partículas de 20 nm se sinterizan. Las partículas terciarias originales forman nuevas partículas primarias de rutilo cristalino o anatasa, de aproximadamente 200 nm de tamaño. Este es un tamaño típico para el dióxido de titanio pigmentario. Las estructuras cuaternarias originales forman aglomerados de partículas de pigmento, que se separan mediante molienda.
1.8. Purificación del hidrolizado
Tras la hidrólisis, la fase líquida contiene entre un 20 % y un 28 % de ácido sulfúrico y cantidades variables de sulfatos disueltos según la materia prima. El hidrato de óxido de titanio se separa de la solución mediante filtración y se lava con agua o ácido diluido. Incluso con el lavado ácido, quedan demasiados iones de metales pesados adsorbidos en el hidrato de óxido de titanio para la producción de pigmento blanco.
La mayoría de las impurezas se pueden eliminar mediante reducción (blanqueo). El residuo de filtración se mezcla con un 3 % y un 10 % de ácido diluido a 50-90 °C y luego se mezcla con polvo de zinc o aluminio (q). También se pueden utilizar agentes reductores no metálicos (p. ej., HOCH2–SO2Na) para el blanqueo.
Tras una segunda filtración y lavado, el hidrato de óxido de titanio presenta bajas concentraciones de impurezas coloreadas. Sin embargo, aún contiene entre un 5 % y un 10 % de ácido sulfúrico quimisorbido, que no se puede eliminar por completo mediante el lavado. Se elimina mediante calentamiento a alta temperatura.
1.9. Dopaje del hidrato
Para producir dióxido de titanio de alta pureza, el hidrato de óxido de titanio se calcina sin adiciones para obtener un grado de TiO2 relativamente grueso con un contenido de rutilo que depende de la temperatura de calentamiento. Para producir grados específicos de pigmento, el hidrato de óxido de titanio debe tratarse con compuestos de metales alcalinos y ácido fosfórico antes de la calcinación (r).
Los pigmentos de anatasa contienen más ácido fosfórico que los pigmentos de rutilo. En el caso de los pigmentos de rutilo, se añaden núcleos de rutilo (menos del 10 %, típicamente entre el 1 % y el 5 %). Se añaden ZnO, Al2O3 y/o Sb2O3 (menos del 3%) para estabilizar la estructura cristalina.
Los núcleos (o núcleos de rutilo) se producen convirtiendo el hidrato de óxido de titanio purificado en titanato de sodio, el cual se elimina del sulfato y se trata con ácido clorhídrico. Los núcleos de rutilo también pueden prepararse mediante precipitación de soluciones de tetracloruro de titanio con solución de hidróxido de sodio.
1.10. Calcinación
El hidrato de óxido de titanio dopado se filtra mediante filtros rotatorios de vacío o prensas de filtro para eliminar el agua. Los filtros rotativos de vacío alcanzan aproximadamente un 30-40 % de contenido de sólidos de TiO2. Los filtros rotativos de presión o los filtros prensa automáticos producen un contenido de TiO2 de aproximadamente el 50 % o superior.
La calcinación se realiza en hornos rotativos (t), que se calientan directamente con gas o aceite en flujo a contracorriente. Aproximadamente dos tercios del tiempo total de residencia (4-20 horas) se destinan al secado del material. Por encima de aproximadamente 500 °C, el trióxido de azufre se elimina y se descompone parcialmente en dióxido de azufre y oxígeno a temperaturas más altas.
El producto alcanza una temperatura máxima de 800-1100 °C, dependiendo del tipo de pigmento, el rendimiento y el perfil de temperatura del horno. El contenido de rutilo, el tamaño de partícula, la distribución del tamaño y la formación de agregados son muy sensibles a las condiciones de funcionamiento del horno.
Tras salir del horno, el clínker puede enfriarse indirectamente o directamente con aire en enfriadores de tambor (u). La temperatura de salida de los gases de escape del horno debe superar los 300 °C para evitar la condensación de ácido sulfúrico en las tuberías.
Se puede conservar energía recirculando parte del gas a la cámara de combustión del horno. Este gas puede mezclarse con gases combustibles como reemplazo parcial del aire o utilizarse para concentrar el ácido diluido. Posteriormente, el gas se transmite al sistema de purificación de gases residuales.
1.11. Molienda
Los aglomerados y agregados del clínker se reducen a finura pigmentaria mediante molienda húmeda o seca. La reducción de tamaño grueso debe realizarse en molinos de martillos (molinos Raymond) o de rodillos antes de la molienda húmeda en molinos de bolas o de arena (con la adición de un agente dispersante).
La fracción gruesa puede eliminarse de la suspensión mediante centrifugación o hidrociclones y reciclarse a los molinos. Los molinos de martillos, de paletas cruzadas, de rodillos y, en particular, los molinos pendulares y de chorro de vapor son adecuados para la molienda seca.
Se pueden utilizar aditivos de molienda especiales como agentes humectantes durante el tratamiento posterior del pigmento o para mejorar la dispersabilidad del pigmento sin tratar.
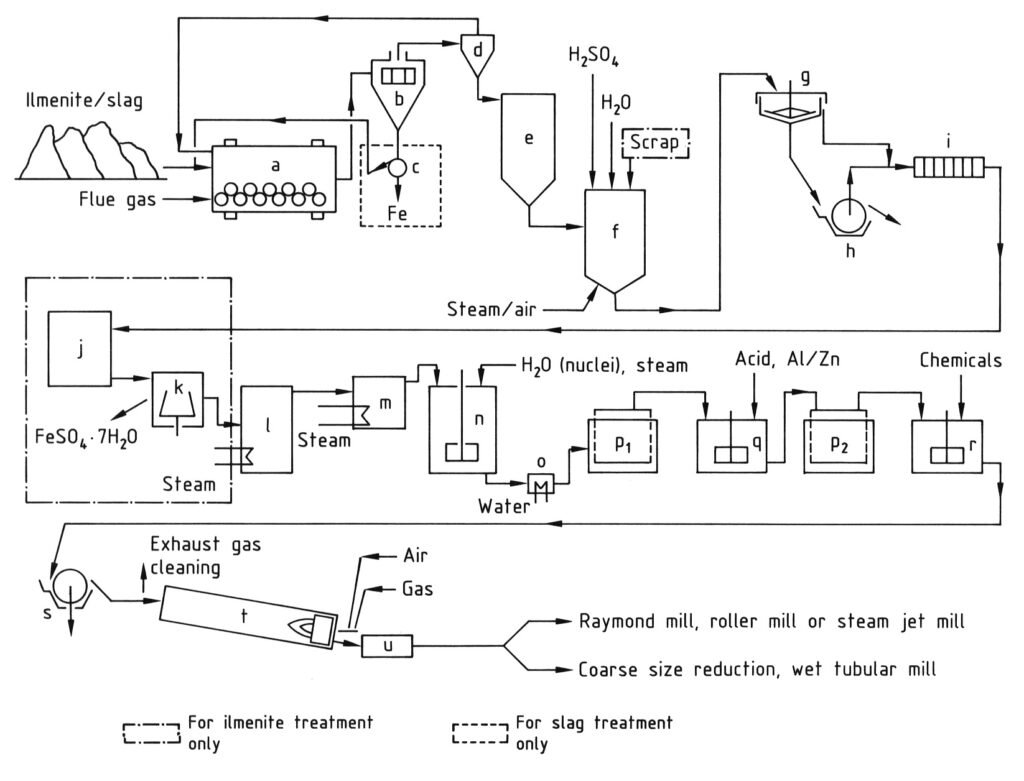
a) Molino de bolas/secador; b) Tamiz; c) Separador magnético; d) Ciclón; e) Silo; f) Recipiente de digestión; g) Espesador; h) Filtro rotatorio; i) Filtro prensa; j) Cristalizador; k) Centrífuga; l) Evaporador al vacío; m) Precalentador; n) Tanque agitado para hidrólisis; o) Enfriador; p) Filtros Moore; q) Tanque agitado para blanqueo; r) Tanque agitado para dopaje; s) Filtro rotatorio para deshidratación; t) Horno rotatorio; u) Enfriador.
2. Producción de dióxido de titanio mediante el proceso de cloruro
La producción de pigmento de dióxido de titanio mediante el proceso de cloruro se ilustra en la Figura 2.
2.1. Cloración
El titanio presente en las materias primas se convierte en tetracloruro de titanio en una atmósfera reductora. Se utiliza coque de petróleo calcinado con un contenido extremadamente bajo de cenizas como agente reductor. Debido a su bajo contenido de volátiles, la formación de HCl es mínima. El dióxido de titanio reacciona exotérmicamente según la siguiente ecuación:
TiO2 + 2 Cl2 + C → TiCl4 + CO2
A medida que aumenta la temperatura, se produce una reacción endotérmica entre el dióxido de carbono y el carbono para formar monóxido de carbono. Es necesario añadir oxígeno junto con el cloro para mantener la temperatura de reacción entre 800 y 1200 °C. El consumo de coque es de 250 a 300 kg por tonelada de dióxido de titanio. Si se utiliza cloro con CO2 procedente de la combustión de TiCl3, el consumo de coque aumenta a 350-450 kg.
La cloración de lecho fijo, más antigua, está obsoleta. En este proceso, la materia prima de titanio molida se mezcla con coque de petróleo y un aglutinante. Se forman briquetas. La cloración se realiza a 700-900 °C en reactores revestidos de ladrillos.
La cloración de lecho fluidizado comenzó en 1950. La materia prima de titanio (con un tamaño de partícula similar a la arena) y el coque de petróleo (con un tamaño de partícula medio aproximadamente cinco veces superior al del dióxido de titanio) reaccionan con el cloro y el oxígeno. Esto ocurre en un reactor de lecho fluidizado revestido de ladrillos a 800-1200 °C.
La materia prima debe estar muy seca para evitar la formación de HCl. La conversión de cloro es del 98-100 %. La conversión de titanio en la materia prima es del 95-100 %. La eficiencia de este proceso depende del diseño del reactor y de la velocidad del gas. Las pérdidas se deben principalmente al arrastre de polvo.
El cloruro de magnesio y el cloruro de calcio pueden acumularse en el reactor de lecho fluidizado debido a su baja volatilidad. El dióxido de silicio y el silicato de circonio también se acumulan debido a su lentitud en la cloración a las temperaturas del proceso. Todos los demás componentes de la materia prima se volatilizan como cloruros en los gases de reacción.
El revestimiento cerámico del reactor de lecho fluidizado es susceptible a la abrasión y la corrosión. Si se interrumpe la cloración, existe el riesgo de que las materias primas se sintericen, lo que puede impedir la fluidización posterior.
2.2. Enfriamiento de gases
Los gases de reacción se extinguen con TiCl4 líquido y el enfriamiento puede ser indirecto o directo (d).
Los cloruros de los demás componentes cristalizan y tienden a acumularse en las superficies de enfriamiento, en particular las grandes cantidades de cloruros de hierro(II) y hierro(III) formadas por la cloración de la ilmenita. En esta etapa inicial, los gases de reacción se enfrían por debajo de 300 °C para separar los cloruros presentes del TiCl4 mediante condensación o sublimación (e).
El gas contiene principalmente TiCl4. Se enfría por debajo de 0 °C para condensar la mayor parte del TiCl4 (f). Las pequeñas cantidades de TiCl4 y cloro que quedan en los gases de escape (CO2, CO y N2) se eliminan mediante depuración alcalina (t).
2.3. Purificación de TiCl4
Los cloruros sólidos y el polvo arrastrado se separan del TiCl4 mediante evaporación simple (destilación) (j). El cloro disuelto se elimina mediante calentamiento o reducción con polvos metálicos (Fe, Cu o Sn).
La eliminación del tetracloruro de vanadio y del oxicloruro de vanadio del TiCl4 mediante destilación es más compleja porque sus puntos de ebullición son muy cercanos. Por lo tanto, se reducen para formar cloruros de vanadio sólidos de baja valencia (i).
Se han recomendado numerosos agentes reductores. Los ejemplos incluyen cobre, tricloruro de titanio, sulfuro de hidrógeno, hidrocarburos, jabones, ácidos grasos y aminas. Tras la evaporación (j), el cloruro de titanio debe contener menos de 5 ppm de vanadio. El fosgeno y el SiCl4 pueden eliminarse mediante destilación fraccionada.
2.4. Oxidación de TiCl4 y recuperación de TiO2
El pigmento de dióxido de titanio y el cloro se forman mediante la reacción del tetracloruro de titanio con oxígeno a 900-1400 °C. El TiCl4 purificado se vaporiza (k) y el vapor se calienta indirectamente a aproximadamente 500-1000 °C (l).
TiCl4 + O2 → 2 Cl2 + TiO2
Esta reacción es moderadamente exotérmica y requiere una temperatura de reacción elevada. Por lo tanto, el oxígeno debe calentarse a más de 1000 °C (m) mediante una llama de plasma eléctrica, haciendo reaccionar parte del oxígeno con monóxido de carbono u otro combustible.
El TiCl4 caliente y el oxígeno caliente (110-150 % de la cantidad estequiométrica) se introducen por separado en una cámara de reacción. Deben mezclarse rápida y completamente para garantizar una alta velocidad de reacción. Se han propuesto y utilizado numerosos diseños de reactores.
Consideraciones similares se aplican a la unidad de enfriamiento (o). El pigmento debe enfriarse rápidamente por debajo de los 600 °C mediante zonas de enfriamiento de diversas geometrías. La adherencia del material a las paredes suele evitarse añadiendo partículas abrasivas como arena, partículas gruesas de TiO2, cloruro de sodio u otros materiales.
En la producción de dióxido de titanio mediante el proceso de cloruro, el diseño del reactor de oxidación y los materiales adecuados, junto con los parámetros de procesamiento, son los aspectos más importantes. Numerosas patentes demuestran amplios esfuerzos de optimización para esta etapa del proceso. Solo unas pocas empresas poseen el conocimiento a escala industrial para este proceso.
La mezcla de reacción, compuesta por gases (Cl2, O2, CO2) y pigmento de dióxido de titanio, puede enfriarse aún más durante la separación de partículas sólidas del pigmento, ya sea indirecta o directamente (p). El TiO2 se separa de la corriente de gas mediante separación por gravedad, ciclones, filtros o una combinación de dispositivos.
La corriente de gas se recicla a la zona de enfriamiento (o) del reactor de oxidación y al proceso de cloración. Se recicla como cloro oxigenado a través de la unidad de licuefacción (u) o directamente como gas. El cloro adsorbido en el pigmento de dióxido de titanio puede eliminarse mediante calentamiento, purga con nitrógeno o aire, o tratamiento químico húmedo.
La separación húmeda mediante temple de la mezcla de gases que contiene pigmento (Cl2, O2 y CO2) en agua no se ha aplicado a gran escala.
La calidad del pigmento de dióxido de titanio (tamaño y distribución del tamaño de partícula) depende de la temperatura de reacción, los aditivos, el exceso de oxígeno y las condiciones reológicas del reactor. Se deben establecer condiciones sofisticadas para cada reactor.
La presencia de agua o compuestos alcalinos durante la combustión de TiCl4 genera núcleos que promueven la formación controlada de partículas de pigmento finamente divididas con alto poder de dispersión. Los aditivos pueden añadirse directamente al oxígeno o producirse mediante la combustión de materiales que contienen hidrógeno.
La presencia de cloruro de aluminio promueve la formación de rutilo y una división más fina del pigmento. Se añade en cantidades de 0,2 a 2,0 % en peso. La adición de PCl3 y SiCl4 suprime la formación de rutilo, lo que produce pigmento anatasa. Sin embargo, este tipo de pigmento no ha demostrado ser relevante para el proceso de cloruro.
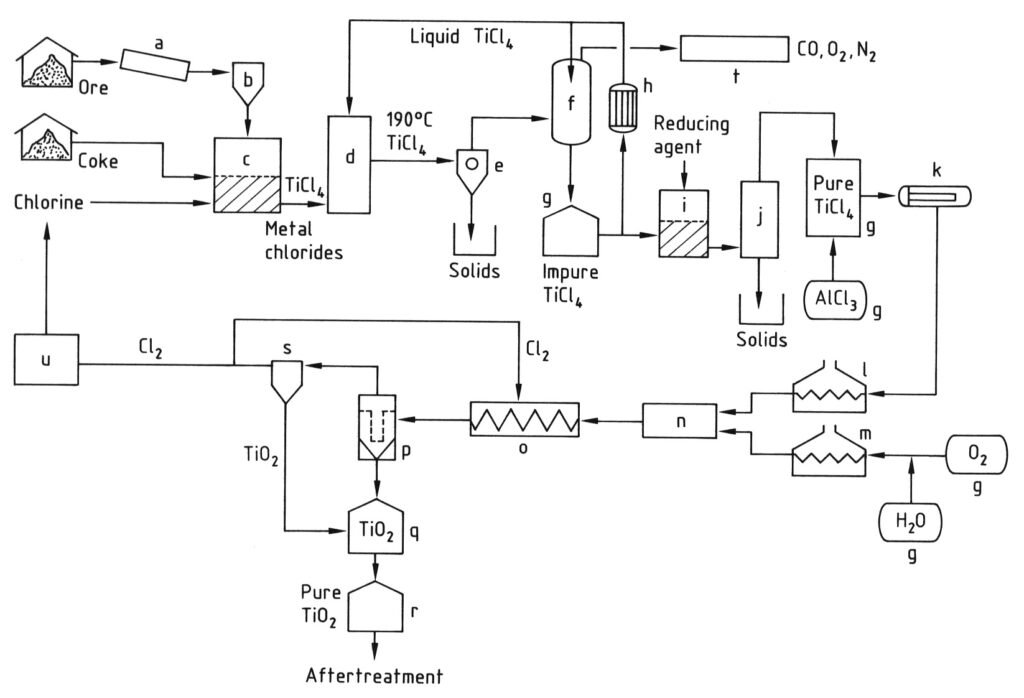
a) Molino; b) Silo; c) Reactor de lecho fluidizado; d) Torre de enfriamiento; e) Separación de cloruros metálicos; f) condensación de TiCl4; g) Tanque; h) Enfriador; i) Reducción de vanadio; j) Destilación; k) Evaporador; l) sobrecalentador de TiCl4; m) Sobrecalentador de O2; n) Quemador; o) Serpentín de enfriamiento; p) Filtro; q) Purificación de TiO2; r) Silo; s) Purificación de gases; t) Limpieza de gases residuales; u) Licuefacción de Cl2
3. Proceso de cloruro vs. Proceso de sulfato para la producción de dióxido de titanio
La capacidad de producción global de dióxido de titanio se divide prácticamente entre los dos procesos principales. Actualmente, el proceso de sulfato representa aproximadamente el 47% de la capacidad, mientras que el proceso de cloruro representa alrededor del 53%.
Las cifras reales de producción y ventas son más favorables al proceso de cloruro, ya que algunas plantas de sulfato, especialmente en China, operan por debajo de su capacidad máxima. La clara tendencia al alza del proceso de cloruro, que alcanzó un máximo cercano al 57% en 1996, se ha estancado recientemente debido al aumento significativo de la capacidad de nuevos procesos de sulfato en China.
Los pigmentos de TiO2 producidos mediante el proceso de cloruro generalmente presentan un brillo superior y una masa más neutra en comparación con el proceso de sulfato. Suelen tener un mayor poder de dispersión y una mayor durabilidad. Sin embargo, para muchas aplicaciones, estos dos tipos de pigmentos son intercambiables.
En ciertos usos, como en fibras y tintas de impresión, los pigmentos de sulfato pueden ofrecer propiedades superiores. Esto se atribuye a menudo a su naturaleza menos abrasiva. Los pigmentos de dióxido de titanio para aplicaciones exigentes casi siempre se someten a un postratamiento inorgánico.
Los pigmentos de anatasa y los dióxidos de titanio técnicos, que requieren la modificación con anatasa, incluyendo aquellos para catalizadores, nanopartículas cosméticas, usos fotocatalíticos y electrocerámica, se producen exclusivamente mediante el proceso de sulfato.
El proceso de cloruro suele considerarse de menor impacto ambiental. Esta evaluación se centra en el volumen de residuos in situ generados por la planta de dióxido de titanio, excluyendo los residuos procedentes de la mejora de la materia prima.
Algunas importantes plantas de sulfato han logrado un reciclaje completo de ácidos débiles, y la mayoría o la totalidad de los subproductos que contienen hierro se venden o procesan. En cambio, los residuos de muchas plantas de cloruro todavía se eliminan en vertederos o pozos profundos.
| Clase de pigmento | TiO2 (mín.), % en peso | Sales solubles en agua, % en peso | Volátiles (máx.), % en peso |
|---|---|---|---|
| Anatasa A 1 (Tipo A) | 98 | 0,6 | 0,5 |
| Anatasa A 2 | 92 | 0,5 | 0,8 |
| Rutilo R 1 (Tipo R) | 97 | 0.6 | 0.5 |
| Rutilo R 2 | 90 | 0.5 | 1.5 |
| Rutilo R 3 | 80 | * | * |
4. Gestión de Residuos en la Producción de Dióxido de Titanio
4.1. Residuos Acuosos
El proceso de sulfato consume de 2,4 a 3,5 toneladas de ácido sulfúrico concentrado por tonelada de dióxido de titanio producida, dependiendo de la materia prima. Durante el procesamiento, parte del ácido sulfúrico se convierte en sulfatos, principalmente sulfato de hierro(II). El ácido sulfúrico restante se obtiene como ácido sulfúrico libre (ácido débil).
La filtración fraccionada y el lavado de la suspensión de hidrolizado producen entre un 70 % y un 95 % en peso de SO42- en una fracción de ácido débil, que contiene aproximadamente entre un 20 % y un 25 % de ácido libre. El 5 % y el 30 % restante de sulfato se diluye considerablemente con agua de lavado.
Históricamente, el vertido directo de ácido en aguas abiertas o costeras era una práctica común. El problema del ácido débil generó una importante controversia política. En consecuencia, la Comunidad Europea ordenó el cese del vertido de ácidos débiles en aguas abiertas para 1993.
Los productores europeos de dióxido de titanio desarrollaron diversos procesos de tratamiento de efluentes para cumplir con la normativa ambiental. Los procesos clave incluyen la precipitación de yeso a partir de ácidos débiles y la concentración/recuperación de ácido libre y ligado.
En el proceso de elaboración de yeso, el efluente ácido se trata inicialmente con CaCO3 finamente dividido para precipitar yeso blanco. Este yeso blanco se filtra, se lava y se seca. Posteriormente, se utiliza para la fabricación de placas de yeso. En una segunda etapa, los sulfatos metálicos residuales del filtrado se precipitan como hidróxidos metálicos junto con yeso adicional mediante la adición de hidróxido de calcio. Esta mezcla, denominada yeso rojo, debe depositarse en vertederos.
También se ha sugerido la producción de pigmentos de óxido de hierro a partir de una solución de sulfato de hierro, obtenida tras la neutralización parcial de ácidos débiles con CaCO3 o hierro metálico.
En el proceso de reciclaje, tanto el ácido sulfúrico libre como el ligado (en forma de sulfatos metálicos) pueden recuperarse del ácido débil mediante concentración y craqueo térmico en un horno de lecho fluidizado (k, Figura 3). El proceso consta de dos etapas:
- Concentración y recuperación del ácido libre por evaporación.
- Separación y descomposición térmica de los sulfatos metálicos, y producción de ácido sulfúrico a partir del dióxido de azufre resultante.
Debido a los requisitos energéticos, solo el ácido con más del 20 % de ácido sulfúrico es económicamente recuperable por evaporación. El ácido débil se concentra desde aproximadamente el 20-25 % hasta aproximadamente el 28 % con un consumo mínimo de calor, aprovechando el calor residual de la producción de ácido sulfúrico del proceso de contacto o de los gases residuales del horno de calcinación de dióxido de titanio.
Tras la evaporación preliminar, se produce una mayor concentración en evaporadores de vacío. La presión de vapor de agua disminuye considerablemente al aumentar la concentración de H2SO4. La evaporación produce una suspensión de sulfatos metálicos en ácido sulfúrico al 60-70 % (etapa 1 en la Figura 3).
La suspensión se enfría a 40-60 °C en una serie de tanques agitados (etapa 2, d) para obtener un producto con buenas propiedades de filtración y un ácido apto para su reciclaje en el proceso de digestión. La filtración (etapa 3, e) se realiza habitualmente con filtros de presión para obtener un residuo de filtración con bajo contenido de líquido residual.
Los requisitos de concentración del ácido reciclado en el proceso de digestión dependen de la calidad de la materia prima con alto contenido de titanio. Para materias primas con alto contenido de titanio, el ácido sulfúrico al 65-70 % separado de los sulfatos metálicos debe concentrarse aún más hasta alcanzar un ácido al 80-87 % (etapa 5).
La concentración puede realizarse en evaporadores de vacío calentados con vapor. Como alternativa, se puede utilizar el calor de los hornos de calcinación de dióxido de titanio. El enfriamiento del ácido tras este proceso de concentración produce una suspensión de sulfato metálico en ácido sulfúrico. Este ácido puede utilizarse directamente para la digestión de la materia prima.
Los sulfatos metálicos recuperados y separados del ácido sulfúrico en la etapa 3 (generalmente mediante filtración, por lo que se denominan «sal de filtración») contienen aproximadamente entre un 15 % y un 30 % de ácido sulfúrico con una concentración del 60 % al 70 %. Pueden convertirse en un material desechable mediante la reacción con compuestos de calcio.
La descomposición térmica de los sulfatos metálicos para formar óxidos metálicos, dióxido de azufre, agua y oxígeno consume mucha energía. Sin embargo, es ecológicamente ventajosa. El requerimiento energético es de aproximadamente 4 × 109 J por tonelada de residuo de filtración. La descomposición térmica se produce a 850–1100 °C en un horno de lecho fluidizado (etapa 6).
La energía se obtiene del carbón, las piritas o el azufre. El dióxido de azufre formado durante la descomposición térmica se purifica mediante métodos estándar, se seca y se convierte en ácido sulfúrico u óleum. Este ácido u óleum puro se mezcla con el ácido sulfúrico recuperado y se utiliza en el proceso de digestión.
Los óxidos metálicos producidos por descomposición térmica contienen todos los elementos presentes inicialmente en la materia prima, excepto el titanio convertido en pigmento. Esta mezcla de óxidos metálicos, principalmente óxido de hierro, puede utilizarse como aditivo en materiales de construcción o en la industria del cemento.
La creciente demanda de procesos industriales respetuosos con el medio ambiente ha impulsado el desarrollo de técnicas que permiten reciclar entre el 5 % y el 30 % de sulfato remanente en el agua ácida de lavado. Los procesos modernos permiten recuperar y reutilizar hasta el 99 % del ácido sulfúrico en la producción.
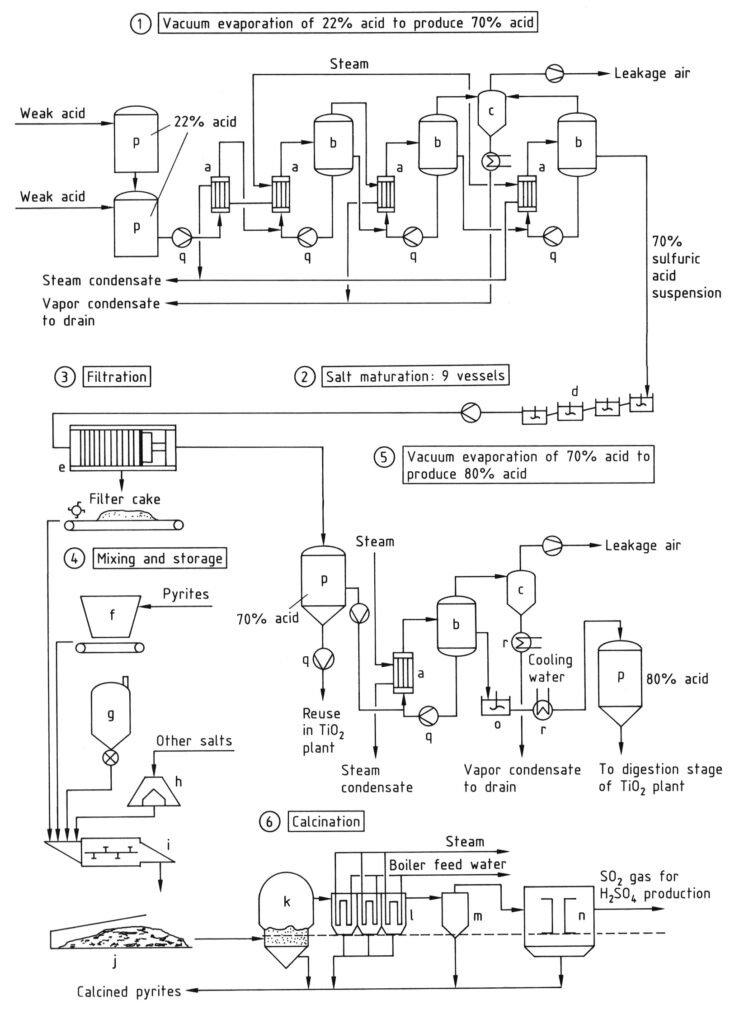
a) Intercambiador de calor; b) Evaporador; c) Condensador de inyección; d) Recipientes de maduración de sales agitadas; e) Filtro prensa; f) Búnker para piritas; g) Silo de carbón; h) Búnker; i) Unidad de tornillo mezclador; j) Depósito cubierto para residuo de filtración mixta; k) Horno de calcinación; l) Caldera de recuperación de calor; m) Ciclón; n) Precipitador electrostático; o) Tanque agitado; p) Tanque de almacenamiento; q) Bomba; r) Enfriador.
4.2. Residuos sólidos
Los residuos sólidos de la reacción de digestión suelen eliminarse tras la neutralización. En la década de 1990, estos residuos comenzaron a utilizarse como fuente de titanio en altos hornos para estabilizar el revestimiento interior y prolongar su vida útil. Otros usos potenciales incluyen relleno asfáltico (en sustitución de la piedra caliza), recubrimiento de vertederos o material de construcción. También se han sugerido algunas aplicaciones como abrasivo.
El sulfato de hierro heptahidratado (FeSO4·7 H2O, cobre as), obtenido mediante la cristalización y separación de licor negro o ácido débil, se utiliza principalmente para la purificación de agua, el tratamiento de aguas residuales y como materia prima para pigmentos de óxido de hierro.
Desde 1980 en Escandinavia, el FeSO4·7 H2O se ha utilizado como agente reductor de cromato en el cemento. El FeSO4·H2O, monohidrato (procedente del secado térmico de heptahidrato), no ha encontrado un uso importante debido a su bajo rendimiento y coste.
Los sulfatos metálicos (sales de filtración) recuperados por filtración de ácidos débiles tras su concentración (componente principal: sulfato de hierro(II) en forma pura de monohidrato) se utilizaron durante muchos años en la fabricación de fertilizantes, el craqueo térmico para la producción de ácido sulfúrico o se desechaban en vertederos.
La sal de filtración se propuso inicialmente como agente reductor de cromato en 2003. Posteriormente, los principales fabricantes europeos de dióxido de titanio investigaron y presentaron numerosas patentes sobre diversos aspectos del uso de derivados de sales de filtración como agentes reductores de cromato.
La sal de filtración ha demostrado propiedades superiores, como reología, resistencia al calor y estabilidad a largo plazo, y puede aplicarse directamente en molinos de cemento. Por lo tanto, se utilizan cantidades cada vez mayores de sal de filtración tratada (por ejemplo, neutralizada con piedra caliza) en la industria del cemento como agente reductor de Cr6+.
Estos avances, junto con la creciente demanda de agentes reductores de cromato para cemento debido a los cambios en la legislación de la UE de 2005, transformaron los residuos de sulfato de hierro, que pasaron de ser un material indeseado a un producto comercial.
En el proceso de cloruro, pueden surgir problemas con las aguas residuales, especialmente si la materia prima contiene menos del 90 % de dióxido de titanio. Los subproductos de cloruro metálico a veces se eliminan en solución mediante inyección en pozos profundos.
Las soluciones de cloruro metálico se bombean a través de pozos profundos hacia estratos geológicos porosos. Se requieren formaciones geológicas especiales para evitar la contaminación de las aguas subterráneas por impurezas.
El proceso de cloruro también está sujeto a restricciones cada vez mayores. Se han realizado esfuerzos para utilizar el subproducto de cloruro de hierro, por ejemplo, en el tratamiento de aguas y como agente de floculación. Se ha propuesto un proceso en el que los cloruros metálicos se tratan con cemento y compuestos alcalinos para producir áridos similares a la roca para la construcción de carreteras.
Otro método consiste en convertir el cloruro de hierro en óxido de hierro mediante el proceso Ruthner, con recuperación de ácido clorhídrico. Hasta hace poco, muchas plantas de procesamiento de cloruros debían neutralizar sus cloruros metálicos residuales, y posteriormente eliminar el hidróxido de hierro resultante.
4.3. Gases residuales
Los gases del horno de calcinación se enfrían en un intercambiador de calor. El pigmento de dióxido de titanio arrastrado se elimina, se lava y se recicla al proceso. El SO2 y el SO3 formados durante la calcinación pueden entonces depurarse de los gases para formar ácido sulfúrico diluido, que se recicla.
Referencias
- Pigments, Inorganic, 2. White Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n01.pub2
- Production of titanium dioxide. – https://ena-norm.eu/wp-content/uploads/2024/04/V.pl_.3.pdf
- A new method for production of titanium dioxide pigment. – https://www.sciencedirect.com/science/article/abs/pii/S0304386X12002423
- A Review of the Production Cycle of Titanium Dioxide Pigment. – https://www.scirp.org/journal/paperinformation?paperid=46456
- Titanium Dioxide. – https://www.ncbi.nlm.nih.gov/books/NBK524874/
- Process for manufacturing titanium dioxide pigments using ultrasonication. – https://patents.google.com/patent/US9353266B2/en
- Process for manufacturing titanium dioxide. – https://patents.google.com/patent/US4288418A/en
- An updated review of industrially relevant titanium dioxide and its environmental health effects. – https://www.sciencedirect.com/science/article/pii/S2666911023000114
