Proceso de producción de acetaldehído
Para la producción de acetaldehído se han utilizado las siguientes materias primas: etanol obtenido mediante la fermentación de carbohidratos o la hidratación de etileno, acetileno, etileno, hidrocarburos inferiores, monóxido de carbono e hidrógeno y metanol.
La viabilidad económica de los procesos comerciales depende de la disponibilidad y los precios de las materias primas. En los países altamente industrializados, donde mantener altos precios del etanol mediante medidas fiscales era un desafío o donde el etanol petroquímico no estaba disponible (como fue el caso en Alemania o Japón antes de 1939), el acetileno se convirtió en el material de partida preferido para el acetaldehído.
El proceso del acetileno sigue utilizándose en algunos países de Europa del Este y por empresas que tienen acceso a acetileno económico. Sin embargo, en otros países, el etanol producido petroquímicamente se convirtió en la materia prima preferida, mientras que el etanol derivado de la fermentación se utilizaba y se sigue utilizando en menor medida en países con una industria química menos importante.
En los países occidentales, incluido Japón, estos procesos han sido reemplazados en gran medida por el proceso de oxidación directa desarrollado a finales de la década de 1950 por Wacker-Chemie y Hoechst. Este cambio se produjo porque el etileno está disponible a un costo menor en comparación con el acetileno.
Incluso los procesos de dos etapas que emplean etanol derivado del etileno como material de partida ya no son competitivos debido a la importancia cada vez menor del acetaldehído como intermediario orgánico.
En general, los procesos basados en acetileno, etileno y etanol tienen una mayor selectividad en comparación con la oxidación de hidrocarburos saturados. En este último caso, además del acetaldehído se forman productos de oxidación adicionales.
Sin embargo, estos procesos son económicamente viables sólo en operaciones a gran escala donde se utilizan todos los productos primarios y secundarios obtenidos durante el proceso, ya que la separación de la mezcla de productos puede ser costosa.
Tabla de contenido
1. Producción de acetaldehído a partir de etanol
Para producir acetaldehído, existen dos métodos que involucran etanol: deshidrogenación y oxidación en presencia de oxígeno. Entre 1918 y 1939 se favoreció la deshidrogenación debido a la producción simultánea de hidrógeno. Sin embargo, más tarde, la oxidación catalítica de etanol en fase de vapor se convirtió en el proceso preferido, probablemente debido a la vida útil prolongada del catalizador y al potencial de recuperación de energía.
1.1. Deshidrogenación del etanol
Los estudios iniciales sobre la deshidrogenación del etanol, documentados en 1886, implicaban hacer pasar etanol a través de tubos de vidrio a 260 °C.
CH3CH2OH → CH3CHO + H2 ΔH = +82,5 kJ/mol
Se logran mejores rendimientos con catalizadores como platino, cobre u óxidos de zinc, níquel u cobalto. Patentes posteriores mencionan catalizadores de zinc y cromo, óxidos de metales de tierras raras y mezclas de óxidos de cobre y cromo. Los catalizadores de cobre producen la menor cantidad de productos de descomposición, pero es necesaria una regeneración frecuente del catalizador.
1.1.1. Descripción del proceso
El vapor de etanol se dirige a través de un reactor tubular que contiene un catalizador compuesto de esponja de cobre o cobre activado con óxido de cromo a temperaturas de 260-290 °C. Cada ejecución da como resultado una tasa de conversión del 25-50%.
El acetaldehído y el etanol se separan de los gases de escape, compuestos principalmente de hidrógeno, mediante lavado con alcohol y agua. El acetaldehído puro se obtiene mediante destilación, mientras que el etanol se separa del agua y los productos de mayor punto de ebullición mediante destilación y se devuelve al reactor.
El rendimiento final de acetaldehído es aproximadamente del 90%. Los subproductos incluyen ácido butírico, crotonaldehído y acetato de etilo.
1.2. Oxidación del etanol
La oxidación del etanol es el método de laboratorio más antiguo y eficaz para sintetizar acetaldehído. En el proceso comercial, el etanol se oxida catalíticamente con oxígeno (o aire) en fase de vapor.
CH3CH2OH + 0,5 O2 → CH3CHO + H2O ΔH = -242 kJ/mol
El cobre, la plata y sus óxidos o aleaciones son catalizadores comúnmente utilizados.
1.3. Proceso Veba-Chemie
En el proceso Veba-Chemie, el etanol se combina con aire y se pasa sobre un catalizador de plata a temperaturas que oscilan entre 500 y 650 °C. La temperatura específica depende de la relación alcohol-aire y del caudal de gas a través del catalizador.
La conversión de alcohol oscila entre el 50% y el 70%, mientras que el rendimiento varía entre el 97% y el 99%, dependiendo de las condiciones de reacción. El acetaldehído y el alcohol no transformado se separan del gas residual mediante lavado con alcohol en frío y destilación fraccionada.
Después de la concentración, el alcohol regresa al reactor. El calor generado durante la reacción se utiliza para la producción de vapor utilizando un sistema de recuperación de calor residual inmediatamente después de la zona de reacción.
Los gases residuales se componen principalmente de nitrógeno, hidrógeno, metano, monóxido de carbono y dióxido de carbono y se queman como gas pobre de bajo poder calorífico en generadores de vapor. Como subproducto se producen pequeñas cantidades de ácido acético.
2. Producción de acetaldehído a partir de acetileno
El uso de compuestos de mercurio sirve como catalizador principal para el proceso industrial de adición de agua (hidratación) en la producción de acetileno.
Para lograr una implementación industrial exitosa de este método, es importante eliminar los productos de polimerización y condensación del acetaldehído formados en un ambiente ácido.
En 1912, el Consortium für elektrochemische Industrie propuso un proceso que utilizaba un exceso de acetileno a una temperatura elevada. Implicó la eliminación inmediata del producto acetaldehído del líquido de reacción.
Simultáneamente, el calor generado durante la reacción se disipó destilando una cantidad adecuada de agua. Las reacciones secundarias, como la oxidación del acetaldehído para formar ácido acético y dióxido de carbono, dieron como resultado la reducción del Hg2+ a mercurio metálico. Actualmente se ha interrumpido la producción de acetaldehído a partir de acetileno en los países occidentales.
2.1. Proceso de oxidación húmeda (Hoechst)
El proceso de oxidación húmeda ofreció una solución para evitar la manipulación directa de compuestos tóxicos de mercurio. Fue empleado, entre otros, por Wacker-Chemie hasta que en 1962 se cambió al etileno como material de partida.
En este método, se añadió sulfato de hierro (III) para reoxidar el mercurio metálico a la sal de mercurio (II), asegurando concentraciones adecuadas del catalizador activo. El acetileno reaccionó con la solución acuosa del catalizador a 90-95 °C.
Aproximadamente entre el 30 y el 50 % del acetileno inyectado experimentó reacción en cada ejecución. El gas que salía del reactor se enfrió, lo que provocó la separación principalmente de agua y trazas de mercurio, que luego se devolvieron al reactor.
Se condensaron acetaldehído y agua en refrigeradores adicionales y finalmente se lavó el acetaldehído con agua del gas del ciclo enfriado. Este proceso produjo una solución acuosa de acetaldehído al 8-10%.
Se introdujo nitrógeno con el gas de alimentación, mientras que se produjo dióxido de carbono como subproducto. Para evitar una acumulación excesiva, estos gases se eliminaron retirando una pequeña corriente del gas del ciclo.
Se formó sulfato de hierro (II) durante la reacción y se oxidó en un reactor separado con ácido nítrico al 30% a 95 °C. Se obtuvo acetaldehído puro mediante destilación fraccionada de la solución acuosa a aproximadamente 200 kPa.
2.2. Proceso Chisso
El proceso Chisso empleó una solución de ácido sulfúrico/sulfato de mercurio como catalizador. El acetileno reaccionó completamente con la solución de catalizador a 68-78 °C y una presión manométrica de 140 kPa.
Una combinación de etapas de proceso de presión y vacío, realizadas a bajas temperaturas y sin exceso de acetileno, permitió el aislamiento y destilación de acetaldehído puro, utilizando el calor generado durante la reacción.
De manera similar al proceso Hoechst, el catalizador podría regenerarse con ácido nítrico. Sin embargo, la producción de acetaldehído mediante este método se suspendió en Chisso Corp. hace más de una década.
2.3. Producción mediante viniléter
REPPE en BASF introdujo un método que utiliza éter vinílico, evitando por completo el uso de compuestos tóxicos de mercurio. Se añadió metanol a acetileno a 150-160 °C y 1600 kPa en presencia de hidróxido de potasio, lo que dio como resultado la formación de metil vinil éter. A continuación se hidrolizó el metil vinil éter con ácido diluido.
2.4. Producción mediante diacetato de etilideno
La adición de ácido acético al acetileno en presencia de sales de mercurio (II) produjo diacetato de etilideno (CH3CH(OCOCH3)2). Este compuesto se descompuso en acetaldehído y anhídrido acético a 130-145 °C con la ayuda de catalizadores ácidos como el ZnCl2.
Aunque este proceso fue desarrollado inicialmente por la Société Chimique des Usines du Rhone a escala industrial en 1914, ha perdido importancia en los últimos tiempos.
3. Producción a partir de etileno
El etileno se ha convertido en la principal materia prima para la producción de acetaldehído, siendo el proceso Wacker el método dominante para la oxidación directa del etileno.
3.1. Oxidación directa de etileno
El proceso Wacker, desarrollado por Wacker-Chemie y Hoechst entre 1957 y 1959, implica la siguiente reacción:
CH4 + 0,5 O2 → CH3CHO ΔH= -244 kJ/mol
Se utiliza una solución de catalizador que contiene PdCl2 y CuCl2. Se descubrió que la reacción entre etileno y cloruro de paladio acuoso produce acetaldehído casi cuantitativamente:
C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2HCl
En el proceso Wacker-Hoechst, el paladio metálico se reoxida con CuCl2, que luego se regenera con oxígeno:
Pd+2CuCl2 → PdCl2 + 2CuCl
2CuCl + 0,5 O2 + 2HCl → 2CuCl2 + H2O
Por lo tanto, sólo se necesita una pequeña cantidad de PdCl2 para la conversión de etileno, y el paso determinante de la velocidad es la reacción del etileno con cloruro de paladio.
El proceso se puede realizar en una o dos etapas. En el método de una etapa, una mezcla de etileno y oxígeno reacciona con la solución del catalizador. Se establece un estado estacionario donde la formación de acetaldehído y la reducción de CuCl2 ocurren al mismo ritmo. El grado de oxidación del catalizador, expresado como la relación CCu2+/(CCu2++CCu+), determina este estado estacionario.
En el proceso de dos etapas, el etileno y el oxígeno reaccionan por separado en diferentes reactores y la solución del catalizador se reduce y se oxida alternativamente. Normalmente se utiliza aire para la oxidación del catalizador en lugar de oxígeno puro.
3.1.1. Proceso de una etapa
En el proceso de una etapa se introducen etileno y oxígeno en una torre de reacción. La solución de catalizador se hace circular y se mezcla con el gas utilizando el principio de transporte aéreo. La reacción tiene lugar a unos 130 °C y 400 kPa.
La mezcla resultante de acetaldehído, vapor de agua y gas no convertido se separa, se enfría y se lava para separar los productos de la reacción.
El gas no convertido se recicla de nuevo al reactor, y una pequeña porción se descarga como gas de escape para evitar la acumulación de gas inerte. A continuación, el acetaldehído bruto obtenido del lavado se destila en dos etapas para obtener acetaldehído purificado.
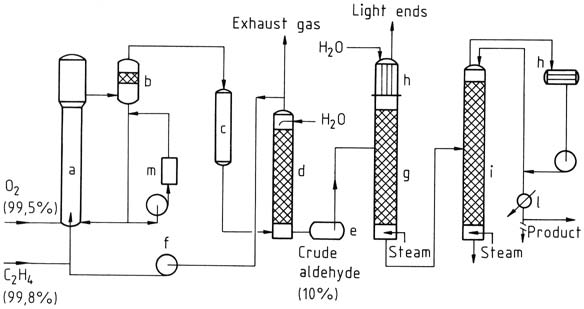
a) Reactor; b) Vaso de separación; c) Enfriador; d) Depurador; e) Tanque de aldehído crudo; f) compresor de ciclo-gas; g) Destilación ligera; h) Condensadores; i) columna de purificación; l) Enfriador de producto; m) Regeneración
3.1.2. Proceso de dos etapas
El proceso de dos etapas implica el uso de reactores tubulares tanto para la reacción como para la oxidación. Los gases reaccionan casi por completo en presencia del catalizador. El etileno reacciona a temperaturas y presiones más bajas y luego la solución catalítica que contiene acetaldehído se expande en una torre de evaporación instantánea.
La mezcla de acetaldehído y vapor de agua se destila y el catalizador se recicla para la reacción con etileno. El agua del proceso se reutiliza y una parte se utiliza para depurar el aire y el gas de escape para eliminar impurezas. El acetaldehído bruto se somete a una destilación en dos etapas para obtener acetaldehído puro.
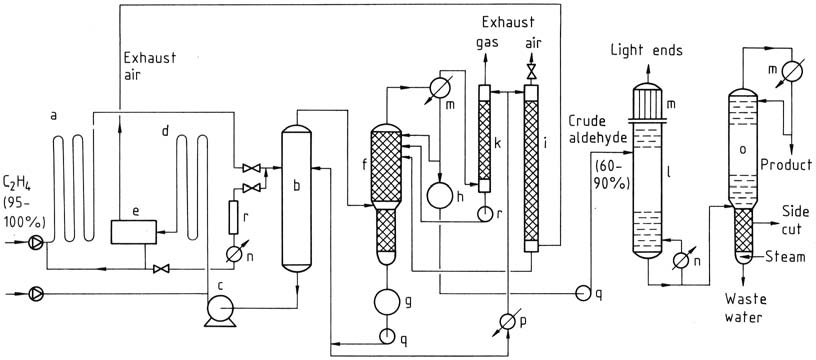
a) Reactor; b) torre de destellos; c) Bomba de catalizador; d) reactor de oxidación; e) Separador de aire de escape; f) columna de aldehído bruto; g) Tanque de agua de proceso; h) Contenedor de crudo-aldehído; i) Depurador de aire de escape; k) Depurador de gases de escape; l) Destilación ligera; m) Condensadores; n) Calentador; o) Columna de purificación; p) Enfriador; q) Bombas; r) Regeneración
Tanto el proceso de una etapa como el de dos etapas tienen un rendimiento similar de acetaldehído de alrededor del 95 % y costos de producción comparables. La elección entre los métodos depende de factores como la disponibilidad de materia prima, consideraciones energéticas y el costo del oxígeno.
3.2. Formación de acetaldehído como subproducto
La generación de acetaldehído ocurre durante el proceso de fabricación de acetato de vinilo a partir de etileno o acetileno. La destilación se emplea para separar el acetaldehído, que posteriormente se convierte en ácido acético para su reciclaje.
En una variación específica del método a partir de etileno, tanto el acetato de vinilo como el acetaldehído se obtienen en proporciones molares iguales de 1:1. Esta característica hace que el proceso sea casi autosuficiente en términos de producción de ácido acético.
3.3. Isomerización de óxido de etileno
Antes de que la oxidación directa del etileno se convirtiera en el método preferido, se llevaron a cabo extensas investigaciones sobre este proceso. Se emplearon catalizadores como Al2O3, SiO2 y sales ácidas derivadas de ácidos minerales como el ácido sulfúrico, el ácido fosfórico o el ácido molíbdico. Aunque se han reportado rendimientos del 90-95%, este enfoque no ha adquirido importancia industrial significativa.
4. Producción de fuentes C1
Tras los aumentos del precio del petróleo en 1973/74 y 1977, los materiales C1 ganaron interés como materia prima para productos químicos orgánicos y como alternativas a los petroquímicos. Sin embargo, en términos de producción de acetaldehído, los materiales C1 parecen tener una importancia limitada ya que la mayoría de los derivados tradicionales de acetaldehído pueden sintetizarse a partir de fuentes C1.
4.1. Producción directa a partir de gas de síntesis
El acetaldehído se forma con una selectividad relativamente baja, con un rendimiento aproximado del 30 % a partir del gas de síntesis. La mezcla resultante también contiene ácido acético, etanol e hidrocarburos saturados, principalmente metano. Se utilizan catalizadores que comprenden compuestos de cobalto y rodio activados por compuestos de yodo o cloruro de magnesio, soportados sobre un soporte de silicato. Hasta la fecha, este proceso no ha encontrado aplicaciones industriales.
4.2. Producción mediante metanol, acetato de metilo o anhídrido acético
La hidroformilación de metanol utilizando CO/H2, conocida como proceso oxo, está bien establecida. Esta reacción ocurre en presencia de catalizadores de hidroformilación como sales de cobalto, níquel y hierro (por ejemplo, CoBr2, CoI2) o los carbonilos metálicos correspondientes.
Se lleva a cabo a temperaturas elevadas (180-200 °C) y alta presión (30-40 MPa). Se ha informado de una selectividad por acetaldehído del 80 % o superior utilizando catalizadores de hierro-cobalto-carbonilo o cobalto-níquel junto con aminas terciarias, fosfinas o nitrilos.
Asimismo, se ha reivindicado una alta selectividad para la hidrocarbonilación de acetato de metilo utilizando catalizadores de paladio o rodio, acompañados de fosfinas terciarias y compuestos de yodo, o catalizadores de cobalto-rutenio, en presencia de yoduros de metilo y sodio.
Ciertas patentes describen la generación de acetaldehído mediante la reducción de anhídrido acético con hidrógeno sobre catalizadores de paladio o platino soportados sobre un soporte, operando a bajas presiones y temperaturas moderadas. Si en el futuro disminuye la importancia del acetaldehído como intermediario orgánico, este método podría resultar interesante para producir pequeñas cantidades de acetaldehído de forma económica.
5. Producción a partir de Hidrocarburos
El acetaldehído es un subproducto incidental en la producción de acroleína, ácido acrílico y óxido de propeno a partir de propeno. Además, se forma por la oxidación de hidrocarburos saturados (p. ej., propano o butano) en fase gaseosa, como lo implementa Celanese en Estados Unidos.
Referencia
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
