Nitrobenceno: Producción, Reacción y Usos
El nitrobenceno es un compuesto químico orgánico con la fórmula molecular C6H5NO2. Es un líquido de color amarillo pálido con un olor distintivo similar al de las almendras amargas.
Tabla de contenido
1. Propiedades físicas del nitrobenceno
El nitrobenceno se conoce como aceite de mirbane. tiene la fórmula química C6H5NO2 y una masa molar de 123,1 g/mol. Este líquido de color amarillo pálido emite un aroma que recuerda a las almendras amargas y presenta una alta solubilidad en varios disolventes orgánicos.
Muestra completa miscibilidad con benceno en todas las proporciones. En particular, el nitrobenceno sirve como disolvente eficaz para el cloruro de aluminio, lo que lo convierte en un componente valioso en la acilación y alquilación de Friedel-Crafts.
El compuesto muestra una ligera solubilidad en agua, siendo aproximadamente del 0,19% a 20 °C y del 0,8% a 80 °C. Además, es fácilmente volátil con el vapor.
Otras propiedades físicas del nitrobenceno son las siguientes:
| Propiedad | Valor |
|---|---|
| mp | 5,85 °C |
| pb a 101 kPa | 210,9 °C |
| pb a 13 kPa | 139,9 °C |
| pb a 4 kPa | 108,2 °C |
| pb a 0,13 kPa | 53,1 °C |
| densidad (sólido) | 1,344 |
| densidad (líquido) 25°C | 1.199 |
| Viscosidad (15 °C) | 2,17 × 102 mPa·s |
| Tensión superficial (20 °C) | 43,35 mN/m |
| Constante dieléctrica a 20 °C | 35,97 |
| Constante dieléctrica a 170 °C | 18.15 |
| Calor específico (30 °C) | 1,418 J/g |
| Calor latente de fusión | 94,1 J/g |
| Calor latente de vaporización | 331 J/g |
| Punto de inflamación (copa cerrada) | 88 °C |
| Temperatura de autoignición | 482°C |
| Límite de explosividad en el aire (93 °C) | 1,8% vol. |
| Densidad de vapor | 4.1 |
| Índice de refracción (15 °C) | 1,55457 |
2. Reacciones químicas del nitrobenceno
El nitrobenceno sufre diversas reacciones químicas debido a la presencia del grupo nitro (-NO2) unido al anillo de benceno. El grupo nitro es un grupo aceptor de electrones, lo que afecta la reactividad del anillo de benceno.
Quita densidad de electrones del anillo, desactivándolo hacia reacciones de sustitución aromática electrófila (EAS). Esto significa que el anillo es menos reactivo ante la sustitución de un electrófilo en lugar de otro electrófilo, como el hidrógeno.
Las reacciones químicas que involucran nitrobenceno abarcan la metasustitución electrófila del anillo aromático a través de procesos como nitración, sulfonación o halogenación.
El nitrobenceno puede actuar como un agente oxidante suave en la síntesis de compuestos como la quinolina y la fucsina.
Por el contrario, la reducción del grupo nitro conduce a una amplia gama de productos, como se presenta en la siguiente tabla:
| Agente reductor | Producto |
|---|---|
| Fe, Zn o Sn/HCl, H2–catalizador | anilina |
| Zn – H2O | N-fenilhidroxilamina (se reordena con ácido a 4-aminofenol) |
| Na3AsO3 | azoxibenceno |
| Zn-NaOH | azobenceno, hidrazobenceno (se reorganiza con ácido para bencidina ) |
| LiAlH4 | azobenceno |
| Na2S2O3– Na3PO4 | fenilsulfamato de sodio (C6H5NHSO3Na) |
| Reducción electrolítica | 4-aminofenol |
Los principales productos de reducción son nitrosobenceno, N-fenilhidroxilamina y anilina, mientras que otros productos surgen de interacciones y reordenamientos posteriores.
Es esencial emplear condiciones de reducción altamente específicas para obtener productos puros, y las etapas intermedias, como el nitrosobenceno, suelen ser difíciles de aislar.
3. Producción de nitrobenceno
El procedimiento tradicional de nitración por lotes implica agregar ácido mixto (ácido nítrico/ácido sulfúrico/agua) (que consta de 27 – 32/56 – 60/8 – 17 % en peso) a un ligero exceso de benceno (para evitar la presencia de ácido nítrico en el gas gastado). ácido). La reacción se controla a una temperatura de 50 – 55 °C y luego se completa calentando a 80 – 90 °C.
Sin embargo, los procesos continuos han reemplazado este enfoque, operando en condiciones similares. Estos procesos continuos ofrecen mayor economía y seguridad debido a una mezcla mejorada y velocidades de reacción más altas que se pueden lograr en reactores más pequeños.
Sorprendentemente, un reactor continuo de 120 L puede producir la misma cantidad de nitrobenceno que un reactor discontinuo de 6000 L. Las configuraciones del reactor varían, pero un ejemplo típico es un reactor cilíndrico agitado que funciona a 50 – 100 °C.
La reutilización del ácido gastado es importante y se logra mediante la concentración continua y la adición de ácido nuevo. Esto contrasta con el concepto de reutilización por lotes, pero ambos enfoques resultan en la misma desventaja de generar una cantidad equivalente de ácido gastado para su eliminación.
Muchas de las instalaciones de producción actuales son unidades empaquetadas basadas en años de experiencia en diseño. Por ejemplo, las unidades Meissner, con capacidades de hasta 12 toneladas de nitroaromáticos por hora, vienen equipadas con una capa de nitrógeno para mayor seguridad.
Se aplican pasos de purga a cada flujo de salida; por tanto, el ácido gastado se extrae junto con el benceno entrante para eliminar el nitrobenceno y el ácido nítrico residuales. Además, los gases residuales se depuran mediante un circuito de ácido mixto para cumplir con las normas medioambientales.
Otro desarrollo innovador es el circuito de nitración por bomba introducido por Nobel Chematur. Este proceso permite que la nitración tenga lugar en la propia bomba, lo que lleva a tiempos de reacción de menos de un segundo debido a la intensa mezcla y a las numerosas ventajas asociadas.
El concepto de un proceso adiabático que utiliza el calor de reacción para la concentración del ácido gastado existe desde 1941. El proceso adiabático American Cyanamid, desarrollado conjuntamente con CLR, constituye la base de una de las plantas de nitrobenceno más grandes del mundo, con una potencia de 159.000 t. /a.
Este proceso implica corrientes paralelas de benceno (1,1 mol por mol de HNO3) y ácido mixto (6 – 8/62 – 68/24 – 32 % en peso) que pasan a través de un reactor tubular vigorosamente agitado, con entrada a 60 – 80 °. C (por debajo del punto de ebullición del benceno) y salir a unos 120 °C, asegurando un tiempo de residencia de aproximadamente 4 minutos.
La necesidad de ácido sulfúrico mucho más débil hace que el reciclaje del ácido sea mucho más rentable, especialmente porque el calor del proceso es casi suficiente para la evaporación, especialmente al vacío.
Otra opción para evitar la necesidad de una reconcentración separada del ácido sulfúrico es realizar la nitración a temperaturas más altas (120 – 160 °C) con el exceso de agua destilada del nitrador como azeótropo con benceno.
En un proceso dúplex, el azeótropo de benceno resultante de la reacción parcial de la primera etapa a alta temperatura se utiliza en una segunda etapa de temperatura más baja para completar la reacción. Si bien la nitración azeotrópica ofrece importantes ahorros de energía, no se considera tan competitiva como la nitración adiabática.
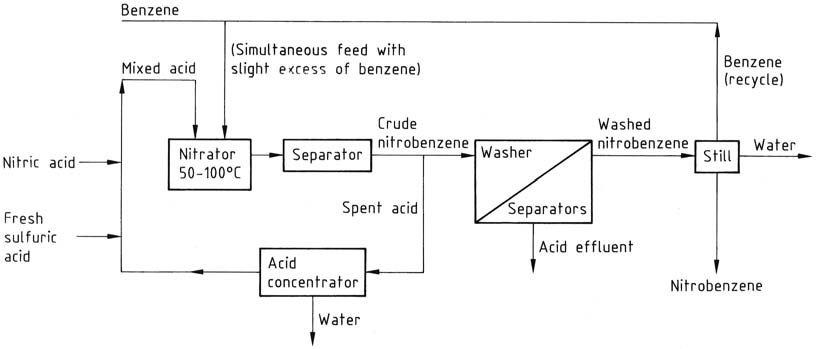
Todos estos procesos comparten flujos de trabajo similares. La mezcla de reacción se mueve desde el nitrador a un separador o centrífuga, y el ácido acuoso gastado se devuelve al circuito de reciclaje a través de un concentrador o etapa de ajuste de fuerza, según corresponda.
El nitrobenceno bruto, como capa superior, pasa a través de una serie de lavadoras-separadoras donde el ácido residual se elimina primero con álcali diluido y luego con agua. El producto lavado se somete a un alambique para eliminar agua y benceno (reciclado).
Si es necesario, el producto finalmente se destila al vacío para obtener un producto puro con un rendimiento global de aproximadamente el 96 %. Las etapas de lavado crean un problema de efluentes, lo que requiere tratamiento de aguas residuales, principalmente para eliminar el nitrobenceno.
En 1985, la capacidad mundial de producción de nitrobenceno era de aproximadamente 1,7 millones de toneladas anuales, de las cuales aproximadamente un tercio se encontraba en Europa occidental y otro tercio en los Estados Unidos.
4. Usos del nitrobenceno
La utilización del nitrobenceno como disolvente en reacciones químicas específicas desempeña un papel menor, aunque significativo. La mayor parte (aproximadamente el 95 % o más) del nitrobenceno producido se convierte en anilina, que sirve como precursor de numerosos productos posteriores.
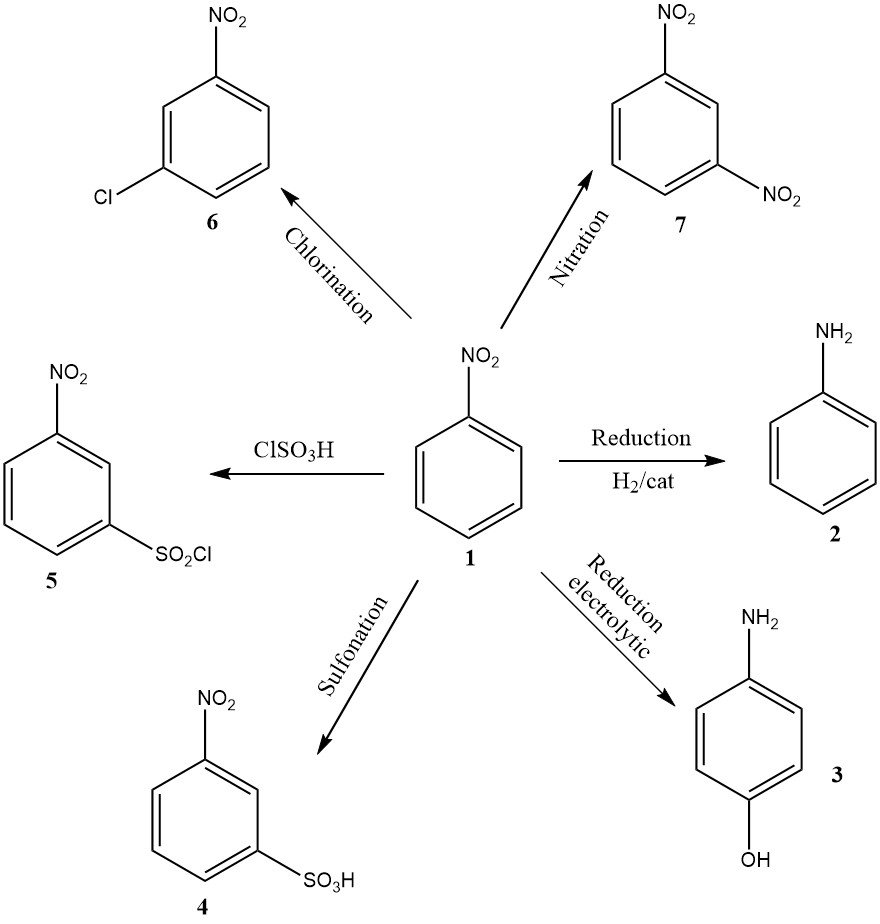
Aunque de menor volumen, otras aplicaciones industrialmente relevantes incluyen la reducción electrolítica para producir 4-aminofenol, la nitración que produce 1,3-dinitrobenceno (7), la cloración que produce 3-cloronitrobenceno (6), la sulfonación que produce ácido 3-nitrobencenosulfónico (4), y clorosulfonación dando cloruro de 3-nitrobencenosulfonilo (5).
Los últimos tres productos se utilizan principalmente como precursores de sus productos de reducción: 3-cloroanilina, ácido metanílico y 3-aminobencenosulfonamida, respectivamente.
La anilina encuentra aplicaciones en la fabricación de polímeros de uretano, productos químicos para caucho, pesticidas, colorantes (particularmente colorantes azoicos), explosivos y productos farmacéuticos. Es un compuesto versátil con una amplia gama de usos en diferentes industrias.
Además de su función como precursor de la anilina, el nitrobenceno también se utiliza como disolvente en determinados procesos industriales y de laboratorio. Puede utilizarse para disolver diversas sustancias, especialmente aquellas que no son solubles en agua.
La solubilidad del nitrobenceno en disolventes orgánicos lo convierte en una herramienta útil en ciertos procedimientos experimentales.
Además, la nigrosina (C.I. Solvent Black 5) se obtiene como una mezcla cruda resultante de la reacción de nitrobenceno con anilina y clorhidrato de anilina a una temperatura de 200 °C en presencia de hierro o cobre.
5. Toxicidad del nitrobenceno
El nitrobenceno, con un Valor Límite Umbral (TLV) de 5 mg/m³, es altamente tóxico y puede provocar una intoxicación aguda debido a su fácil absorción a través de la piel o el tracto respiratorio.
Los principales efectos de la exposición incluyen una reducción de los niveles de hemoglobina, metahemoglobinemia, cianosis y dificultad para respirar. La exposición prolongada puede provocar daños en el bazo y el hígado, ictericia y anemia.
Es importante señalar que el consumo de alcohol puede acelerar e intensificar estos efectos. Por lo tanto, se deben establecer y mantener condiciones de trabajo estrictas y bien definidas para garantizar un control y seguridad adecuados.
Referencia
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
