Metanol: Producción, Reacciones y Usos
El metanol, también conocido como alcohol de madera, es un compuesto químico con la fórmula CH3OH. Es un líquido incoloro e inflamable con un olor alcohólico distintivo. El metanol es el alcohol más simple y el más importante a nivel industrial.
El metanol es una materia prima química clave que se utiliza en la producción de una amplia gama de productos, incluidos plásticos, pinturas y productos farmacéuticos. También se utiliza como combustible y fuente de energía.
El metanol se aisló por primera vez en el siglo XVII, pero no fue hasta principios del siglo XX que comenzó a producirse a escala comercial. Hoy en día, el metanol se produce mediante diversos procesos, pero el método más común consiste en hacer reaccionar monóxido de carbono e hidrógeno en presencia de un catalizador de óxido de cobre.
El metanol es una molécula muy versátil y puede convertirse en una amplia gama de otras sustancias químicas mediante una variedad de reacciones químicas. Por ejemplo, el metanol se puede utilizar para producir formaldehído, ácido acético y metacrilato de metilo.
El metanol también se utiliza como combustible y fuente de energía. Se puede mezclar con gasolina para reducir las emisiones y también se puede utilizar en pilas de combustible para generar electricidad.
Tabla de contenido
1. Propiedades físicas del metanol
El metanol es un líquido incoloro con alta polaridad y presión de vapor media. Es un disolvente versátil que puede disolver una amplia gama de sustancias, incluidos agua, alcoholes y otros disolventes orgánicos. Es miscible con aceites y grasas hasta cierto punto.
El metanol tiene las propiedades físicas que se presentan en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Estado físico | Líquido |
| Color | Incoloro |
| Olor | Ligeramente dulce, alcohólico |
| Punto de fusión | -97,6 °C (-143,7 °F; 175,6 K) |
| Punto de ebullición | 64,7 °C (148,5 °F; 337,8 K) |
| Densidad | 0,792 g/cm³ |
| Solubilidad en agua | Miscible |
| Presión de vapor | 160 mmHg a 20 °C (68 °F) |
| Punto de inflamación | 11 °C (52 °F) |
| Límites de inflamabilidad | 6,7–36 % por volumen en el aire |
| Temperatura de autoignición | 455 °C (851 °F) |
2. Reacciones químicas del metanol
El metanol es el alcohol más simple y su reactividad está determinada por el grupo hidroxilo. El metanol reacciona escindiendo el enlace C-O u O-H, y el grupo hidrógeno o hidroxilo puede sustituirse. A diferencia de los alcoholes superiores, el metanol no puede sufrir una eliminación β para formar un enlace múltiple.
Las reacciones industriales importantes del metanol incluyen:
- Deshidrogenación y deshidrogenación oxidativa.
- Carbonilación
- Esterificación con ácidos orgánicos o inorgánicos y derivados ácidos.
- Eterificación
- Adición a enlaces insaturados.
- Reemplazo de grupos hidroxilo.
1. Combustión de metanol: El metanol puede sufrir combustión, que es una reacción química que implica la combinación de metanol con oxígeno gaseoso (O2) para producir dióxido de carbono (CO2), agua (H2O) y energía.
2CH3OH + 3O2 → 2CO2 + 4H2O + energía
Esta reacción es exotérmica y produce mucho calor, lo que convierte al metanol en un combustible útil.
2. Esterificación: El metanol puede reaccionar con los ácidos carboxílicos para producir ésteres, que son compuestos orgánicos con un olor dulce característico. Esta reacción está catalizada por un catalizador ácido, como el ácido sulfúrico o el ácido clorhídrico.
RCOOH + CH3OH → RCOOCH3 + H2O
3. Deshidratación: El metanol puede sufrir deshidratación, que es una reacción química que implica la eliminación de moléculas de agua del metanol para producir dimetiléter (DME). Esta reacción está catalizada por un catalizador ácido, como alúmina o zeolita.
2CH3OH → CH3OCH3 + H2O
4. Oxidación: El metanol se puede oxidar para producir formaldehído (HCHO), que es un compuesto intermedio útil en la producción de diversos productos químicos.
2CH3OH + O2 → 2HCHO + 2H2O
Esta reacción suele estar catalizada por un catalizador metálico, como cobre o plata.
5. Metilación: El metanol se puede utilizar como fuente de grupos metilo (-CH3) en diversas reacciones químicas, como la metilación de fenoles para producir metilfenoles.
C6H5OH + CH3OH → C6H4(OCH3)OH + H2O
3. Producción de Metanol
Actualmente, el metanol se produce a escala industrial mediante una conversión catalítica de gas de síntesis a baja presión. Este proceso tiene menores costos de inversión y producción, confiabilidad operativa mejorada y mayor flexibilidad que otros métodos.
La producción de metanol se puede dividir en tres pasos principales:
- Producción de gas de síntesis.
- Síntesis de metanol
- Procesamiento de metanol crudo.
3.1. Producción de gas de síntesis
El gas de síntesis se puede producir a partir de una variedad de materiales carbonosos, incluidos carbón, coque, gas natural, petróleo y fracciones de petróleo. El gas natural es la materia prima más común para la producción de gas de síntesis a gran escala para la síntesis de metanol.
La composición del gas de síntesis necesario para la síntesis de metanol se caracteriza por el número estequiométrico S, que se define de la siguiente manera:
S = (H2 – CO2)/(CO + CO2)
El número de estequiometría debe ser al menos 2,0 para la mezcla de gases de síntesis. Los valores superiores a 2,0 indican un exceso de hidrógeno, mientras que los valores inferiores a 2,0 indican una deficiencia de hidrógeno.
Una deficiencia de hidrógeno reducirá la selectividad hacia el metanol, mientras que un exceso de hidrógeno aumentará el tamaño del circuito de síntesis. Por lo tanto, una composición de gas de síntesis con un número estequiométrico ligeramente superior a 2,0 es óptima para la síntesis de metanol.
3.1.1. Gas de síntesis a partir de gas natural
La mayor parte del metanol producido en todo el mundo se deriva del gas natural, que puede craquearse mediante reformado con vapor, reformado autotérmico, una combinación de los mismos o mediante oxidación parcial.
Reformado con vapor
En el reformado con vapor, la materia prima de gas natural se craquea catalíticamente en ausencia de oxígeno con la adición de vapor y posiblemente dióxido de carbono. Esto produce un gas de síntesis con un número estequiométrico muy por encima de 2,0.
El número estequiométrico se puede ajustar al valor deseado de ligeramente por encima de 2,0 añadiendo CO2 ya sea aguas arriba o aguas abajo del reformador de vapor. El calor necesario para la reacción se suministra externamente.
Reforma autotérmica
En el reformado autotérmico, la materia prima de gas natural se convierte mediante oxidación parcial con oxígeno y reacción con un catalizador a base de Ni. El calor para la reacción lo proporciona la reacción de oxidación parcial exotérmica. El gas de síntesis obtenido se caracteriza por una deficiencia de hidrógeno, por lo que se debe agregar hidrógeno antes de dirigirlo al circuito de síntesis de metanol.
Combinación de vapor y reformado autotérmico
En una combinación de los dos procesos, sólo una parte de la corriente de gas natural se somete a reformado con vapor. El resto se alimenta junto con el gas reformado con vapor a un reformador autotérmico (ATR) lleno de catalizador a base de Ni.
En el ATR, el gas natural se oxida parcialmente con oxígeno. El número estequiométrico del gas de síntesis se puede ajustar ligeramente por encima de 2,0 ajustando la división entre vapor y reformado autotérmico y seleccionando los parámetros de proceso adecuados.
Oxidación parcial
En la oxidación parcial, la materia prima de gas natural se craquea sin catalizador mediante oxidación directa con oxígeno. Esto genera calor para la reacción.
3.1.2. Gas de síntesis a partir de otras materias primas
Hidrocarburos
Los hidrocarburos superiores, como el gas licuado de petróleo, los gases residuales de las refinerías y la nafta, también se pueden utilizar como materias primas para la producción de gas de síntesis para las plantas de metanol. Se procesan principalmente mediante reformado con vapor.
Petróleo crudo, petróleo pesado, alquitrán y asfalto
El petróleo crudo, el petróleo pesado, el alquitrán y los productos asfálticos también se pueden convertir en gas de síntesis, pero esto es más difícil que con el gas natural. Su contenido de azufre es considerablemente mayor (0,7-1,5% H2S y COS) y debe reducirse.
El gas de síntesis producido también contiene un exceso de monóxido de carbono y, por lo tanto, debe someterse a una conversión por desplazamiento con agua. El exceso resultante de dióxido de carbono se elimina del gas. La limpieza de gases y la eliminación de dióxido de carbono se pueden lograr, por ejemplo, dentro de un proceso Rectisol.
Carbón
El carbón se puede convertir en gas de síntesis con vapor y oxígeno mediante diversos procesos a diferentes presiones (0,5-8 MPa) y temperaturas (400-1500°C). El gas de síntesis a base de carbón debe desulfurarse y someterse a conversión por turnos para obtener la estequiometría requerida.
3.2. Síntesis de metanol
El metanol se sintetiza a partir de gas de síntesis en un reactor a 200-300 °C y 5-10 MPa. La reacción es exotérmica, por lo que se debe eliminar el calor para evitar que el reactor se sobrecaliente.
Se enfría el gas que sale del reactor y se condensa el metanol. El gas restante se recicla de nuevo al reactor, junto con el gas de síntesis fresco. Esto es necesario porque sólo entre el 50 y el 80 % del gas de síntesis se convierte en metanol en una sola pasada.
A continuación se purifica y destila el metanol bruto. El gas de purga del circuito de reciclaje se utiliza para calentar el reformador.
Desarrollo tecnológico
Hasta 1997, la principal diferencia entre los procesos industriales de metanol a baja presión era el diseño del reactor. La capacidad máxima de las plantas de metanol era de 2.500 a 3.000 t/d.
En 1997, Lurgi introdujo el proceso MegaMetanol, que combina diferentes tipos de reactores con una planta de producción de gas de síntesis a gran escala. Esto allanó el camino para plantas de metanol con capacidades de hasta 10.000 t/d por tren.
Hoy en día, existe una variedad de tecnologías de síntesis de metanol disponibles, cada una con sus propias ventajas y desventajas. Los principales proveedores de tecnología son Lurgi, JM/Davy, Topsøe, MGC, JM/Uhde, JM/Jacobs, JM/Others y JM/Toyo.
Todas estas tecnologías se basan en conceptos altamente integrados que incluyen todos los pasos, desde la gasificación y la limpieza del gas hasta la síntesis y el procesamiento. Esto permite altas eficiencias energéticas y de carbono de hasta el 67% y el 83%, respectivamente.
3.2.1. Diseño de reactores
El metanol se ha producido a escala industrial desde la década de 1960, y todavía se utilizan varios diseños de reactores básicos diferentes en la actualidad. El mejor diseño para una planta en particular dependerá de los requisitos específicos, como la fuente de carbono, la disponibilidad de servicios públicos y la integración del calor.
Reactores adiabáticos
Los reactores adiabáticos no eliminan calor durante la reacción, por lo que la temperatura aumenta gradualmente a lo largo del eje del reactor. Esto se puede mitigar apagando la reacción con gas frío en varios puntos o usando una serie de lechos de reactor con refrigeradores intermedios.
Reactores cuasi isotérmicos
Los reactores cuasi isotérmicos mantienen una temperatura relativamente constante en todo el reactor. Esto normalmente se hace mediante el uso de un reactor tubular con enfriamiento mediante agua hirviendo. También existen reactores refrigerados por gas, en los que el calor de reacción se transfiere al gas de reacción.
Diseños de reactores específicos
Algunos diseños específicos de reactores de metanol incluyen:
- Reactor cuasi isotérmico estándar: Este reactor utiliza un reactor tubular con enfriamiento mediante agua hirviendo.
- Reactor Variobar: este reactor utiliza un reactor de carcasa y tubos enrollado en varios niveles, con tubos de enfriamiento integrados en el empaque del catalizador.
- Reactor refrigerado por gas: este reactor tiene un lecho de catalizador en el lado de la carcasa y el gas de síntesis fluye a través del lecho de catalizador en dirección axial, radial o axial-radial.
- Superconvertidor: Este reactor utiliza tubos de doble pared llenos de catalizador en el espacio anular. El gas de síntesis primero fluye a través del tubo interior para calentarlo y luego en dirección inversa a través del lecho del catalizador para liberar el calor de reacción.
3.2.2. Diseños de circuitos de síntesis de metanol a gran escala
El metanol es un buen portador de energía para áreas remotas porque puede transportarse fácilmente. Sin embargo, para que sean económicas, las plantas de producción de metanol deben ser a gran escala. Esto significa que la tasa de conversión del gas de síntesis en metanol debe ser alta, de modo que se minimice la cantidad de gas que fluye a través del circuito.
Un diseño para una planta de síntesis de metanol de alta conversión es la síntesis de metanol con convertidor combinado de Lurgi (Figura 1). Este proceso utiliza dos reactores en paralelo: un reactor cuasi isotérmico de agua en ebullición y un reactor refrigerado por gas.
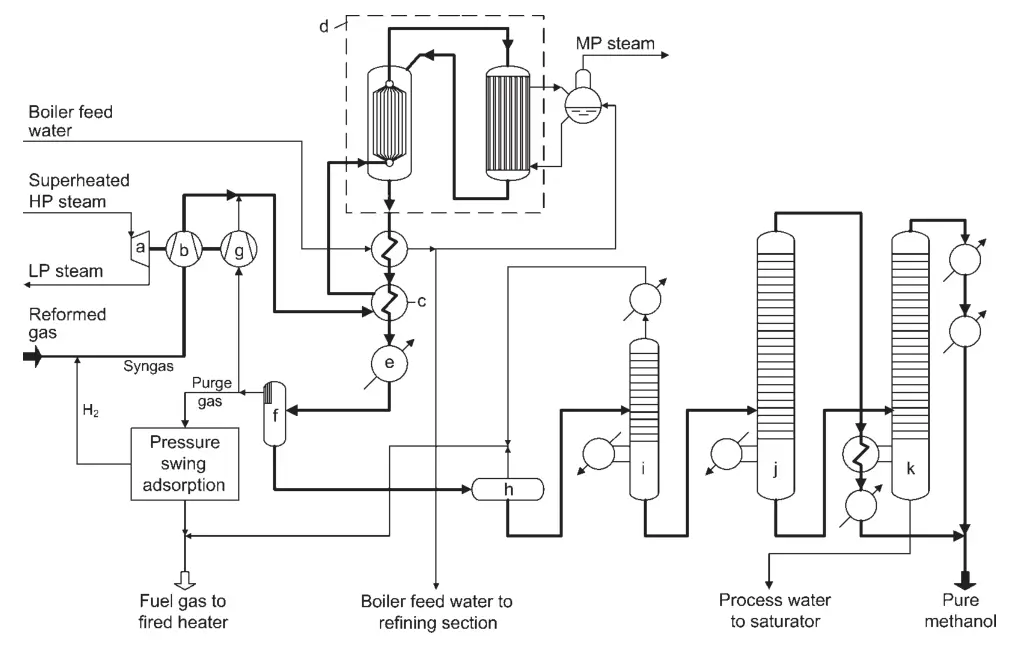
a) Turbina para gas de síntesis y compresor de reciclaje; b) compresor de gas de síntesis; c) Calentador de compensación; d) Sistema convertidor combinado; e) Enfriador final; f) Separador de metanol; g) Reciclar el compresor de gas; h) Vaso de expansión; i) Columna de extremos ligeros; j) Columna de presión de metanol puro; k) Columna de metanol atmosférico
El reactor cuasi isotérmico convierte la parte más reactiva del gas de síntesis, mientras que el reactor refrigerado por gas convierte el gas restante. El calor de reacción del reactor enfriado por gas se utiliza para precalentar el gas de entrada al reactor cuasi isotérmico.
Otro diseño para una planta de síntesis de metanol de alta conversión es la tecnología de bucle en serie de Davy Process Technology (Figura 2). Este proceso utiliza dos reactores en serie, utilizándose dos veces el mismo gas de circulación. La fuerza impulsora de la reacción se mantiene condensando metanol entre los dos reactores.
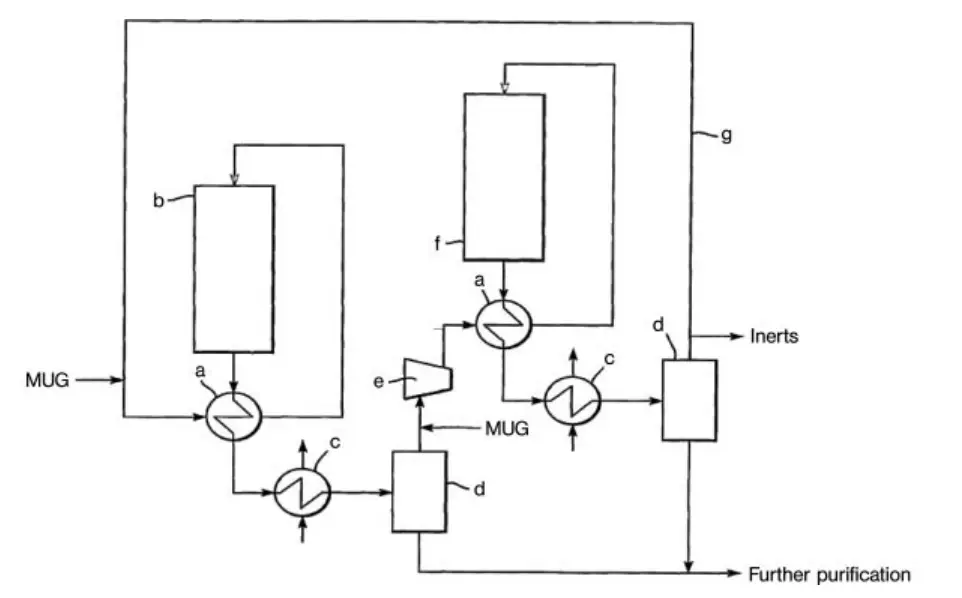
a) Intercambiador; b) reactor; c) Condensador; d) Separador gas-líquido; e) circulador; f) Reactor final; g) Línea de reciclaje de gas
3.3. Rutas de síntesis alternativas de metanol
3.3.1. CO2 a metanol
La valorización química del CO2 mediante hidrogenación a metanol se ha estudiado desde principios de los años 1990. Sin embargo, solo ha ganado interés comercial en los últimos años debido a la creciente conciencia de la necesidad de reducir las emisiones de CO2 y al desarrollo de políticas gubernamentales como impuestos al carbono y programas de límites máximos y comercio.
Varias empresas han desarrollado sistemas catalizadores y conceptos de procesos para la producción de CO2 en metanol. Sin embargo, los resultados a escala piloto son escasos y los únicos proyectos a escala de demostración son los de Mitsui Chemicals y Carbonrecycling, Islandia.
Los conocimientos básicos sobre la tecnología de conversión de CO2 en metanol ya están disponibles, pero los verdaderos desafíos son la producción de hidrógeno renovable y la producción económica de CO2 limpio a partir de corrientes de gases residuales.
Los impulsores políticos, ecológicos y económicos decidirán si esta tecnología llega al mercado y cuándo.
3.3.2. Síntesis de metanol en fase líquida
El metanol también se puede producir convirtiendo monóxido de carbono (CO) con hidrógeno en una fase líquida, normalmente metanol. Cuando se utilizan condiciones de reacción adecuadas y sistemas catalíticos que contienen componentes alcalinos, se pueden alcanzar productividades significativas de hasta 1,3 kg kgcat⁻¹ h⁻¹.
El mecanismo de reacción en la fase líquida es diferente al de la fase gaseosa. Implica la carbonilación de metanol (o un alcohol superior) al éster metílico respectivo, seguida de hidrogenólisis al alcohol y metanol respectivos.
A finales de la década de 1990, el Departamento de Energía de Estados Unidos (DOE), junto con Eastman y Air Products, puso en funcionamiento una planta a escala de demostración para la síntesis de metanol en fase líquida.
Sin embargo, se descubrió que la vida útil del catalizador es inferior a la de los procesos convencionales (mejor caso: 0,17 %/día a 215 °C). Tanto el agua como el CO2 tienen un efecto negativo sobre el rendimiento del catalizador.
A pesar de estos desafíos, la investigación sobre la síntesis de metanol en fase líquida está en curso. Este concepto es prometedor porque tiene el potencial de ser más eficiente y menos costoso que la síntesis convencional de metanol en fase gaseosa.
3.3.3. Oxidación directa de metano
La oxidación directa de metano a metanol es una reacción muy deseable, pero también muy desafiante. Esto se debe a que la reacción es tanto cinética como termodinámicamente desfavorable.
La mayoría de los sistemas catalíticos para la oxidación directa de metano a metanol producen una baja conversión (<10%) o una baja selectividad (<80%). Sin embargo, algunas empresas afirman haber desarrollado procesos simples y eficientes para esta reacción, principalmente para pequeñas fuentes de gas.
Un sistema catalizador prometedor son los catalizadores heterogéneos de Pt-CTF (estructura covalente a base de triazina) en un medio de ácido sulfúrico. Se ha demostrado que este sistema logra una alta conversión y selectividad para la oxidación directa de metano a metanol.
3.4. Destilación de metanol crudo
El metanol crudo que sale del reactor contiene agua y otras impurezas, incluidas sustancias ligeras y pesadas. La cantidad y composición de estas impurezas dependen de las condiciones de reacción, el gas de alimentación y el catalizador.
Para purificar el metanol crudo, primero se lo vuelve ligeramente alcalino mediante la adición de pequeñas cantidades de sosa cáustica acuosa para neutralizar los ácidos carboxílicos inferiores e hidrolizar parcialmente los ésteres. Luego, los extremos ligeros se retiran en una columna de extremos ligeros. Finalmente, se destila metanol puro por cabeza en una o más columnas de destilación.
Si las columnas de destilación funcionan a diferentes presiones, el calor de condensación de los vapores de la columna que funciona a mayor presión se puede utilizar para calentar la columna a menor presión.
Si el agua de proceso contiene ligeras impurezas, se requiere una extracción lateral o una columna adicional para la purificación.
Algunos componentes forman mezclas azeotrópicas con metanol, como acetona, formiato de etilo, acetato de metilo, acetato de etilo y propionato de metilo.
4. Usos del metanol
El metanol tiene una variedad de usos en diversas industrias. Para obtener información detallada, consulte este artículo: Usos del metanol →
5. Toxicología del metanol
El metanol es un alcohol venenoso que puede absorberse por la boca, la piel y los pulmones. Se metaboliza en ácido fórmico, que puede provocar acidosis y otros problemas de salud.
Los síntomas de la intoxicación por metanol incluyen dolor abdominal, náuseas, dolor de cabeza, vómitos, lasitud, visión borrosa, oftalmalgia, fotofobia y xantopsia. En casos graves, la intoxicación por metanol puede provocar coma y la muerte.
La dosis letal de metanol está entre 30 y 100 ml/kg de peso corporal. La sensibilidad al metanol varía ampliamente.
El tratamiento para la intoxicación por metanol incluye:
- Administración de etanol para inhibir la oxidación del metanol a ácido fórmico.
- Lavado gástrico
- Hemodiálisis
- Tratamiento con álcali para controlar la hiperacidez sanguínea.
- Administración de estimulantes del SNC.
- Beber grandes volúmenes de líquido
- Vendaje para proteger los ojos de la luz.
- Mantener al paciente caliente
El metanol también puede causar intoxicación crónica, que se caracteriza por daños en los sistemas nervioso central y visual.
Referencia
- Methanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_465.pub3
