Indol: propiedades, reacciones, producción y usos

¿Qué es el indol?
El indol, también conocido como 1-benzo[b]pirrol, es un compuesto orgánico heterocíclico aromático que tiene una estructura bicíclica (un benceno fusionado a un pirrol) con la fórmula química C8H7N. Es un sólido incoloro con un olor a humedad muy persistente.
El indol fue descubierto por primera vez por A. V. Baeyer y C. A. Knop en 1866 como resultado de la investigación sobre la reducción de la isatina, que se deriva del tinte natural índigo. El indol se sintetizó calentando oxindol con polvo de zinc. En 1910, R. Weissgerber aisló el indol del alquitrán de hulla.
El indol se ha encontrado en la Robinia pseudacacia, los jazmines y ciertas plantas cítricas; en el perfume de Hevea bruziLiensis, en las flores de naranja y en la madera de Celtis reticulosa. Constituye el 2,5% del aceite de jazmín y el 0,1% del aceite de flor de naranja. Cuando se utiliza en fragancias en concentraciones más altas, exuda un intenso olor fecal.
El indol es plano con 10 electrones π en un sistema completamente conjugado. El anillo se clasifica como un compuesto heteroaromático π-excesivo debido al carácter donador de electrones del átomo de nitrógeno de tipo pirrol. El sistema π es relativamente rico en electrones, particularmente en el carbono C-3.
Tabla de contenido
1. Propiedades físicas del indol
El indol es un sólido cristalino incoloro que es fácilmente soluble en alcohol, benceno, éter y la mayoría de los disolventes orgánicos, pero escasamente soluble en agua. Es volátil con vapor.
El indol es un compuesto neutro (compuesto nitrogenado no básico) pero puede ser protonado o desprotonado por un ácido o una base muy fuertes, respectivamente. El pKa del ácido conjugado es de aproximadamente -2,4; el del compuesto neutro es de aproximadamente 16,7.
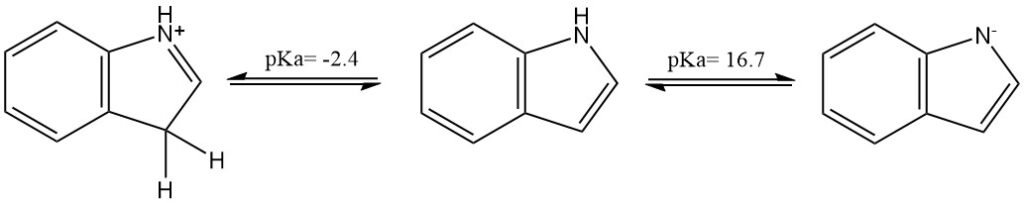
Las propiedades físicas del indol se resumen en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número CAS | [120-72-9] |
| Fórmula química | C8H7N |
| Peso molecular | 117,15 g/mol |
| Punto de fusión | 52–54◦C |
| Punto de ebullición | 254 °C |
| Densidad | 1,22 g/cm3 |
| pKa | 16,7 |
| Calor de combustión | 3,650 kJ/kg (a 25 °C) |
| Entalpía de vaporización (10,3–27,4 °C) | 597,5 kJ/kg |
| Momento dipolar | 2,11 D (benceno) |
2. Reacciones químicas del indol
El indol, como compuesto heterocíclico, muestra una reactividad característica tanto del pirrol como del benceno. El átomo de hidrógeno unido al nitrógeno puede ser reemplazado por metales alcalinos. La oxidación del indol produce índigo, mientras que la hidrogenación suave produce 2,3-dihidroindol (indolina). Las reacciones con ácidos dan como resultado la formación de diindol, triindol y productos poliméricos.
2.1. Sustitución aromática electrofílica del indol
El indol puede sufrir una sustitución aromática electrofílica debido a la naturaleza rica en electrones de la fracción pirrol. El carbono en la posición 3 es el más reactivo debido tanto a la distribución de la densidad electrónica como a la estabilidad de las estructuras intermedias.
Los estudios computacionales que utilizan métodos de orbitales moleculares han revelado que la densidad electrónica en la posición 3 es mayor que en la posición 2. Además, las energías relativas de las estructuras intermedias formadas durante la sustitución electrofílica sugieren que la posición 3 es más favorable para el ataque.
Esta preferencia se debe probablemente a la retención del carácter bencenoide del anillo carbocíclico en el intermedio formado en la posición 3.
En el caso de los indoles 3-sustituidos, el ataque electrofílico puede ocurrir en la posición 3, incluso si ya está sustituido. Esto puede conducir a un patrón complejo de sustitución, ya que tanto el sustituyente nuevo como el original pueden migrar a la posición 2.
Se pueden realizar muchas reacciones de sustitución aromática electrofílica comunes en el indol. Sin embargo, a menudo surgen complicaciones debido a la reactividad excesiva del indol o la inestabilidad relativa de los productos de sustitución. Un ejemplo de ello es la halogenación.
2.1.1. Halogenación
La halogenación del indol se puede lograr utilizando varios reactivos, como el ion hipoclorito, el cloruro de sulfurilo, el tribromuro de piridinio y el yodo. El producto principal de la halogenación es típicamente el derivado 3-haloindol.
El indol se puede clorar utilizando iones hipoclorito o cloruro de sulfurilo para producir 3-cloroindol. Sin embargo, el 3-cloroindol es relativamente inestable en soluciones acuosas ácidas y puede sufrir hidrólisis para convertirse en oxindol.
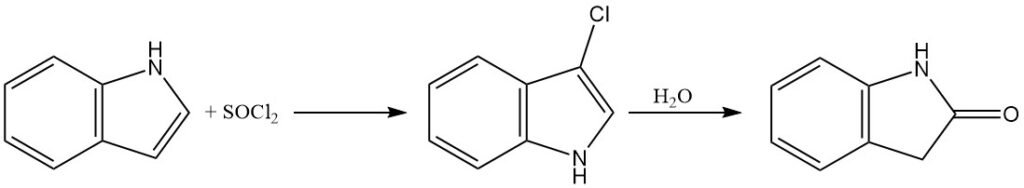
El 3-bromoindol se puede preparar utilizando tribromuro de piridinio como fuente de bromo electrofílico. El indol reacciona con yodo para dar 3-yodoindol.
Tanto el 3-bromoindol como el 3-yodoindol son susceptibles a la hidrólisis en condiciones ácidas, pero son relativamente estables en entornos básicos.
2.1.2. Nitración
La nitración del indol puede ser una reacción compleja debido a la formación de óxidos de nitrógeno, que pueden participar en transformaciones oxidativas. En medios fuertemente ácidos, la nitración de los indoles 2-sustituidos ocurre principalmente en la posición 5.
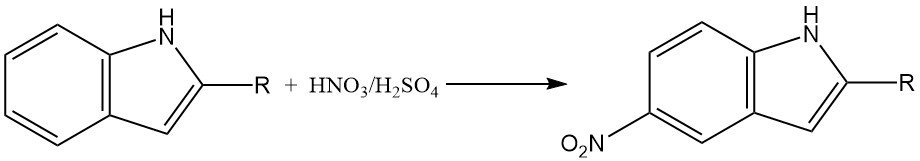
Esto se debe probablemente a la formación de un intermedio de ácido conjugado, que tiene un carácter aromático reducido y es más susceptible a la nitración en la posición 5.
2.1.3. C-Alquilación
La C-alquilación del indol se puede lograr haciendo reaccionar el indol con agentes alquilantes en condiciones apropiadas. La regioselectividad de la C-alquilación puede verse influenciada por las condiciones de reacción y la naturaleza del agente alquilante.
Las condiciones que promueven la formación del intermedio de sustitución aromática electrofílica, como el uso de bases fuertes o coordinación metálica estrecha en nitrógeno o agentes alquilantes altamente reactivos como compuestos alílicos y bencílicos, favorecen la alquilación C-3.
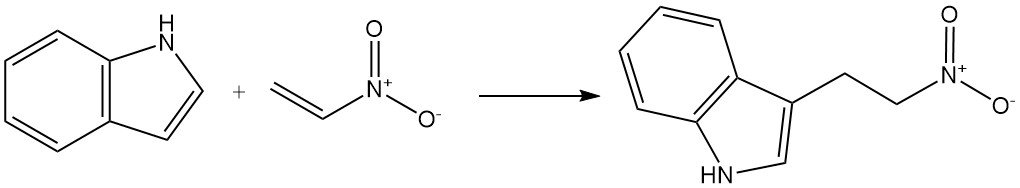
Los reactivos insaturados activados por grupos atractores de electrones también pueden reaccionar con el indol para experimentar alquilación C-3. Un ejemplo es la reacción del indol con nitroetileno para formar 3-(2-nitroetil)indol.
La gramina, un intermediario formado por la reacción del indol con el ion N,N-dimetilformaldiminio, se puede utilizar para introducir una variedad de sustituyentes en la posición 3. El grupo dimetilamino de la gramina puede ser desplazado por nucleófilos, o la gramina puede convertirse en su sal cuaternaria antes de la sustitución.
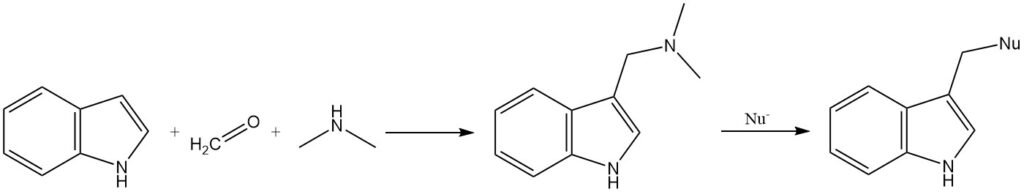
2.1.4. Acilación
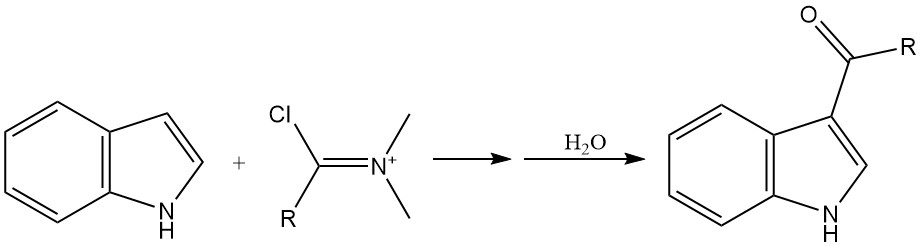
La acilación es otro método importante para introducir sustituyentes en el anillo de indol, particularmente en la posición 3. La acilación se puede lograr utilizando diversos reactivos, como haluros de acilo y reactivos de Vilsmeier-Haack.
Los haluros de acilo altamente reactivos, como el cloruro de oxalilo, pueden acilar directamente el indol sin necesidad de un catalizador. Los cloruros de ácido normales pueden reaccionar con las sales de magnesio o zinc del indol para producir productos de acilación.
La reacción de Vilsmeier-Haack, que implica una amida y oxicloruro de fósforo, es un método común para la acilación del indol.
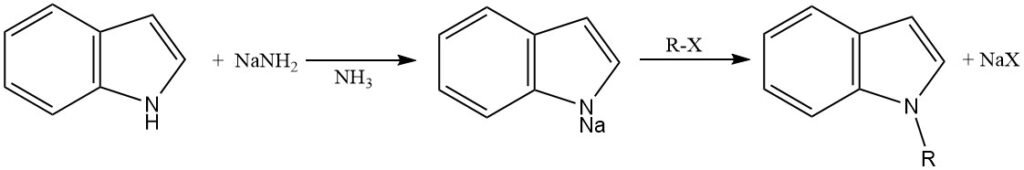
2.2. N-alquilación de indol
Para facilitar la N-alquilación, el anillo de indol debe desprotonarse para generar el anión indol, que es un nucleófilo más fuerte que la molécula de indol neutra.
Esta desprotonación se puede lograr utilizando varias bases fuertes, como amida de sodio en amoníaco líquido, hidruro de sodio o hidruro de potasio en solventes apróticos (N,N-dimetilformamida y dimetilsulfóxido), o catálisis de transferencia de fase.
El anión indol generado se alquila mediante reacción con un haluro de alquilo u otro agente alquilante. La elección del agente alquilante y las condiciones de reacción pueden influir en la regioselectividad de la N-alquilación.
Los haluros de alquilo primarios, secundarios y terciarios se pueden utilizar para la N-alquilación de indol. Sin embargo, los haluros de alquilo primarios son generalmente más reactivos que los haluros de alquilo secundarios o terciarios. También se pueden utilizar otros agentes alquilantes, como sulfatos de dialquilo, tosilatos de alquilo y triflatos de alquilo.
2.3. Arilación de indol
La arilación de indol es la introducción de un grupo arilo en el anillo de indol. Esta reacción se lleva a cabo típicamente a través de intermediarios sustituidos en lugar de hacerlo directamente en el indol. Las reacciones de acoplamiento cruzado catalizadas por paladio se han convertido en el método preferido para la arilación de indoles y otros anillos heteroaromáticos.
Las reacciones de acoplamiento cruzado catalizadas por paladio implican el acoplamiento de un haluro de arilo o un triflato de arilo con indol en presencia de un catalizador de paladio. El nucleófilo arilo puede ser un indol-estaño, indol-cinc o indol-ácido borónico.
Las reacciones de acoplamiento cruzado catalizadas por paladio son altamente selectivas, se pueden utilizar para introducir una variedad de grupos arilo en el anillo de indol y se llevan a cabo en condiciones suaves.
2.4. Litiación y transformaciones posteriores
La litiación del indol es la introducción de un átomo de litio en el anillo de indol de la posición 2. Se han utilizado con frecuencia tres intermediarios, como 1-fenilsulfonilindol (1), 1-t-butoxicarbonilindol (2) o indol-1-carboxilato de litio (3), y se ha logrado un buen rendimiento.
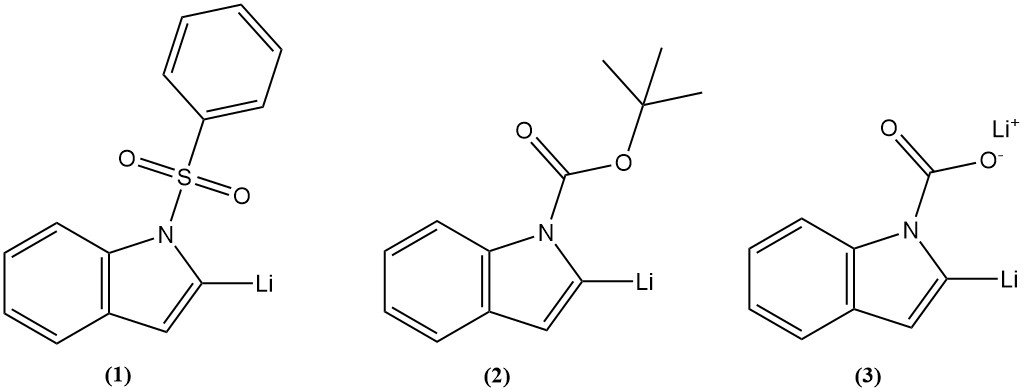
La litiación del indol en la posición 2 puede ir seguida de una reacción con diversos electrófilos para introducir una amplia variedad de sustituyentes. La litiación en otras posiciones del anillo de indol puede lograrse mediante intercambio de halógeno-metal.
2.5. Oxidación del indol
El indol es susceptible a la oxidación debido a su naturaleza rica en electrones. La oxidación del indol puede conducir a la formación de diversos intermediarios y productos, dependiendo del oxidante utilizado.
La oxidación del indol con oxígeno a menudo conduce a la formación de intermediarios 3-hidroperoxi-3H-indol. Estos intermediarios pueden sufrir transformaciones adicionales, como descomposición o reordenamiento, para formar diversos productos de oxidación.
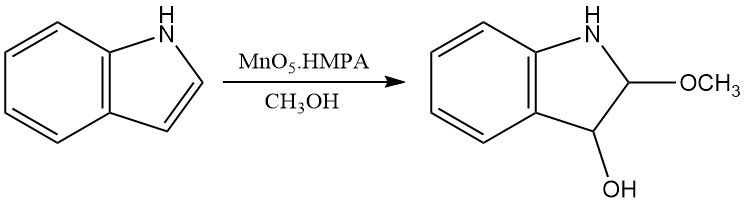
Los ácidos peroxicarboxílicos también pueden oxidar el indol para producir productos similares a los obtenidos con oxígeno. Otros oxidantes químicos, como el dimetilsulfóxido en ácido acuoso o MoO5·HMPA, producen oxindoles y 3-hidroxi-2-metoxiindolinas, respectivamente.
3. Producción de indol
El indol se obtiene principalmente de dos fuentes: alquitrán de hulla y síntesis química. Aunque se han descrito métodos sintéticos para la producción de indol, la extracción de la fracción de destilado de alquitrán de hulla es la única fuente comercial.
El alquitrán de hulla de alta temperatura contiene aproximadamente un 0,2 % de indol. Durante la destilación del alquitrán de hulla, el indol se concentra en una fracción de bifenil-indol que hierve dentro de un estrecho rango de temperatura de 245 a 255 °C.
Después de eliminar los fenoles y las bases, el indol se separa del bifenilo mediante:
- Reacción con hidróxido de potasio para formar su sal de potasio, que se puede separar del bifenilo.
- Destilación azeotrópica con dietilenglicol.
- Extracción de la mezcla de bifenilo-indol utilizando disolventes selectivos como glicoles, dimetilsulfóxido acuoso o monoetanolamina.
El indol crudo obtenido a partir de estos procesos se puede purificar aún más mediante cristalización a partir de disolventes de hidrocarburos alifáticos.
Se han desarrollado varios métodos químicos para la síntesis de indol a escala técnica, entre ellos:
- La síntesis de Madelung implica la formilación de o-toluidina utilizando ácido fórmico, seguida de ciclización para formar indol.
- Deshidrogenación y ciclización de 2-etilanilina para formar indol.
- Ciclocondensación de anilina y etilenglicol en fase líquida o gaseosa para producir indol.
- Ciclización de 2-(2-nitrofenil)etanol.
3.1. Producción de indol mediante síntesis de Madelung
La síntesis de Madelung es un método clásico para la preparación de indoles. Esta reacción es una condensación intramolecular de una o-alquilanilida. La o-toluidina reacciona con ácido fórmico para producir N-formil-o-toluidina, que se trata con amida sódica para formar indol.
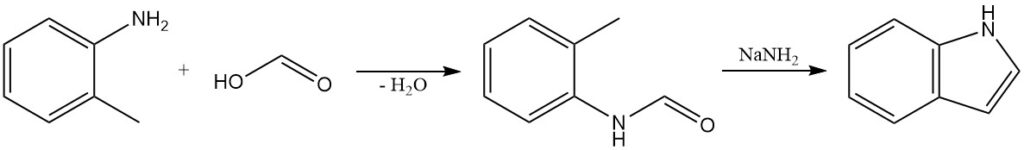
La síntesis de Madelung se ha utilizado para preparar una variedad de indoles sustituidos, incluidos aquellos con grupos funcionales como halógenos, grupos alquilo y grupos arilo.
La síntesis original de Madelung utilizaba altas temperaturas y bases fuertes como la amida de sodio. Por ejemplo, la o-metilacetanilida se puede convertir en 2-metilindol calentándola con amida de sodio a temperaturas elevadas.
En los últimos años, los investigadores han desarrollado condiciones más suaves para la síntesis de Madelung, que pueden ser ventajosas para sustratos sensibles o cuando es importante evitar reacciones secundarias.
Un método implica el uso de bases fuertes no nucleófilas como n-butillitio o diisopropilamida de litio para formar un derivado de dilitio de la anilida, que luego puede sufrir ciclización en condiciones más suaves.
3.2. Otros métodos de síntesis
El indol se puede sintetizar a través de varias vías, incluida la reacción de anilina con bromuro de etileno, calentando o-amino-ω-cloroestireno con etóxido de sodio y calentando la dianilida del ácido tartárico con cloruro de cinc.
El ácido indol-2-carboxílico, que produce indol por descaraboxilación, se puede formar calentando o-formilfenilglicina con anhídrido acético y acetato de sodio.
Otros métodos para la síntesis de indol incluyen la destilación de ácido oxal-o-toluico con polvo de cinc o su sal de bario, la pirólisis de N-etilanilina, la deshidrogenación catalítica de o-etilanilina y el calentamiento de clorhidrato de o,o’-diaminoestilbeno a presión reducida.
El indol también se puede obtener mediante la reducción de o-nitrofenilacetonitrilo, ácido o-nitrocinámico u o-nitrofenilacetaldehído.
Finalmente, el indol se puede preparar tratando el ácido acetil-o-aminocinámico con ácido clorhídrico a altas temperaturas o reduciendo o-ω-dinitrostireno. El calentamiento del ácido indol-2-carboxílico y del ácido quinolin-2,3-dicarboxílico con carbonato de calcio también produce indol.
3.3. La síntesis de indol de Fischer
La reacción de Fischer ha demostrado ser la más versátil para la síntesis de derivados de indol, aunque la reacción no puede producir indol por sí misma. Desde un punto de vista teórico, la acetaldehído fenilhidrazona produciría indol mediante la síntesis de Fischer, pero en la realidad no se obtiene ninguno.
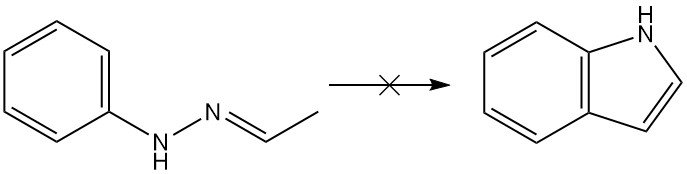
La síntesis de indol de Fischer es un método clásico para la preparación de indoles que implica la ciclización de una N-arilhidrazona en condiciones ácidas para formar un indol.
El paso clave en la síntesis de indol de Fischer es una transposición sigmatrópica [3,3] del tautómero enehidrazona de la hidrazona. Para que se produzca la ciclización, debe haber al menos un átomo de hidrógeno α en el enlace C-N. La regioselectividad de la reacción está influenciada por los sustituyentes en el carbono de la hidrazona.
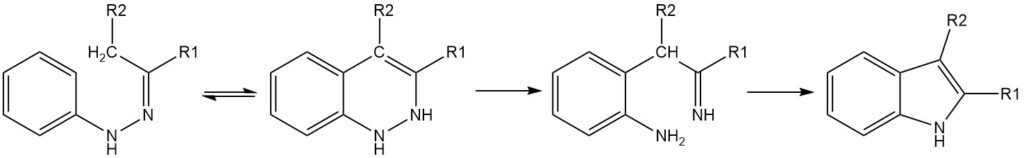
Si sólo hay un átomo de hidrógeno α en el enlace C-N, el producto será un indol 3,3-disustituido-3H. Si ambos sustituyentes en el carbono de la hidrazona tienen uno o más hidrógenos α, pueden resultar mezclas de productos.
En general, el sustituyente más ramificado tiene más probabilidades de sufrir ciclización. Por ejemplo, las fenilhidrazonas derivadas de metilalquilcetonas suelen producir 2-metilindoles. Sin embargo, la selectividad puede revertirse en determinadas condiciones de reacción.
La presencia de sustituyentes en el anillo fenilo de la hidrazona también puede influir en la regioselectividad de la síntesis de indol de Fischer. Los sustituyentes meta pueden conducir a la formación de indoles isoméricos, mientras que los sustituyentes orto hacen que la reacción sea más complicada.
3.4. Biosíntesis de indol a partir de triptófano
Una de las principales fuentes de indol en los sistemas biológicos es el aminoácido triptófano. La conversión del triptófano en indol se produce a través de una serie de reacciones enzimáticas conocidas como la vía de degradación del triptófano. Esta vía se encuentra principalmente en bacterias y hongos, pero también puede estar activa en ciertos tejidos de mamíferos, como el hígado y el intestino.
El paso inicial de esta vía es la escisión del triptófano por la enzima triptofanasa. Esta reacción produce indol, piruvato y amoníaco.
Además de la vía de la triptofanasa, el triptófano también puede degradarse a través de la vía de la quinurenina, que participa principalmente en la producción de niacina (vitamina B3), pero también produce derivados del indol.
4. Usos del indol
El indol se utiliza en diversas industrias, incluidas la farmacéutica, la perfumería y la aromatización. También es un componente natural de varias sustancias, como el humo del tabaco, el aceite de jazmín y el aceite de azahar. Es un producto de degradación bacteriana del triptófano en el intestino.
Debido a su agradable aroma, el indol se ha utilizado como fijador de fragancias durante muchos años. También se utiliza como agente aromatizante sintético.
El indol puede actuar como una kairomona, una sustancia química volátil liberada por las plantas para atraer a los insectos fitófagos.
El indol es un precursor para la síntesis del aminoácido esencial triptófano. Se pueden utilizar métodos tanto químicos como biotecnológicos para producir triptófano a partir del indol.
El indol se utiliza para sintetizar reguladores del crecimiento de las plantas, como el ácido indol-3-acético y el ácido indol-3-butanoico. La indolina, un derivado del indol, se utiliza en la síntesis de protectores vegetales fungicidas y bactericidas.
Los derivados del indol tienen una amplia gama de aplicaciones farmacéuticas, como:
- La indometacina y otros derivados del indol se utilizan como analgésicos suaves.
- La indolina y sus derivados se utilizan en la síntesis de fármacos antihipertensivos.
- La triptamina, un derivado del indol, se utiliza en la síntesis del vasodilatador Vincamina.
- Los piridilalquilindoles, derivados del indol, se utilizan como antidepresivos, antihistamínicos y antihipertensivos.
- Los 3-peridinilindoles, obtenidos a partir del indol, se utilizan para prevenir la anoxia.
- El 5-cloroindol, un derivado del indol, se utiliza en la producción de tranquilizantes, fármacos para reducir la presión arterial y antieméticos, y en el tratamiento de la enfermedad de Parkinson.
El indol y sus derivados se utilizan como intermediarios en la síntesis de diversos colorantes, incluidos los colorantes diazo catiónicos, los colorantes de cianina, los colorantes de indolilmetano y los colorantes de ftaleína de carbazol.
5. Toxicología del indol
La población general puede estar expuesta al indol a través de la inhalación del aire ambiente o del humo del tabaco, la ingestión de alimentos contaminados y el contacto dérmico con vapores, alimentos, perfumes u otros productos que contengan indol. La exposición ocupacional puede ocurrir en lugares de trabajo donde se produce o utiliza indol.
El indol puede absorberse a través de varias vías, incluidas la inhalación, la ingestión y el contacto dérmico.
El indol absorbido desde el tracto gastrointestinal se metaboliza en el hígado para formar indoxilo, que luego se conjuga con sulfato para producir indican. Estos metabolitos se excretan principalmente a través de la orina.
El indol se absorbe fácilmente desde el tracto gastrointestinal y experimenta un metabolismo rápido en el hígado. Los metabolitos primarios del indol incluyen el indican y el oxindol, que se excretan principalmente a través de la orina.
La DL50 oral aguda del indol en ratas y ratones es de aproximadamente 1000–1100 mg/kg y 500 mg/kg, respectivamente. Los estudios de autopsia posteriores a la exposición aguda revelaron hemorragias e hiperemia en los órganos y tejidos internos. El indol tiene un olor desagradable y puede causar náuseas en concentraciones bajas.
El indol puede causar una leve irritación temporal en la piel y los ojos cuando se aplica tópicamente. A diferencia de su derivado metilado, el escatol, el indol no induce daño pulmonar en el ganado después de una aplicación oral repetida.
Las dosis crónicas altas de indol (20–200 mg/kg/día durante más de tres meses) en ratones, ratas, conejos y perros se han asociado con efectos hematológicos, incluyendo anemia, leucocitosis y leucopenia. En el ganado, se ha observado hemólisis y nefrosis hemoglobinúrica después de dosis orales repetidas.
Si bien no hay evidencia experimental definitiva de la carcinogenicidad del indol, puede influir en la formación de tumores causados por otros agentes. Se ha demostrado que las dosis altas de indol (800 mg/kg/día) aceleran el desarrollo de tumores de piel y carcinomas de vejiga en modelos animales.
En cuanto a la genotoxicidad, se ha descubierto que el indol potencia los efectos mutagénicos de otros agentes en la prueba de Ames. Sin embargo, el indol en sí no fue mutagénico en la prueba de Ames ni en una prueba de transformación celular. En un ensayo de reparación de ADN, el indol causó daños reparables en el ADN de Bacillus subtilis.
La Asociación de Fabricantes de Sabores y Extractos (FEMA) ha otorgado al indol el estatus GRAS (generalmente reconocido como seguro) y está aprobado para su uso como material aromatizante en alimentos. Sin embargo, no existen límites de exposición ocupacional específicos para el indol establecidos por las agencias reguladoras.
Referencias
- Indole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_167
- Indole; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0914041519211404.a01
- Indole; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543008605
- Indole; Chemistry of Heterocyclic Compounds, Volume 8. – https://onlinelibrary.wiley.com/doi/10.1002/9780470186572.ch1
- https://www.sciencedirect.com/science/article/abs/pii/S092809871630207X
- https://www.sciencedirect.com/science/article/abs/pii/S0040403921007413
