Hidroxilamina: reacciones, producción y usos

La hidroxilamina, inicialmente descrita por LOSSEN en 1865, fue aislada posteriormente como su base libre en 1891 por LOBRY DE BRUYN. RASCHIG obtuvo una patente para el primer método industrial de producción de sulfato de hidroxilamonio en Alemania (1908) y Estados Unidos (1911).
La importancia de las sales de hidroxilamina y sus soluciones radica en su importante papel como intermediarios en diversos procesos industriales, en particular en la fabricación de caprolactama. Se estima que la capacidad mundial anual de producción de hidroxilamina alcanza las 800.000 toneladas métricas.
Tabla de contenido
1. Propiedades físicas de la hidroxilamina
La hidroxilamina, de fórmula química NH2OH, tiene la característica de formar cristales transparentes, incoloros y sin olor.
Este compuesto exhibe una alta solubilidad en agua, así como en metanol y etanol. Varias propiedades físicas asociadas con la hidroxilamina son las siguientes:
| Propiedad | Valor |
|---|---|
| Masa molar | 33,03 g/mol |
| Punto de fusión (pf) | 32,05 °C |
| Punto de ebullición (pb) a 29 kPa | 56 °C |
| Presión de vapor a 0 °C | 0,36 kPa |
| Presión de vapor a 32 °C | 7,1 kPa |
| Entalpía de Formación | -114 kJ/mol |
1.1. Sulfato de hidroxilamonio
El compuesto de sulfato de hidroxilamonio, también conocido como (NH3OH)2SO4 o (NH2OH)2·H2SO4, existe en una forma cristalina que se disuelve fácilmente en agua pero muestra sólo una ligera solubilidad en disolventes orgánicos.
La forma sólida de este compuesto tiene una densidad de 1,883 g/cm3, mientras que la densidad aparente es de aproximadamente 1,10 g/cm3.
Es importante señalar que el sulfato de hidroxilamonio se descompone cuando se expone a temperaturas superiores a 120 °C.
Las soluciones acuosas de sulfato de hidroxilamonio son transparentes e incoloras. En una solución acuosa al 1 % en peso a 20 °C, el pH mide 3,6.
1.2. Cloruro de hidroxilamonio
El cloruro de hidroxilamonio cristalino, también conocido como (NH3OH)Cl o NH2OH·HCl, es una sal higroscópica que forma cristales. Presenta una alta solubilidad tanto en agua como en metanol.
La adición de 0,5% en peso de sílice pirogénica previene eficazmente el apelmazamiento, donde el gel de sílice actúa como un componente insoluble e inerte.
El cloruro de hidroxilamonio tiene una densidad de 1,676 g/cm3 y una densidad aparente de aproximadamente 0,780 g/cm3.
Su descomposición se produce a temperaturas superiores a 120 °C. Cuando se disuelve en agua, una solución acuosa al 1 % en peso de cloruro de hidroxilamonio a 20 °C tiene un valor de pH de 3,2.
2. Reacciones químicas de la hidroxilamina
Al calentarse, las sales de hidroxilamonio se descomponen y, si se produce un calentamiento local, puede provocar una descomposición exotérmica descontrolada. La presencia de impurezas de metales pesados, en particular cobre, aleaciones que contienen cobre y sales de cobre, favorece la descomposición.
La descomposición del sulfato de hidroxilamonio produce dióxido de azufre, monóxido de dinitrógeno (óxido nitroso), agua y sulfato de amonio. Por otro lado, el cloruro de hidroxilamonio se descompone en cloruro de hidrógeno, nitrógeno, agua y cloruro de amonio.
Cuando las sales de hidroxilamonio reaccionan con un álcali, producen hidroxilamina, que se descompone fácilmente. La reacción con los nitritos da como resultado la descomposición en monóxido de dinitrógeno.
Las soluciones acuosas de sales de hidroxilamonio presentan acidez. La exposición prolongada a 80 °C provoca una descomposición lenta. La hidroxilamina y sus sales actúan como trampas de radicales en solución, lo que lleva a la formación de amoníaco y nitrógeno.
La oxidación de la hidroxilamina, dependiendo del oxidante y de las condiciones de reacción, produce compuestos nitrogenados en varios estados de oxidación.
Los agentes reductores fuertes como el zinc o el polvo de hierro producen amoníaco. Muchos iones metálicos forman complejos con hidroxilamina.
Las sales de hidroxilamonio se pueden transformar en ácido hidroxilamina-O-sulfónico cuando reaccionan con óleum o ácido clorosulfónico. Este ácido sirve como reactivo adecuado para procesos como aminación, desaminación reductora, hidroximetilación y formación de heterociclos.
La hidroxilamina puede reaccionar tanto con átomos de nitrógeno como de oxígeno. Cuando se pretende preparar hidroxilaminas O-sustituidas, es necesaria la protección del átomo de nitrógeno para evitar la N-alquilación.
Los compuestos de hidroxilamonio reaccionan con aldehídos y cetonas para formar oximas. Las β-dicetonas y los β-dialdehídos producen isoxazoles de hidroxilamina.
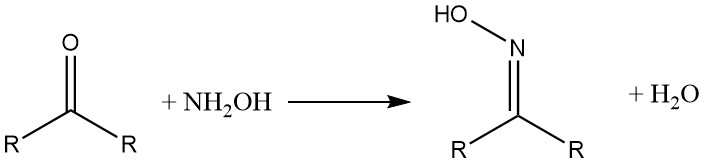
Con los ácidos carboxílicos y sus derivados, la hidroxilamina forma los correspondientes ácidos hidroxámicos.

La reacción con isocianatos y nitrilos conduce a la formación de N-hidroxiureas y amidoximas, respectivamente.

La hidroxilamina también reacciona con dobles enlaces olefínicos:
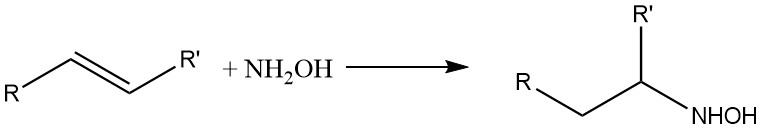
3. Producción de hidroxilamina
La producción industrial de hidroxilamina implica la reducción de los estados de oxidación superiores del nitrógeno. Por ejemplo, el óxido nítrico o el ácido nítrico pueden sufrir una hidrogenación catalítica para producir hidroxilamina.
La reducción del ácido nitroso a hidroxilamina implica el uso de ácido sulfuroso. En todos estos procesos, el producto resultante es una solución acuosa de una sal, NH2OH·HX (donde HX representa un ácido, como el ácido sulfúrico o fosfórico), o (NH3OH)X, en lugar de hidroxilamina libre.
La hidrólisis ácida de los nitroalcanos primarios, que al mismo tiempo produce el correspondiente ácido carboxílico, desempeña un papel menor en la producción global de hidroxilamina.
3.1. Hidrogenación catalítica de óxido nítrico
Para lograr óxido nítrico de alta pureza, se emplea un proceso de dos pasos. Inicialmente, se hacen reaccionar amoniaco y oxígeno sobre un catalizador de platino-rodio a temperaturas superiores a 900 °C.
Para garantizar la seguridad, el gas de reacción se diluye con suficiente agua o vapor de agua, lo que lleva la mezcla por debajo del límite inferior de explosión. Esta reacción produce óxido nítrico junto con dióxido de nitrógeno y exceso de oxígeno como subproductos.
El segundo paso implica la hidrogenación de dióxido de nitrógeno y el exceso de oxígeno sobre un catalizador de plata. El dióxido de nitrógeno se convierte en óxido nítrico, mientras que el exceso de oxígeno se transforma en agua.
Después de la condensación y la recuperación simultánea del vapor de agua, el óxido nítrico se purifica mediante un lavador.
Luego se convierte en hidroxilamina haciéndola reaccionar con hidrógeno por debajo de 50 °C sobre una suspensión de catalizador de platino parcialmente envenenado en ácido sulfúrico. Como subproductos se producen pequeñas cantidades de sulfato de amonio y monóxido de dinitrógeno.
El proceso industrial sigue un enfoque continuo de varios pasos, con una amplia recirculación de los gases de escape.
El gas residual, que contiene hidrógeno, nitrógeno, óxido nítrico y monóxido de dinitrógeno, se puede quemar para recuperar vapor. Seleccionando cuidadosamente la composición del gas se pueden evitar mezclas de gases explosivas durante la síntesis de hidroxilamina.
Además, un proceso modificado implica la hidrogenación catalítica de monóxido de nitrógeno, lo que lleva a la producción de ciclohexanona oxima e hidroxilamina. Este método se conoce como oximación ácida.
3.2. Hidrogenación catalítica de nitratos
La hidroxilamina se produce comúnmente mediante el proceso de hidroxilamina-fosfato-oxima (HPO). Este proceso implica la hidrogenación de una solución de nitrato de amonio en presencia de ácido fosfórico.
El proceso HPO normalmente se lleva a cabo junto con la síntesis de ciclohexanona oxima, que se utiliza en la producción de caprolactama.
3.3. El proceso de Raschig
El proceso de Raschig, que a menudo se modifica, sigue siendo un método importante para la producción industrial de hidroxilamina.
En el proceso Raschig, el agua, el amoníaco y el dióxido de carbono reaccionan dentro de una columna de absorción. Esta reacción conduce a la formación de una solución de carbonato de amonio, que a bajas temperaturas reacciona con los óxidos de nitrógeno para producir una solución alcalina de nitrito de amonio:
NH3 + H2O + CO2 → (NH4)2CO3
(NH4)2CO3 + NO + NO2 → 2 NH4NO2 + CO2
En el siguiente paso, el nitrito de amonio se convierte en disulfonato de hidroxilamina de amonio haciéndolo reaccionar con dióxido de azufre:
NH4NO2 + 2 SO2 + NH3 + H2O → HO–N(SO3NH4)2
En este proceso, se recicla cualquier exceso de disulfonato de hidroxilamina de amonio. La solución que contiene disulfonato de hidroxilamina de amonio se extrae y la sal se hidroliza y neutraliza, dando como resultado la producción de sulfato de hidroxilamonio y sulfato de amonio como productos finales.
HO–N(SO3NH4)2 + H2O → (NH3OH)2SO4 + (NH4)2SO4
3.4. Escisión ácida de nitroalcanos
La descomposición de mezclas que contienen nitropropano y nitrometano se puede lograr tratándolas con ácido sulfúrico a temperaturas elevadas. Esta reacción produce sulfato de hidroxilamonio y el correspondiente ácido carboxílico:
Nitropropano + Nitrometano + Ácido Sulfúrico → Sulfato de Hidroxilamonio + Ácido Carboxílico
Sin embargo, este proceso se ha empleado de forma limitada debido a su alto coste y la disponibilidad limitada de las materias primas necesarias.
4. Usos de la hidroxilamina
Más del 95% de la producción de hidroxilamina se dedica a la fabricación de ciclohexanona oxima o caprolactama.
Diferentes productores utilizan la hidrogenación o el proceso de Raschig, observándose variaciones principalmente en la cantidad de sulfato de amonio generado durante la oximación.
Las sales de hidroxilamonio sirven como una forma estable de hidroxilamina y encuentran aplicaciones en diversos sectores de la industria química. Algunos usos notables incluyen:
1. Industria química: Actuando como reactivo para la producción de oximas como intermediarios, además de funcionar como agente oxidante o reductor dependiendo del pH.
2. Pinturas y recubrimientos: Utilizados en la producción de oximas especializadas utilizadas como agentes anticrema.
3. Productos farmacéuticos: Empleados en la producción de antibióticos, esteroides, tranquilizantes, espasmolíticos y fármacos antituberculosos.
4. Fotografía: Se utiliza como estabilizador para reveladores y como aditivo en emulsiones de color.
5. Industria del caucho: Actúa como regulador en la polimerización del caucho sintético, antioxidante del caucho natural y acelerador en la vulcanización del caucho sintético.
6. Jabón: Sirve como agente auxiliar en el refinado de grasas para la producción de jabón.
7. Plásticos: Funciona como regulador e inhibidor en diversos procesos de polimerización.
8. Metalurgia: Se utiliza como aditivo para el tratamiento superficial del acero, agente auxiliar para la extracción de metales del licor residual de electrólisis y para la recuperación de desechos. También sirve como agente de flotación para minerales de cobre.
9. Industria nuclear: Actúa como agente auxiliar para la separación de uranio y plutonio.
10. Textiles: Funciona como agente auxiliar en procesos de teñido específicos, fijador de tintes textiles y material de partida para tintes textiles a base de isatina e isoxazol.
11. Protección de cultivos: Sirve como material de partida para la producción de insecticidas, herbicidas y reguladores del crecimiento de las plantas.
12. Alimento: Funciona como intermediario en la producción de edulcorantes.
Estas aplicaciones resaltan la versatilidad y la importancia de las sales de hidroxilamonio en una amplia gama de industrias.
5. Toxicología y Salud Ocupacional
Los compuestos de hidroxilamonio se consideran perjudiciales para la salud y pueden provocar irritación. La LD50 (oral, rata) para los compuestos de hidroxilamonio es de aproximadamente 600 a 640 mg/kg. En términos de toxicidad acuática, la CL50 (orfe dorada, 48 horas) para el sulfato de hidroxilamonio oscila entre 1 y 10 mg/L.
Cuando entra en contacto con la piel, la hidroxilamina puede causar irritación leve a moderada y es posible la sensibilización. También tiene un efecto irritante de moderado a fuerte en las membranas mucosas, como los ojos.
La hidroxilamina se puede absorber a través de la piel y tiene el potencial de formar metahemoglobina.
Los estudios que examinan los efectos teratogénicos de la hidroxilamina (en ratas) no han demostrado efectos nocivos en la descendencia. Si bien la hidroxilamina y sus sales no se consideran cancerígenos según los datos actuales, se ha descubierto que son mutagénicos para organismos inferiores.
Es importante evitar el contacto con las sales de hidroxilamonio debido a sus efectos irritantes y la posibilidad de que el polvo afecte la piel, los ojos y la garganta. En caso de contacto con la piel o los ojos, las zonas afectadas deben enjuagarse abundantemente con agua.
Se debe evitar estrictamente la ingestión de sales de hidroxilamonio y, si es necesario, se debe consultar a un médico. Las sales de hidroxilamonio deben etiquetarse como materiales peligrosos.
Referencia
- Hydroxylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a13_527
Preguntas frecuentes: hidroxilamina
La hidroxilamina puede actuar tanto como ácido como como base, dependiendo de la reacción y el entorno en el que se encuentre.
El ácido conjugado de la hidroxilamina es el ion hidroxilamonio (NH3OH+).
La hidroxilamina se utiliza en diversas aplicaciones, incluida la producción de oximas como intermediarios en la industria química, como antioxidante y regulador en la industria del caucho, en la síntesis de productos farmacéuticos, colorantes y agentes fitosanitarios, y como material de partida para la producción. de caprolactama.
La hidroxilamina puede ser dañina e irritante para la piel, los ojos y las membranas mucosas. Debe manipularse con precaución y con las medidas de seguridad adecuadas. Se debe evitar el contacto con las sales de hidroxilamina y se debe minimizar la exposición.
La hidroxilamina en sí no se usa comúnmente como fármaco. Sin embargo, puede utilizarse como intermediario en la síntesis de ciertos productos farmacéuticos.
El nitrógeno de la hidroxilamina tiene una carga formal de 0 (neutral).
Cuando la hidroxilamina actúa como base, el átomo de nitrógeno de la hidroxilamina acepta un protón.
La cetona reacciona con la hidroxilamina para producir una oxima.
La hidroxilamina se puede producir mediante varios métodos, como la hidrogenación de óxido nítrico o ácido nítrico, el proceso de Raschig o la hidrólisis y neutralización del nitrito de amonio. El método específico depende de la aplicación deseada y de la tecnología disponible.
