Cloroacetaldehído: Propiedades, Producción y Usos

El cloroacetaldehído [107-20-0], también conocido como 2-cloroetanal, es un compuesto orgánico líquido incoloro con la fórmula CH2ClCHO. Fue producido por primera vez en forma pura por K. Natterer en 1882 calentando cloroacetaldehído dietil acetal con ácido oxálico anhidro a 100-150° C.
Tabla de contenido
1. Propiedades físicas del cloroacetaldehído
1.1. Cloroacetaldehído anhidro
El cloroacetaldehído anhidro es un líquido móvil incoloro con un olor acre que tiene las siguientes propiedades físicas:
- Peso molecular: 78,50 g/mol
- Punto de ebullición: 85–85,5 °C (99,7 kPa)
- Entalpía de formación: -256,4 kJ/mol
- Entalpía de combustión: -981,4 kJ/mol (101,3 kPa, 20 °C)
- Momento dipolar: 1,99 D (298 K, benceno)
- Soluble en agua (formación de hidratos) y disolventes orgánicos comunes
- Coeficiente de partición octanol-agua: 0,16 (muy bajo)
1.2. Monocloroacetaldehído Hemihidrato
- Fórmula: CH2ClCH(OH)2OCH(OH)CH2Cl (éter 1,1′-dihidroxi-2,2′-diclorodietilo)
- Peso molecular: 175,01 g/mol
- Cristales incoloros con punto de fusión entre 43 y 50 °C (deshidratación)
- Se descompone en el punto de ebullición (84 °C)
- Soluble en agua, etanol, éter, benceno, diclorometano y cloroformo.
- Números CAS [34789-09-8] («acetaldehído clorodímero hidrato») y [7737-02-2] («1,1′-oxibis( 2-cloroetanol)») se refieren al mismo compuesto.
- Forma una mezcla azeotrópica con agua, inseparable por simple destilación.
- Punto de inflamación: 60°C
- Punto de ignición: 405°C
- Límites de explosividad en el aire (20°C, 101,3 kPa): inferior a 305 g/m³
| Temperatura (°C) | Solubilidad (% en peso |
|---|---|
| 1 | 13.35 |
| 10 | 22.2 |
| 20 | 44,3 |
| 30 | 62,7 |
| 40 | 81,5 |
| Concentración (% en peso | Densidad (g/cm³) |
|---|---|
| 10 | 1.041 |
| 20 | 1.085 |
| 30 | 1.137 |
| 40 | 1.188 |
| 50 | 1.238 |
| 60 | 1.290 |
| 72,5 | 1.355 |
2. Propiedades químicas del cloroacetaldehído
El cloroacetaldehído es muy reactivo debido a los grupos aldehído y clorometilo. Sus α-hidrógenos y su cloro se activan, facilitando sustituciones nucleofílicas y reacciones propias de los aldehídos (adición, condensación).
2.1. Reacciones del grupo aldehído
La autocondensación de cloroacetaldehído a temperatura ambiente forma trímeros, tetrámeros y polímeros de polioximetileno cíclicos. También existen cotrímeros y copolímeros con acetaldehído. La estructura del hemihidrato 1,1′-dihidroxi-2,2′-diclorodietil éter reacciona de manera similar a un aldehído.
El aducto de bisulfito de sodio y los dimetil/dietil acetales son derivados importantes del cloroacetaldehído utilizados como precursores farmacéuticos y de pesticidas.
La oxidación del cloroacetaldehído con sales de aire/cobalto, peróxido de hidrógeno o ácido nítrico produce ácido monocloroacético.

La condensación aldólica en un medio alcalino produce 2,4-dicloroacetaldol y la coaldolización con acetaldehído forma 2-clorocrotonaldehído, que también es un subproducto de la producción de acetaldehído.
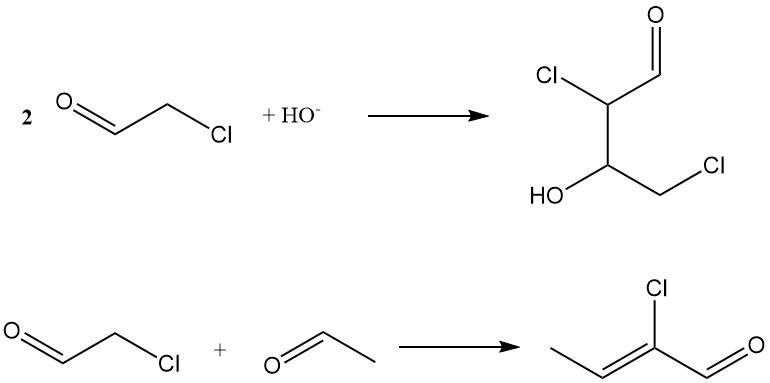
Otras reacciones incluyen la formación de aldehído amoníaco, cianhidrina y cloroacetato de 2-cloroetilo (reacción de Tishchenko).
2.2. Reacciones del átomo de cloro
La hidrogenación de cloroacetaldehído en una solución acuosa con un catalizador de paladio-carbono elimina el cloro. Varios nucleófilos pueden reemplazar el cloro.
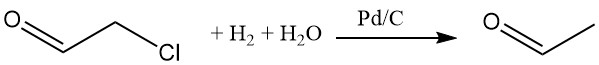
El cloroacetaldehído reacciona con el mercaptano de sodio para producir mercaptoacetaldehído, que se utiliza como intermediario en la síntesis de tienodiazepinas, colorantes azoicos, d-l-cisteína y ciertos sabores de alimentos.

Los compuestos amino pueden sustituir el átomo de cloro del cloroacetaldehído en forma acetal (evitar reacciones con el grupo aldehído). Estos intermediarios se utilizan en la síntesis de pesticidas y productos farmacéuticos.

El cloroacetaldehído dimetil acetal reacciona con metóxido de sodio para formar 1,1,2-trimetoxietano (un intermedio farmacéutico).

2.3. Reacciones combinadas
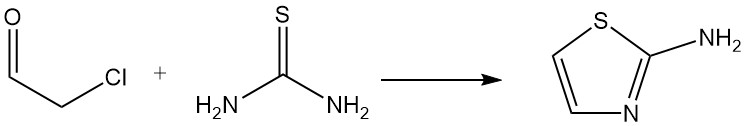
El cloroacetaldehído (hemihidrato o acetal) es un material de partida importante para la síntesis de heterociclos; un ejemplo es la reacción con tiourea para formar 2-aminotiazol, que se utiliza en la producción de productos farmacéuticos y colorantes.
La ciclocondensación con acetoacetato de metilo da 2-metil-3-carbometoxifurano (un desinfectante de semillas).
La reacción del cloroacetaldehído con carboetoxihidrazina, seguida de la ciclación con cloruro de tionilo, produce 5-clorotiadiazol, un defoliante del algodón y regulador del crecimiento de las plantas.
Los estilbenos se forman mediante reacciones con hidrocarburos aromáticos, fenoles o éteres de fenol. Los vinildialquilfosfatos se producen mediante la reacción de Perkow con fosfitos de trialquilo. El 1,1,2-triacetoxietano (precursor de d,l-serina) se prepara haciendo reaccionar cloroacetaldehído con acetato de sodio y anhídrido acético.
2.4. Polímeros de cloroacetaldehído
1. Tricloroparaldehído (C6H9Cl3O3)
- Propiedades: cristales incoloros, pf 88–89 °C, pb 140–144 °C, soluble en disolventes orgánicos comunes.
- Formación:
- Reacción de ácido sulfúrico concentrado con cloroacetaldehído hemihidrato.
- Residuo de la destilación azeotrópica del cloroacetaldehído hemihidrato.
- Descomposición del nitrato de 1,2-dicloroetilo en presencia de ácidos de Lewis.
Se convierte en cloroacetaldehído al calentarlo con ácidos.
2. Tetraclorometaldehído (C8H12Cl4O4)
- Propiedades: cristales incoloros, pf 65–67 °C, pb 127–130 °C.
- Formación: Residuo de la deshidratación azeotrópica del hemihidrato de cloroacetaldehído.
3. Policloroacetaldehídos (C2H3ClO)n
- Propiedades: productos elastoméricos amorfos con estructura poliacetal. Formas cristalinas disponibles a temperaturas más bajas con catalizadores específicos.
- Formación: polimerización de cloroacetaldehído anhidro de -40 a -78°C, especialmente con ácidos de Lewis.
3. Producción de cloroacetaldehído

El cloroacetaldehído se produce por reacción de acetaldehído o paraldehído con cloro, con dicloroacetaldehído y tricloroacetaldehído como impurezas. Estos productos de los árboles también se obtienen como subproductos en el proceso Wacker para la producción de acetaldehído.
Otro método de producción es la cloración de cloruro de vinilo en agua a 20 °C, que produce casi un 100% de cloroacetaldehído si su concentración en el medio de reacción se mantiene por debajo del 5%. Concentraciones más altas favorecen la formación de 1,1,2-tricloroetano.
La reacción del cloro con acetato de vinilo en agua a temperatura ambiente forma una solución concentrada de cloroacetaldehído, que se puede destilar para producir el compuesto puro. Los productos secundarios son cantidades menores de acetaldehídos clorados, acetaldehído y productos de condensación.
La síntesis de acetales de cloroacetaldehído con altos rendimientos y pureza se logra realizando las reacciones anteriores en alcoholes.
La producción de cloroacetaldehído anhidro mediante cloración de acetaldehído o paraldehído seco da un rendimiento bajo. Sin embargo, la deshidratación azeotrópica del hemihidrato con cloroformo, tolueno o tetracloruro de carbono seguida de una destilación sobre un deshidratador agente ofrece mejores resultados.
El cloroacetaldehído anhidro se obtiene con altos rendimientos mediante la despolimerización de tricloroparaldehído o policloroacetaldehído a 145°C con ácido oxálico o ácido tricloroacético. La pirólisis del carbonato de cloroetileno en presencia de sales de amonio cuaternario también da el mismo resultado.
4. Usos del cloroacetaldehído
El cloroacetaldehído se utiliza como componente básico en la producción de intermediarios para las estatinas, que reducen los niveles de colesterol, y para los medicamentos contra el SIDA. El derivado mercapto, 2,5-dihidroxi-1,4-ditiano, se utiliza en la síntesis de medicamentos contra el VIH/SIDA.
El cloroacetaldehído también se utiliza en la síntesis de diversos colorantes. Sus derivados de dialquilacetal, como el cloroacetaldehído dimetil acetal, son materiales de partida importantes para la producción de productos químicos agrícolas y sus acetales se utilizan en la producción de fragancias.
Puede formar polímeros, que comercialmente no son importantes.
5. Toxicología del cloroacetaldehído
Toxicidad aguda:
- Altamente tóxico por inhalación, causando muerte rápida o retardada en animales. Los valores de dosis letal (LD50) son:
- Rata (oral): 89 mg/kg
- Conejo (dérmico): 267 mg/kg
- Rata (inhalación, 1h): 650 mg/m³
- Irritante para la piel y los ojos, incluso en concentraciones bajas (solución al 0,03%).
- No es un sensibilizante cutáneo en cobayas.
Toxicidad crónica:
- No se observaron signos de toxicidad en estudios de inhalación crónica por debajo de 5,2 mg/m³.
- Mutagénico en diversos organismos y células humanas.
- No se observó ningún aumento de tumores de piel en estudios con ratones.
- Se observaron tumores hepáticos en ratones macho que bebieron agua con 0,1 g/l de cloroacetaldehído.
Exposición humana:
- El cloroacetaldehído es un irritante para la piel, las membranas mucosas y el tracto respiratorio.
- Causa ampollas similares a quemaduras y daños en los tejidos al contacto con la piel.
- Lagrimeo e irritación nasal con una exposición al aire de 32,6 mg/m³.
Recomendaciones:
- TLV-STEL (EE.UU.): 1 ppm (concentración máxima permitida en el aire).
- Clasificación de la UE: «Muy tóxico» y «Peligroso para el medio ambiente».
- Requiere equipo de protección personal completo (gafas, guantes y mascarilla).
Referencia
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
