Ácido Tartárico: Propiedades, Reacciones, Producción y Usos
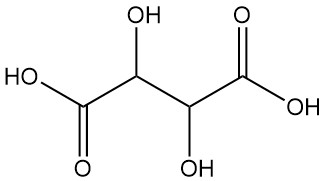
El ácido tartárico, también conocido como acidum tartaricum, ácido 2,3-dihidroxibutanodioico (nomenclatura IUPAC), es un ácido orgánico cristalino blanco que se encuentra naturalmente en muchas frutas con la fórmula C4H6O6. La molécula posee dos centros de carbono asimétricos con dos grupos de ácido carboxílico y un dialcohol en la misma molécula, lo que da como resultado cuatro estereoisómeros.
Enantiómeros:
- El ácido L(+)-tartárico y el ácido D(-)-tartárico son isómeros ópticamente activos que rotan el plano de la luz polarizada. Estas moléculas de imagen especular (enantiómeros) comparten propiedades físicas y químicas idénticas, excepto por las rotaciones ópticas opuestas.
Diastereómeros:
- El ácido DL-tartárico (mezcla racémica) es una combinación equimolar sintética de formas L(+) y D(-). Está ópticamente inactivo debido a la compensación interna.
- El ácido mesotartárico (ácido tartárico irresoluble) es otro diastereómero ópticamente inactivo con propiedades físicas distintas en comparación con las formas activa y racémica. Ni el racémico ni el mesotartárico son ácidos ópticamente activos.
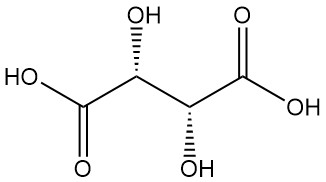
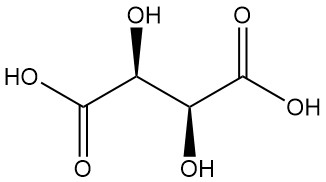
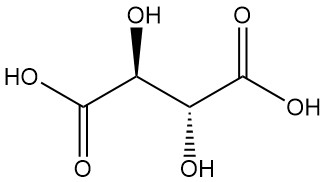
El ácido tartárico, conocido desde la antigüedad por su sal potásica (tártaro), fue aislado por primera vez por Scheele en el siglo XVIII. Berzelius determinó su estructura en 1830. El trabajo innovador de Pasteur (1848-1860) sobre las sales del ácido tartárico revolucionó la química orgánica.
Explicó la conexión entre las formas racémicas y ópticamente activas separando cristales de tartrato de sodio y amonio y demostrando sus correspondientes rotaciones ópticas.
El ácido L(+)-tartárico es la forma natural predominante y la variante producida comercialmente. Se encuentra como ácido o sal en varias plantas, particularmente en las uvas, donde se acumula como bitartrato de potasio (tártaro) durante la fermentación del vino. Este precipitado insoluble es la fuente principal para la producción comercial de ácido L(+)-tartárico.
Tabla de contenido
1. Propiedades físicas del ácido tartárico
Las propiedades físicas del ácido L(+)-tartárico natural se dan en la Tabla 1 y son idénticas a las del ácido D(-)-tartárico.
El ácido tartárico es un sólido inodoro con un fuerte sabor ácido que es estable en el aire.
Las soluciones de ácido tartárico tienen una rotación óptica que varía según la concentración, como lo representa la siguiente ecuación:
[α] =15,050-0,1535c
donde c es la concentración de ácido tartárico en el rango de 20 a 50% peso/vol.
La Tabla 2 presenta la solubilidad a diversas temperaturas.
A diversas temperaturas (°C), la densidad relativa de las soluciones de ácido tartárico se enumera en la Tabla 3.
| Propiedad | Valor |
|---|---|
| Masa molecular | 150,09 g/mol |
| Forma cristalina | Agujas monoclínicas anhidras (por encima de 5 °C) |
| Densidad | 1,7598 g/cm³ |
| Punto de fusión | 169-170 °C |
| Apariencia | Cristales incoloros |
| Descomposición | Más de 220 °C (olor a azúcar caramelizado) |
| Solubilidad | |
| Agua | Altamente soluble |
| Alcohol (18 °C) | 20,4 g por 100 g |
| Éter dietílico (18 °C) | 0,3 g por 100 g |
| Rotación óptica al 20% peso/vol | +11,98° (-11,98° para el ácido D(-)-tartárico) |
| Entalpía de combustión | 1149,9 kJ/mol |
| Capacidad calorífica específica (0-100 °C) | 1237 kJ kg⁻¹ K⁻¹ |
| Constantes de disociación ácida (25 °C) |
K₁ = 1,17 × 10⁻³ K₂ = 5,0 × 10⁻⁵ |
| Puntos de ebullición de las soluciones |
Solución al 25%: 102,2 °C Solución al 50%: 106,7 °C |
| Índice de refracción en el punto de fusión (170 °C) | 1.464 |
| Temperatura (°C) | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Solubilidad (g/100 g H₂O) | 115 | 120 | 125 | 139 | 156 | 176 | 195 | 218 | 244 | 273 | 307 | 343 |
| Temperatura (°C) | Densidad |
|---|---|
| 1 | 1,0045 |
| 10 | 1,0469 |
| 20 | 1,0969 |
| 30 | 1.1505 |
| 40 | 1,2078 |
| 50 | 1,2696 |
2. Reacciones químicas del ácido tartárico
El ácido L(+)-tartárico se funde entre 170-180 °C y se isomeriza (reorganiza su estructura) a ácido metatartárico sin pérdida de agua. Un calentamiento adicional produce anhídridos amorfos. Estos anhídridos se convierten en ácido tartárico al hervir con agua.
Por encima de 220 °C, el ácido tartárico se descompone, se hincha y se inflama, dejando un residuo carbonoso.
El ácido tartárico es muy sensible a los agentes oxidantes. La oxidación del ácido tartárico por peróxido de hidrógeno y sulfato ferroso (reactivo de Fenton) produce ácido dioxosuccínico.
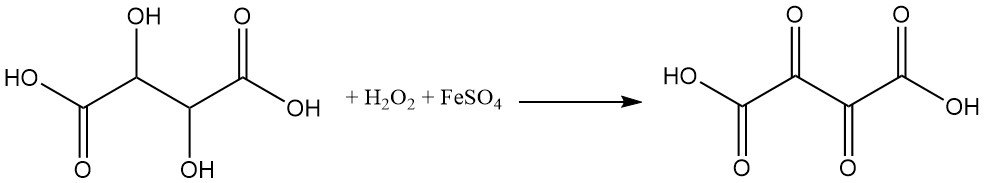
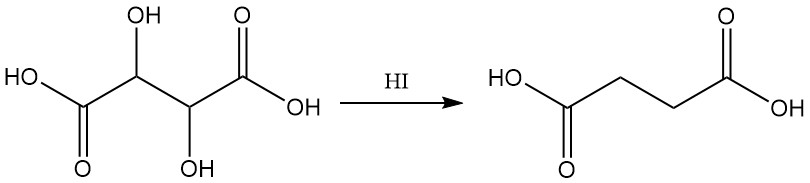
La reducción con ácido yodhídrico produce ácido succínico.
Los tartratos en solución reaccionan con nitrato de amonio y plata para producir plata metálica.
El ácido tartárico se utiliza como agente complejante para inhibir la precipitación de sales de metales pesados por las bases.
La ebullición prolongada de soluciones de ácido L(+)-tartárico con álcalis (KOH o NaOH) da como resultado la formación de compuestos racémicos y Ácidos mesotartáricos.
3. Recursos naturales del ácido tartárico
El ácido L(+)-tartárico es el único isómero producido comercialmente a gran escala. La materia prima exclusiva proviene de residuos naturales generados durante la elaboración del vino. Estos residuos contienen principalmente ácido tartárico en forma de bitartrato de potasio (cremor tártaro) y, en menor medida, tartrato de calcio.
Las fuentes de ácido tartárico son las siguientes:
- tártaro es un precipitado rojizo que se deposita en las paredes de las tinas de vino a medida que aumenta la concentración de etanol. Contiene una alta concentración (80-90%) de bitartrato de potasio.
- Lías: estos sedimentos se depositan en el fondo de las tinas de vino y contienen una concentración más baja (19-38 %) de bitartrato de potasio.
- Lías secas: son lías procesadas con un mayor contenido de bitartrato de potasio (55-70%).
- Subproducto de destilería: las destilerías obtienen este material a partir de lías de vino o orujos de uva (los sólidos sobrantes después del prensado de la uva). Después de eliminar el alcohol por destilación, las lías o orujos se tratan con hidróxido de calcio para precipitar el tartrato de calcio.
4. Producción de ácido tartárico
Si bien existen múltiples isómeros del ácido tartárico, el ácido L(+)-tartárico es el único isómero producido comercialmente a gran escala. También se sintetiza una cantidad muy pequeña de ácido racémico para aplicaciones específicas.
4.1. Producción de ácido L(+)-tartárico
Los principales productores de ácido L(+)-tartárico se encuentran en España, Francia e Italia. Por ejemplo, la Société Legré-Mante, fundada en 1784, es uno de los productores más antiguos.
Todos los métodos para la producción de ácido L(+)-tartárico se basan en la descomposición del tartrato de calcio con ácido sulfúrico. Históricamente, se emplearon dos métodos competitivos para obtener el material de partida (tartrato de calcio): el proceso ácido Scheurer-Kestner y el proceso neutro Scheele-Lowitz (incluida la variante Desfosses).
Actualmente, el proceso neutro, más económico, es el método dominante.
El material de partida seco (tártaro o lías) se muele primero y luego se tuesta a 160 °C durante 2 horas en un tostador. Este paso elimina impurezas orgánicas que podrían dificultar la filtración en etapas posteriores.
El producto tostado caliente se transfiere a un reactor, donde se diluye con agua y se neutraliza con hidróxido de calcio hasta un pH de 5. La temperatura de reacción se mantiene a 70 °C.
Para mejorar la eficiencia de la reacción y minimizar las pérdidas, se añade un exceso de 10 % de cloruro de calcio o sulfato de calcio en comparación con la cantidad estequiométrica requerida. Tiene lugar la siguiente reacción química:
2 KHC4H4O6 + Ca(OH)2 + CaCl2 → 2 CaC4H4O6 + 2 KCl + 2 H2O
El tartrato de calcio formado se separa del líquido restante (licor madre) mediante filtración usando un filtro rotatorio y luego se lava. Si el material de partida procede de destilerías, se podrá evitar esta etapa inicial.
En la segunda etapa, el tartrato de calcio obtenido se descompone en una solución acuosa utilizando ácido sulfúrico. Esta reacción produce una solución de ácido tartárico y sulfato de calcio insoluble:
CaC4H4O6 + H2SO4 → H2C4H4O6 + CaSO4
Se utiliza un exceso de aproximadamente un 5% de ácido sulfúrico en comparación con la cantidad de ácido tartárico para optimizar la reacción. La mezcla resultante se filtra y se lava para eliminar impurezas.
La solución de ácido tartárico rojo, con una concentración de alrededor de 200 g/L, se concentra luego en evaporadores de vacío a 70 °C para alcanzar una concentración de 650 g/L. Se produce una concentración adicional al vacío a 70 °C hasta que comienzan a formarse cristales (a aproximadamente 1300 g/l).
Esta mezcla de cristal líquido luego se transfiere a cristalizadores para un enfriamiento lento, promoviendo el máximo rendimiento cristalino. Después de enfriar, la mezcla se seca en centrífugas para separar los cristales de las aguas madre.
El licor madre, que todavía contiene ácido tartárico, se somete a ciclos repetidos de evaporación, granulación y secado para maximizar el rendimiento de ácido tartárico granulado. Los gránulos obtenidos se enfrían para formar una solución de ácido tartárico de 650 g/l.
Esta solución se somete a un procesamiento adicional, que incluye decoloración con carbón activado y purificación química para eliminar el exceso de hierro y ácido sulfúrico, todo realizado a 70 °C. Luego se filtra y se concentra al vacío hasta que comienza la cristalización.
Posteriormente, la mezcla se transfiere a cristalizadores o se enfría para maximizar el rendimiento cristalino. A continuación se separa la mezcla mediante centrifugación. Las aguas madre, que contienen ácido tartárico residual, se someten a ciclos adicionales de evaporación, granulación y secado antes de volver a tratarse.
Los gránulos purificados se secan en un horno a 140 °C y luego se tamizan en varios tamaños de grano que van desde 2000 μm hasta menos de 100 μm (polvo).
Si bien el proceso descrito anteriormente es el método principal, se han explorado otros procesos de producción. Estos incluyen la producción basada en fermentación de ácido L(+)-tartárico y la síntesis química de ácido DL-tartárico racémico.
4.2. Producción de ácido L(+)-tartárico mediante fermentación
Si bien el método de producción convencional de ácido L(+)-tartárico se basa en reacciones químicas, se están investigando alternativas basadas en la fermentación.
Para este fin se han explorado dos cepas bacterianas principales:
- Acetobacter suboxydans: esta especie bacteriana ha sido investigada por su capacidad para convertir la glucosa en ácido L(+)-tartárico.
- Nocardia tartaricans: esta bacteria se muestra prometedora a la hora de convertir el ácido cis-epoxisuccínico y sus derivados de sodio en el producto deseado.
4.3. Síntesis química del ácido DL-tartárico racémico
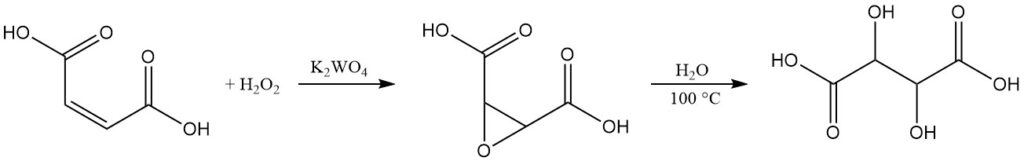
Si bien el ácido L(+)-tartárico domina el mercado comercial, existe un proceso de producción a pequeña escala para el ácido DL-tartárico racémico.
Este método comienza con ácido maleico o sus sales. En una solución acuosa, el ácido maleico se oxida utilizando peróxido de hidrógeno al 35% en presencia de tungstato de potasio como catalizador. Esta reacción produce ácido epoxi-succínico, un producto intermedio.
Al hervir la mezcla de reacción, el ácido epoxisuccínico se hidroliza para formar ácido tartárico racémico. Después de enfriar, el producto final se aísla mediante centrifugación, lavado y secado.
Se han explorado y documentado varias variaciones de este proceso en publicaciones científicas. Esta actividad de investigación se refleja además en numerosas solicitudes de patente presentadas para este método.
Actualmente, la producción comercial de ácido DL-tartárico racémico sigue siendo limitada, con sólo una pequeña unidad de producción operativa en Sudáfrica.
5. Derivados del ácido L(+)-tartárico
El ácido tartárico forma fácilmente numerosas sales y ésteres, y algunos encuentran importantes aplicaciones comerciales. Esta sección analiza los compuestos más conocidos.
5.1. Tartrato de sodio y potasio
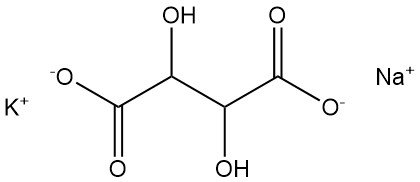
El tartrato de sodio y potasio, también conocido como sal de Seignette o sal de Rochelle, fue descubierto en 1672 por Pierre Seignette.
Propiedades físicas:
- Fórmula: KNaC4H4O6 · 4 H2O
- Número CAS: [6381-59-5]
- Masa molar: 282,23 g/mol
- Densidad: 1,79 g/cm³
- Punto de fusión: 70–80 °C (se descompone a 220 °C)
- Solubilidad: 26 g/100 ml de agua a 0 °C, 66 g/100 ml de agua a 26 °C
La materia prima para la producción de tartrato de sodio y potasio es el sarro con un contenido mínimo de ácido tartárico del 68%.
Esta solución se diluye con agua, se neutraliza con hidróxido de sodio caliente, se decolora con carbón activo y luego se filtra. El filtrado se concentra por evaporación y luego se cristaliza mediante enfriamiento para producir la sal sólida, que se separa, se lava, se seca y se tamiza antes de envasar.
Los tamaños de grano comerciales varían desde 2000 μm hasta < 250 µm (polvo).
5.2. Bitartrato de potasio
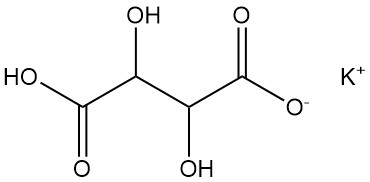
El bitartrato de potasio se conoce comúnmente como crémor tártaro.
Propiedades físicas:
- Fórmula: KHC4H4O6
- Número CAS: [868-14-4]
- Densidad: 1,96 g/cm³
- Solubilidad: 0,57 g/100 ml de agua a 20 °C, 6,1 g/100 ml de agua a 100 °C
Se obtiene principalmente de las aguas madres que quedan tras la producción de sal de Rochelle. El bitartrato de potasio se decolora, se purifica, se filtra, se acidifica con ácido clorhídrico o ácido sulfúrico, se precipita, centrifugado, secado, molido y envasado como un polvo fino.
5.3. Tartrato de antimonio y potasio
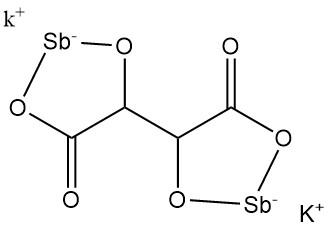
El tartrato de potasio y antimonio (emético tártaro) fue descubierto en 1631 por Adrien de Mynsicht.
Propiedades físicas:
- Fórmula: KSbC4H2O6 · 1,5 H2O
- Número CAS: [28300-74-5]
- Masa molar: 333,93 g/mol
- Densidad: 2,61 g/cm³
- Solubilidad: 8,7 g/100 ml de agua a 25 °C, 35,7 g/100 ml de agua a 100 °C
El tartrato de antimonio y potasio se produce mediante la reacción de óxido de antimonio con cremor tártaro en agua, seguido de la concentración de la solución residual y la cristalización. Después de la filtración, los cristales se secan y se pulverizan.
5.4. Ácido metatartárico
El ácido metatartárico se produce calentando el ácido tartárico a 170-180 °C. Esta conversión implica una esterificación interna dentro de las moléculas de ácido tartárico, lo que da lugar a un producto más o menos polimerizado. El ácido metatartárico tiene propiedades inhibidoras excepcionales contra la precipitación de las sales del ácido tartárico.
6. Usos del ácido tartárico
El ácido L(+)-tartárico y sus derivados se utilizan en diversas industrias, incluidas la alimentaria, farmacéutica, vinícola y otras.
El ácido L(+)-tartárico (E 334) se utiliza:
- como agente acidificante en mostos de vino, dulces, jaleas, mermeladas, néctares de frutas, helados, gelatinas y pastas, potenciando sus perfiles de sabor.
- para conservar frutas, verduras o pescado como antioxidante sinérgico, estabilizando el pH, el color, el sabor y el valor nutricional.
- Como antioxidante en grasas y aceites.
- En la preparación de bebidas carbonatadas.
- Como excipiente o portador de ingredientes farmacéuticos activos, ayudando a corregir la basicidad.
- Como agente acidificante para tabletas y polvos espumosos debido a su estabilidad y alta solubilidad
- Como retardador en la industria del cemento, particularmente con yeso y yeso.
- En pulido y limpieza de metales.
El crémor tártaro (E 336) se utiliza para acelerar la precipitación de las sales del ácido tartárico en el vino, en la producción de levaduras químicas y como laxante en algunas formulaciones farmacológicas. .
La sal de Seignette (E 337) se utiliza en procesos de galvanoplastia para mejorar la deposición y el rendimiento, en electrónica y piezoelectricidad, como agente reductor en el plateado de espejos y como un constituyente de la solución de Fehling. También se utiliza como regulador de la combustión en la producción de papel para cigarrillos, como laxante en algunos productos farmacéuticos y como mordiente en las industrias textil y del cuero.
En pequeñas cantidades, el tartrato de potasio y antimonilo se utiliza como expectorante en jarabes para la tos y ayuda en el tratamiento de algunas enfermedades tropicales.
El ácido metatartárico se utiliza para inhibir la cristalización del tartrato en los vinos de mesa.
Los tartratos de monoglicéridos y diglicéridos de ácidos grasos se utilizan como emulsionantes en la industria de la panadería.
7. Toxicología del ácido tartárico
A diferencia del ácido cítrico, el ácido tartárico no participa directamente en el ciclo de Krebs (vía de producción de energía) en el cuerpo humano.
El ácido L(+)-tartárico, la forma natural, se encuentra en las frutas y el vino. Después de la ingesta oral, aproximadamente el 20% se elimina a través de la orina, mientras que una parte significativa sufre degradación bacteriana por parte de la microbiota intestinal. No se detectan rastros en las heces.
El ácido tartárico absorbido se elimina rápidamente del torrente sanguíneo y se excreta por los riñones o se metaboliza en diversos tejidos.
Los estudios a largo plazo en ratas que utilizaron tartrato de L(+)-sodio no han revelado ningún signo de toxicidad o carcinogenicidad. Además, no se observaron efectos negativos sobre la función o patología renal con una dosis diaria de 3 g/kg de peso corporal.
El ácido racémico (DL)-tartárico se ha estudiado menos y las investigaciones sugieren que se comporta de manera diferente al isómero L(+) natural.
El ácido DL-tartárico se elimina del torrente sanguíneo a un ritmo más lento y se acumula durante más tiempo en los riñones, provocando potencialmente un aumento de peso en estos órganos. Debido a este efecto nefrotóxico, la forma DL no está aprobada para su uso en alimentos o productos farmacéuticos.
Referencias
- Tartaric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_163
- Tartaric Acid; Van Nostrand’s Encyclopedia of Chemistry. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471740039.vec2453
- Organic Acids in Fruits. https://onlinelibrary.wiley.com/doi/abs/10.1002/9781119431077.ch8
- Tartaric acid. https://www.sciencedirect.com/science/article/abs/pii/B9780128190968000197
