Ácido sulfámico: propiedades, reacciones, producción y usos
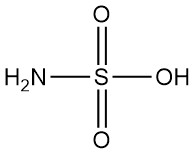
¿Qué es el ácido sulfámico?
El ácido sulfámico, también conocido como ácido amidosulfúrico, es un ácido inorgánico fuerte con la fórmula química H3NSO3. Es un sólido blanco, inodoro, cristalino y no higroscópico que se disocia fuertemente en agua.
El ácido sulfámico se ha fabricado industrialmente durante aproximadamente medio siglo. Durante el período de 1950 a 1980, se establecieron instalaciones de producción en varias naciones industrializadas en previsión de una mayor demanda del mercado.
Sin embargo, las posteriores disminuciones en la demanda del producto, junto con los desafíos de producción y las dificultades relacionadas con la eliminación de subproductos, llevaron al cierre de todas las plantas de fabricación en Europa y Estados Unidos. La producción continúa en Japón (Nissan) y en Taiwán (varios fabricantes).
Tabla de contenido
1. Propiedades físicas del ácido sulfámico
El ácido sulfámico es un sólido blanco, cristalino y no volátil a temperatura ambiente. Forma una solución acuosa de ácido fuerte con un pH de 1,18 para una solución de solo el 1 %. La solubilidad del ácido sulfámico en agua aumenta al agregar otros ácidos o sales y muestra una solubilidad limitada en ácidos inorgánicos concentrados y la mayoría de los solventes orgánicos.
La solubilidad en agua depende de la temperatura, como se detalla en la Tabla 1.
| Temperatura (°C) | Solubilidad (g/100 g) | Concentración (% en peso) |
|---|---|---|
| 0 | 14,7 | 12,8 |
| 10 | 18,5 | 15,6 |
| 20 | 21,3 | 17,5 |
| 30 | 26,1 | 20,7 |
| 40 | 29,5 | 22,8 |
| 50 | 32,8 | 24,7 |
| 60 | 37,1 | 27,0 |
| 70 | 41,9 | 29,5 |
| 80 | 47,0 | 32,0 |
Las propiedades físicas importantes del ácido sulfámico se dan en la siguiente tabla.
| Propiedad | Valor |
|---|---|
| Número CAS | [5329-14-6] |
| Fórmula química | H3NSO3 |
| Peso molecular | 97,1 g/mol |
| Punto de fusión | 205 °C |
| Constante de disociación | 1,10 x 10-1 |
| Densidad a 25 °C | 2,126 g/cm3 |
| Calor específico | 1,1467 J/g |
| Presión de vapor a 20 °C | 0,8 Pa |
| Presión de vapor a 100 °C | 0,25 Pa |
2. Reacciones químicas del ácido sulfámico
Al calentar el ácido sulfámico por encima de los 209 °C, se descompone en trióxido de azufre, dióxido de azufre, agua, amoníaco y nitrógeno.
Las soluciones acuosas de ácido sulfámico se hidrolizan para formar sulfato de hidrógeno de amonio:
NH2SO3H + H2O → NH4HSO4
La velocidad de hidrólisis depende de la concentración, el pH y la temperatura. Las soluciones acuosas diluidas son estables a temperatura ambiente. Una solución al 10 % de ácido sulfámico se hidroliza al 50 % a una temperatura de 80 °C durante 10 horas.
El ácido sulfámico se puede oxidar en presencia de cloro, bromo y cloratos para producir ácido sulfúrico.
2 NH2SO3H + KClO3 → 2 H2SO4 + N2 + KCl + H2O
Al calentar ácido nítrico concentrado con ácido sulfámico, se forma óxido de dinitrógeno.
NH2SO3H + HNO3 → H2SO4 + N2O + H2O
El ácido nitroso reacciona completamente con el ácido sulfámico para producir nitrógeno y ácido sulfúrico, por lo que esta reacción se puede utilizar para el análisis cuantitativo.
NH2SO3H + HNO2 → H2SO4 + H2O + N2
La reacción con cloruro de tionilo da como resultado la formación de cloruro de sulfamilo:
NH2SO3H + SOCl2 → ClSO2NH2 + SO2 + HCl
El ácido sulfámico disuelve hidróxidos, óxidos y carbonatos metálicos.
Los alcoholes primarios y secundarios reaccionan con el ácido sulfámico para formar sulfatos de alquilamonio.
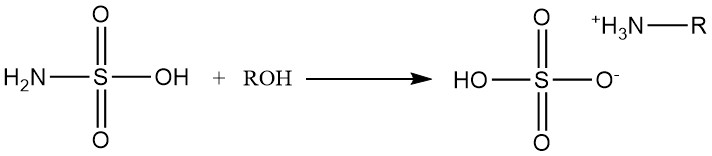
Las reacciones con alcoholes secundarios requieren la presencia de catalizadores de amina, y los alcoholes terciarios no reaccionan con el ácido sulfámico.
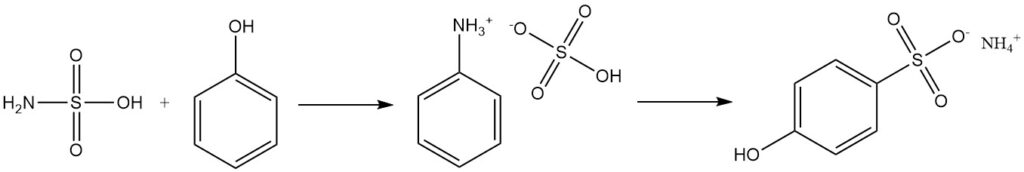
Los alcoholes aromáticos como el fenol reaccionan con el ácido sulfámico para producir sulfonatos, con sulfato de fenilamonio como intermediario.
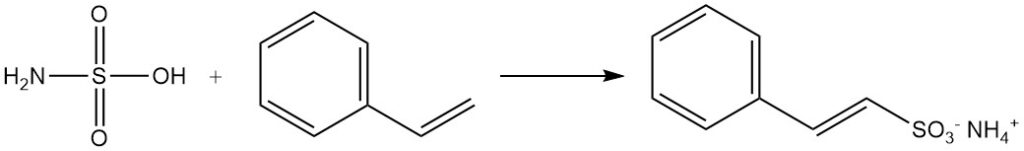
Los aldehídos forman productos de adición con las sales de ácido sulfámico. Los compuestos aromáticos con cadenas laterales insaturadas, como el estireno, sufren sulfonación por acción del ácido sulfámico, conservando al mismo tiempo el doble enlace de la cadena lateral.
3. Producción de ácido sulfámico
La producción de ácido sulfámico utiliza exclusivamente el proceso de urea, y las plantas que utilizan amoníaco y trióxido de azufre han dejado de funcionar.
El ácido sulfámico se produce directamente mediante la reacción de cantidades equimolares de urea, trióxido de azufre y ácido sulfúrico.
NH2CONH2 + SO3 + H2SO4 → 2 NH2SO3H + CO2
Esta reacción es fuertemente exotérmica e implica un proceso de dos etapas, de acuerdo con las siguientes reacciones:
NH2CONH2 + SO3 → NH2CONHSO3H
NH2CONHSO3H + H2SO4 → 2 NH2SO3H + CO2
En la etapa inicial, la urea se agita con exceso de ácido sulfúrico y trióxido de azufre. La temperatura se mantiene por debajo de los 40 °C para inhibir la formación de dióxido de carbono. La segunda etapa implica la reacción del producto de la primera etapa en presencia de un exceso de trióxido de azufre a un rango de temperatura de 50 a 80 °C para producir ácido sulfámico y dióxido de carbono.
Después de la eliminación del exceso de trióxido de azufre, se obtiene ácido sulfámico con una pureza superior al 95% y se obtiene un producto de alta pureza por recristalización.
Según una patente de Nissan, el ácido sulfámico se produce mediante la reacción de urea con óleum (xH2SO4 · ySO3).
El producto de reacción se recristaliza en húmedo, seguido de la separación y el secado del ácido cristalizado. La molienda a alta presión con una presión que varía de 600 a 1500 kg/m2 da como resultado un producto cristalino fino con un diámetro de partícula promedio de ≤ 500 μm.
4. Usos del ácido sulfámico
El ácido sulfámico se utiliza principalmente para sintetizar ciclamato (1), que es un edulcorante artificial.
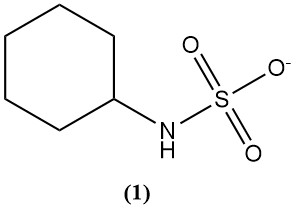
El ácido sulfámico también se utiliza en productos de limpieza para eliminar depósitos de carbonato y fosfato, como las incrustaciones de las calderas, debido a su capacidad para formar sales solubles y su relativamente baja corrosividad hacia los metales.
Se utiliza para limpiar maquinaria e instrumentos en industrias como la del papel, el azúcar, los productos lácteos y la elaboración de cerveza, así como para eliminar depósitos en plantas de evaporación, intercambiadores de calor y sistemas de refrigeración.
Algunos países utilizan el ácido sulfámico para tratar alcoholes grasos o etoxilados en un proceso a escala industrial para producir precursores de cera.
El ácido sulfámico también se utiliza como estabilizador de cloro, en la producción de tintes, en procesos de galvanoplastia y en las industrias del papel y los textiles.
En los laboratorios, se emplea en química analítica.
5. Toxicología del ácido sulfámico
Se considera generalmente que el ácido sulfámico tiene una toxicidad baja. Sus propiedades fisiológicas son características de un ácido mineral fuerte.
El polvo de ácido sulfámico puede irritar las membranas mucosas de la nariz y la faringe, así como la conjuntiva de los ojos. Este es un efecto común de muchos ácidos fuertes.
Se ha descubierto que la administración oral de 1,6 g/kg de ácido sulfámico a ratas es letal. Esto indica un cierto nivel de toxicidad, pero es esencial tener en cuenta que se trata de una dosis relativamente alta y que el estudio se realizó en ratas. La toxicidad humana puede variar.
El ácido sulfámico, al igual que otros ácidos fuertes, es corrosivo para la piel, los ojos y el tracto respiratorio. Se debe evitar el contacto directo.
Los procedimientos de manipulación adecuados, incluido el uso de equipos de protección individual (EPI), como guantes, gafas y protección respiratoria, son esenciales cuando se trabaja con ácido sulfámico.
Referencia
- Sulfamic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a25_439
