Ácido málico: propiedades, producción y usos
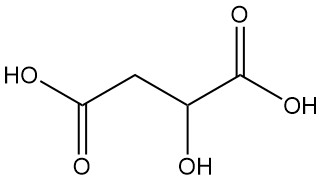
¿Qué es el ácido málico?
El ácido málico, también conocido como ácido hidroxisuccínico o ácido hidroxibutanodioico, es un ácido dicarboxílico con la fórmula química C4H6O5. Es un compuesto orgánico natural que se caracteriza por un sabor ácido.
Fue descrito por primera vez por Sheele, quien en 1785 aisló este ácido de manzanas verdes. El nombre málico proviene del latín malum, que significa manzana.
El ácido málico es un componente de varias frutas, en particular de las manzanas. En los sistemas biológicos, el ácido málico, en su forma ionizada, el malato, actúa como intermediario en el ciclo del ácido tricarboxílico. Esta vía metabólica es crucial para la producción de energía.
El isómero L del ácido málico es la forma predominante que se encuentra en la naturaleza y posee actividad biológica. Si bien se lo conoce principalmente por su papel en la aromatización de los alimentos, la evidencia emergente sugiere posibles beneficios para la salud humana.
El ácido málico participa en el metabolismo energético, en particular en condiciones de hipoxia. Los estudios indican su potencial para mejorar el rendimiento físico y aliviar los síntomas asociados con la fibromialgia.
El metabolismo del ácido málico está influenciado por enzimas como la enzima málica. Esta enzima cataliza la descarboxilación oxidativa del malato a piruvato. El piruvato generado puede sufrir otras transformaciones metabólicas, incluida la conversión a glucosa u oxaloacetato.
El ácido málico muestra propiedades antimicrobianas. Su naturaleza ácida contribuye a la conservación de los alimentos al inhibir el crecimiento microbiano. Sin embargo, su eficacia se ve influenciada por factores como el pH y las especies microbianas específicas.
Tabla de contenido
| Propiedad | Valor |
|---|---|
| Número CAS | [617-48-1] |
| Fórmula química | C4H6O5 |
| Masa molecular | 134,09 g/mol |
| Punto de fusión | 131 °C |
| Densidad | 1,60 g/cm3 |
| Viscosidad de una solución acuosa al 50% a 25 °C | 6,5 mPa.s |
| Calor de combustión a 20 °C | -1,340 MJ/mol |
| pKa1 a 20 °C | 3,51 |
| pKa2 a 20 °C | 5,03 |
| Propiedad | Valor |
|---|---|
| Número CAS | [97-67-6] |
| Punto de fusión | 100 °C |
| Densidad a 20 °C | 1,595 g/cm3 |
| Rotación específica a 18 °C (7 % en peso en H2O) | -2,3° |
| Solubilidad en agua a 20 °C | 36,4 g/100 g |
2. Reacciones químicas del ácido málico
Debido a la presencia de ácido carboxílico y grupos funcionales hidroxilo en el ácido málico, este puede experimentar una variedad de reacciones químicas.
Como ácido carboxílico, el ácido málico reacciona con bases para formar sales, como malato de sodio o malato de potasio.
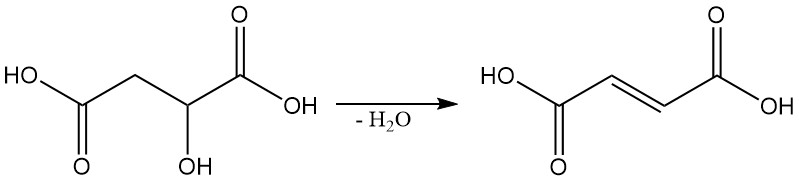
En condiciones específicas, el ácido málico se puede deshidratar para producir ácido fumárico.
La descarboxilación del ácido málico produce ácido pirúvico.
El ácido málico puede reaccionar con alcoholes para formar ésteres, que se utilizan a menudo como agentes aromatizantes.
El ácido málico se puede oxidar para producir diversos productos, como ácido oxalacético, ácido oxálico y dióxido de carbono, según las condiciones.
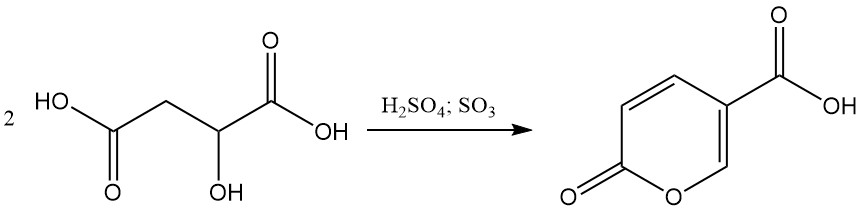
En presencia de ácido sulfúrico fumante entre un 20% y un 30%, el ácido málico sufre una autocondensación para formar ácido cumálico.
El ácido málico puede formar complejos con iones metálicos como el calcio y el magnesio.
La fermentación maloláctica es un proceso común en la elaboración del vino, en el que el ácido málico se convierte en ácido láctico por acción de las bacterias. También es un intermediario en el ciclo de Krebs, en el que sufre una oxidación a ácido oxalacético.
3. Producción de ácido málico
3.1. Producción química de ácido málico
La síntesis de ácido málico se basa principalmente en procesos químicos, produciendo ácido D,L-málico racémico. El precursor, el anhídrido maleico, se deriva de hidrocarburos fósiles, principalmente n-butano. El benceno, una antigua materia prima, sigue utilizándose, sobre todo en los países asiáticos.
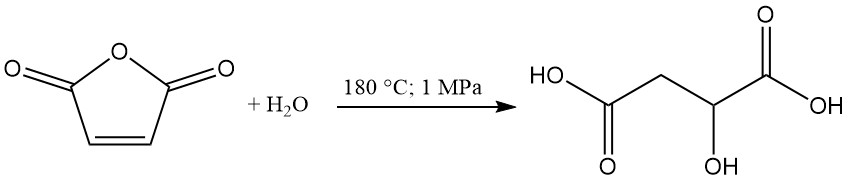
El ácido (R,S)-málico se produce industrialmente en Estados Unidos y Canadá mediante la hidratación del anhídrido maleico. Alberta Gas es el único fabricante estadounidense con una capacidad de producción de aproximadamente 5000 toneladas métricas anuales.
En este proceso, el anhídrido maleico se calienta a 180 °C bajo una presión de 1 MPa para formar ácido málico como producto primario. El ácido maleico y el ácido fumárico se generan como subproductos. El ácido fumárico, debido a su baja solubilidad en agua, se puede separar por filtración y reciclar.
La concentración posterior del filtrado da lugar al ácido málico. El ácido crudo se purifica mediante lavado, evaporación y recristalización repetidos para reducir las impurezas de ácido fumárico y maleico a 7,5 y <500 ppm, respectivamente.
Para obtener ácido málico de calidad farmacéutica, son necesarios pasos de purificación adicionales.
3.2. Producción enzimática de ácido L-málico
El ácido L-málico enantiopuro, que se prefiere para productos farmacéuticos y polímeros, es difícil de obtener mediante la resolución del ácido D,L-málico racémico. La síntesis enzimática ofrece una alternativa selectiva y más suave.
La hidratación catalizada por fumarasa del ácido fumárico a ácido L-málico es el principal proceso enzimático. Esto se puede lograr utilizando enzimas purificadas, células permeabilizadas o liofilizadas o células completas.
Los microorganismos como Saccharomyces cerevisiae, Brevibacterium flavus, Brevibacterium ammoniagenes y Rhizopus oryzae muestran altas tasas de conversión entre el 80% y ≈100% en la catálisis de células completas. La inmovilización hace que el proceso sea más económico al permitir que el catalizador sea reutilizable.
3.3. Biosíntesis de ácido málico por microorganismos
La producción de ácido málico por microorganismos ofrece ventajas con respecto a la síntesis química, entre ellas, la formación exclusiva de ácido L-málico y el uso de sustratos diversos y renovables.
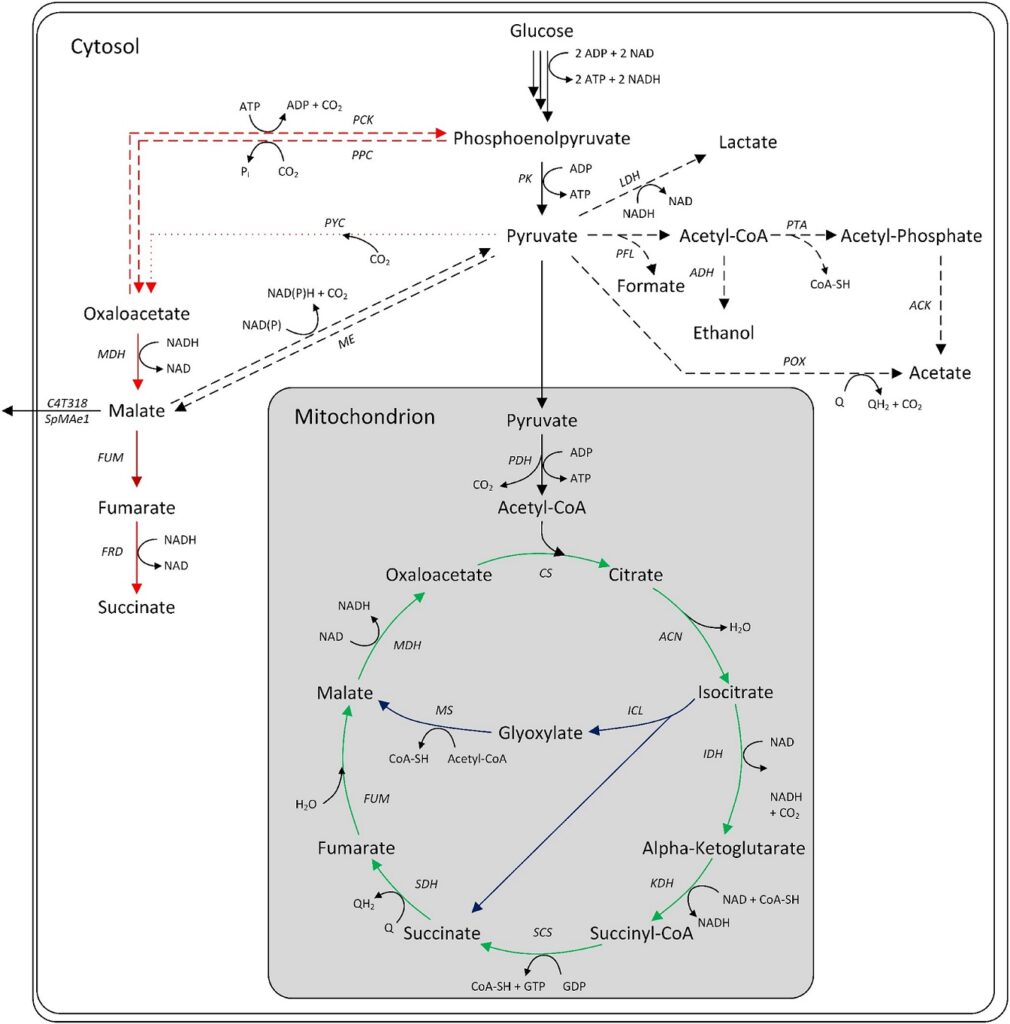
Existen tres vías intracelulares primarias para la producción de ácido málico microbiano: el ciclo del ácido tricarboxílico oxidativo (TCA), el ciclo del TCA reductor (rTCA) y el ciclo del glioxilato. El TCA oxidativo, ubicado en la mitocondria, convierte el acetil-CoA en citrato, que posteriormente se oxida a L-malato con pérdida de dióxido de carbono.
El rendimiento teórico máximo es de 1 mol/mol. Algunas especies de Aspergillus poseen isoformas citosólicas del TCA, lo que permite una vía reductora del TCA. Esta ruta neutra en ATP carboxila el piruvato en oxaloacetato, que se convierte en L-malato por la malato deshidrogenasa. Es posible un rendimiento teórico de 2 mol/mol de glucosa.
El ciclo del glioxilato convierte el citrato en succinato y glioxilato, con posterior condensación a L-malato. El rendimiento máximo es de 1 mol/mol, que puede aumentar hasta 1,33 mol/mol si el oxaloacetato consumido se repone mediante la carboxilación del piruvato.
Los microorganismos utilizados en la producción de ácido L-málico incluyen microorganismos naturales (como Aspergillus flavus, Aspergillus oryzae, Ustilago trichophora y Rhizopus delemar) y hongos y bacterias modificados genéticamente.
4. Usos del ácido málico
El ácido (R,S)-málico comparte propiedades fisicoquímicas con el ácido cítrico y el ácido tartárico, pero posee un perfil de sabor más suave. Esta característica favorece su aplicación en productos alimenticios donde la acidez del ácido cítrico no es deseable. Algunos ejemplos incluyen el envasado de alimentos y la repostería.
En la industria alimentaria, el ácido málico se utiliza ampliamente (alrededor del 85-90%) como acidulante y regulador de la acidez. Su sabor difiere del del ácido cítrico, ofreciendo una acidez menos intensa pero más duradera. Esta propiedad ayuda a enmascarar el regusto de los edulcorantes artificiales y a crear perfiles de sabor equilibrados en las bebidas.
Las interacciones sinérgicas entre el ácido málico y los edulcorantes permiten una reducción de edulcorante de hasta el 20% y un potencial ahorro de costos. El uso de ácido málico anhidro en polvo ofrece ventajas económicas adicionales.
Las principales aplicaciones incluyen confitería, mermeladas, jaleas y frutas y verduras enlatadas. Las regulaciones sobre aditivos alimentarios en la mayoría de los países permiten su uso.
Los ácidos málicos enantioméricos, ácido (R)-(+)-málico y ácido (S)-(-)-málico, se pueden obtener a partir de la resolución del ácido (R,S)-málico o por fermentación microbiana del ácido fumárico.
Más allá de la industria alimentaria, el ácido málico se utiliza como tampón y agente quelante en productos de limpieza y cuidado personal. Las aplicaciones farmacéuticas incluyen su uso como componente de medicamentos, mientras que la fabricación de semiconductores lo utiliza en procesos de pulido y limpieza.
Además, el ácido málico se emplea en piensos para animales y como componente de mezclas de baja temperatura de transición.
El ácido málico es un ácido dicarboxílico, lo que permite su uso como bloque de construcción de polímeros. Los copolímeros y homopolímeros de ácido málico presentan propiedades como hidrofilicidad, biocompatibilidad y biodegradabilidad, encontrando aplicaciones potenciales en campos como la administración de fármacos y la ciencia de los materiales.
Entre los principales fabricantes de ácido málico se encuentran Bartek (Canadá), las empresas japonesas Fuso Chemical y Mitsubishi Corporation Life Sciences, Isegen (Sudáfrica), Polynt (Italia), Thirumalai Chemicals (India), las empresas chinas Changmao Biochemical Engineering Company, Anhui Sealong Biotechnology y Jinhu Lile Biotechnology Industry, así como Tate & Lyle (Reino Unido) y Yongsan Chemicals (Corea).
5. Toxicología del ácido málico
El ácido málico muestra una baja toxicidad aguda en pruebas con animales. Los valores de LD50 oral varían de 1,6 a 5 g/kg en todas las especies. Los valores de LD50 intravenosos e intraperitoneales son significativamente más bajos.
Los estudios orales crónicos en ratas y perros revelaron efectos adversos mínimos, que incluyeron principalmente alteraciones menores en el peso corporal y el consumo de alimento. Los estudios de toxicidad reproductiva arrojaron resultados negativos.
Los estudios dermatológicos indican irritación moderada de la piel en conejos e irritación ocular grave en conejos. El ácido málico es un fuerte irritante para la piel de los conejillos de indias.
Las evaluaciones de mutagenicidad arrojaron resultados inconsistentes. El ácido málico en sí no fue mutagénico en varios ensayos, pero sus pirolizados y derivados clorados mostraron propiedades mutagénicas.
Los estudios de irritación de la piel informaron efectos dependientes de la dosis, y un pH más alto se correlacionó con una mayor irritación. Las pruebas predictivas en pacientes con dermatitis atópica indicaron una posible reactividad de la piel a las dietas ricas en ácido málico. El ácido málico también influyó en las tasas de renovación celular según los valores de pH.
Los ensayos clínicos de eficacia y seguridad no informaron toxicidad.
Los estudios de toxicidad crónica sobre el ácido málico en ratas y perros establecieron niveles sin efecto observado (NOEL) de 5000 ppm y 50000 ppm, respectivamente.
Los datos de toxicidad crónica del ácido fumárico en ratas indican un nivel sin efecto adverso observado (NOAEL) de aproximadamente 600 mg/kg de peso corporal/día. Dada la conversión metabólica del ácido fumárico en ácido málico dentro del ciclo de Krebs, la extrapolación entre especies se considera válida.
La evaluación de la exposición al ácido málico a partir de la concentración en la dieta en mg/kg/día arrojó resultados inciertos. Los rangos estimados variaron entre 2-200 mg/kg/día y 25-2500 mg/kg/día. La aplicación de los factores de conversión de la EFSA abordó esta incertidumbre, lo que dio como resultado un NOAEL de 260 mg/kg/día.
Referencias
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- https://scijournals.onlinelibrary.wiley.com/doi/10.1002/jctb.6269
- https://pubmed.ncbi.nlm.nih.gov/11358110/
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse9535
- https://onlinelibrary.wiley.com/doi/10.1002/9780470995327.ch157
- https://echa.europa.eu/registration-dossier/-/registered-dossier/11511/7/6/1
- https://www.orgsyn.org/demo.aspx?prep=cv4p0201
