Ácido Bencenosulfónico: Producción, Reacciones y Usos

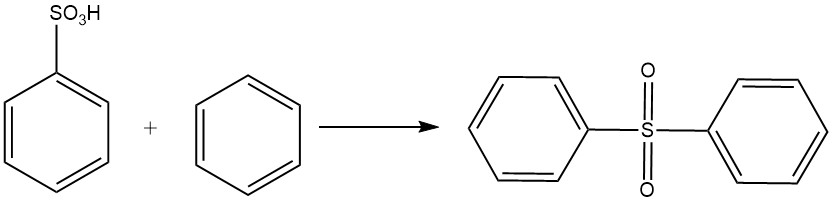
El ácido bencenosulfónico es un compuesto químico con la fórmula C6H5SO3H y un peso molecular de 158,17 g/mol. Fue sintetizado por primera vez en 1834 por E. Mitscherlich mediante la reacción de benceno y ácido sulfúrico concentrado, produciendo ácido bencenosulfónico y difenilsulfona.
Una aplicación industrial notable del ácido bencenosulfónico es la producción de fenol por fusión alcalina, una reacción iniciada por A. Wurtz y A. Kekulé en 1867 y luego refinada por P. O. Degener en 1878.
Históricamente, el ácido bencenosulfónico tuvo un papel importante en la producción de fenol. Sin embargo, en los últimos tiempos, los métodos alternativos de síntesis de fenol han ganado popularidad en los procesos industriales.
Tabla de contenido
1. Propiedades físicas del ácido bencenosulfónico
La cristalización del ácido bencenosulfónico a partir de una solución acuosa forma un hidrato que contiene 1,5 moléculas de agua, lo que da como resultado agujas delicuescentes con un punto de fusión de 43-44 °C. El monohidrato tiene un punto de fusión de 45-46 °C.
El ácido anhidro es destilable sin descomposición a 171-172 °C (0,13 mbar). Demuestra alta solubilidad en agua y etanol, solubilidad moderada en benceno e insolubilidad en éter dietílico y disulfuro de carbono.
El bencenosulfonato de sodio se descompone aproximadamente a 450 grados Celsius. Es soluble en 1,75 partes de agua a 30 °C y 0,8 partes de agua hirviendo. La cristalización en soluciones acuosas produce la sal con un mol de agua de cristalización. Las sales de calcio y bario también son solubles en agua.
| Propiedad | Valor |
|---|---|
| Apariencia | Cristales blancos delicuescentes o sólido ceroso |
| Peso molecular | 158,17 g/mol |
| Densidad | 1,48 g/cm³ |
| Punto de fusión (hidrato) | 43-44 °C |
| Punto de fusión (monohidrato) | 45-46 °C |
| Punto de fusión (anhidro) | 65-66 °C |
| Punto de ebullición | 274 °C (se descompone) |
| Punto de destilación (anhidra) | 171-172 °C (0,13 mbar) |
| Punto de inflamación | 113°C |
| Solubilidad en agua | Alto |
| Solubilidad en alcohol | Alto |
| Solubilidad en benceno | Moderado |
| Solubilidad en éter dietílico | Insoluble |
| Solubilidad en disulfuro de carbono | Insoluble |
| Constante dieléctrica (solución acuosa) | 0,2 |
| pKa | -2,8 |
| Olor | Acre |
| Temperatura de descomposición (bencenosulfonato de sodio) | 450°C |
| Solubilidad del bencenosulfonato de sodio en agua | 1,75 partes a 30 °C 0,8 partes al punto de ebullición |
| Solubilidad de las sales de calcio y bario en agua | soluble en agua |
| Peligros | Corrosivo para los ojos, la piel y el tracto respiratorio |
2. Reacciones químicas del ácido bencenosulfónico
El ácido bencenosulfónico exhibe reacciones típicas de un ácido sulfónico aromático fuerte. La hidrólisis ácida a 175 °C produce benceno y ácido sulfúrico.

Una sulfonación adicional con ácido sulfúrico fumante produce ácido 1,3-bencenodisulfónico, que se puede convertir en ácido 1,3,5-bencenotrisulfónico y ácido difenilsulfona disulfónico.

El ácido bencenosulfónico sufre una reacción tipo Friedel-Crafts con benceno para formar difenilsulfona.
El ácido bencenosulfónico reacciona con hidróxido de sodio a 320-350 °C para producir fenolato de sodio según la siguiente ecuación:
C6H5SO3Na + 2 NaOH → C6H5ONa + Na2SO3 + H2O
Esta reacción formó la base de la primera producción industrial de fenol.

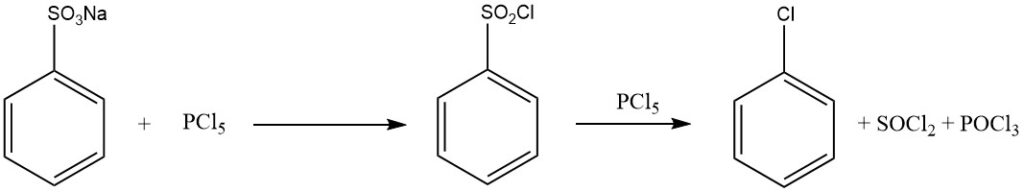
El tratamiento del ácido bencenosulfónico con halogenuros de fósforo (PCl5, PBr5), ácido clorosulfúrico, cloruro de tionilo o fosgeno produce haluros de sulfonilo:
C6H5SO2OH + PCl5 → C6H5SO2Cl + POCl3 + HCl
Cuando se utiliza un exceso de PCl5 se forma clorobenceno según:
C6H5SO2Cl + PCl5 → C6H5Cl + SOCl2 + POCl3
El anhídrido bencenosulfónico se sintetiza haciendo reaccionar ácido bencenosulfónico con P2O5, SOCl2, o SO3. También se puede formar como subproducto durante la preparación de ácido bencenosulfónico o cloruro de bencenosulfonilo. Sin embargo, en estos casos, a menudo no se observan debido a su rápida hidrólisis en ácido acuoso.

Los ésteres bencenosulfónicos se producen mediante la reacción de ácido sulfónico o cloruros de sulfonilo con alcoholes o éteres.
3. Producción de ácido bencenosulfónico
El ácido bencenosulfónico se produce mediante una reacción exotérmica entre benceno y ácido sulfúrico, como lo describe la ecuación:
C6H6 + H2SO4 → C6H5SO3H + H2O

CROOKS y WHITE investigaron esta reacción, examinando el impacto de la temperatura y la composición de la mezcla de sulfonación en la velocidad de reacción. Cabe señalar que la reacción cesa a una concentración específica de ácido sulfúrico, normalmente entre 74 y 78 %, dependiendo de la temperatura y la generación de agua.
En entornos industriales, una parte del ácido sulfúrico (normalmente el 45 % en el proceso clásico) permanece sin convertirse y sirve como disolvente y diluyente. Esto limita la formación de subproductos, particularmente difenilsulfona, a un bajo rendimiento. El exceso de ácido se puede eliminar industrialmente añadiendo carbonato de calcio.
Se han empleado varios métodos para reducir el exceso de ácido sulfúrico y mejorar la formación de sulfona:
- Emplear óleum o trióxido de azufre en lugar de ácido sulfúrico.
- Extracción de ácido bencenosulfónico de la mezcla de reacción con benceno.
- Eliminación azeotrópica del agua de reacción con benceno.
a. El proceso clásico implicó la sulfonación del benceno para producir ácido bencenosulfónico que se usó en la síntesis de fenol y luego el subproducto sulfito formado se usa para neutralizar el ácido bencenosulfónico. Este proceso es sólo de interés histórico.
b. Un enfoque más moderno es la sulfonación continua con Oleum, también conocida como proceso Monsanto. Se trata de bombear benceno y óleum a una cascada de seis recipientes de sulfonación. Estos recipientes, conectados mediante tubos de rebose, permiten que la mezcla de reacción fluya de uno a otro.
Los dos primeros recipientes se enfrían, mientras que los demás se calientan. La neutralización de la mezcla de reacción con sulfito de sodio o solución de hidróxido de sodio elimina el exceso de ácido sulfúrico. El sulfato de sodio precipita y se puede separar en centrífugas. La solución de bencenosulfonato de sodio resultante se puede concentrar y convertir directamente en fenol o secar.
Este proceso utiliza óleum que contiene un 35,6% de trióxido de azufre y mantiene unas condiciones de temperatura específicas. En este proceso sólo alrededor del 1% del benceno se convierte en difenilsulfona.
c. Otro método es el proceso de extracción continua, que consiste en introducir un exceso de benceno y trióxido de azufre en un recipiente con agitación vigorosa. En la parte superior del recipiente se forma una capa de benceno saturada con ácido bencenosulfónico y se lava continuamente con agua o una solución de hidróxido de sodio en un segundo recipiente agitador.
El benceno separado se puede devolver al recipiente de reacción. En este proceso, el consumo de ácido sulfúrico es de 1260 kg por cada 1000 kg de benceno convertido y la formación de difenilsulfona es inferior al 2%.
d. El método de eliminación azeotrópica del agua de reacción implica calentar ácido sulfúrico con una concentración de, por ejemplo, 79 % a 170 °C en un recipiente de sulfonación e introducir vapor de benceno finamente dividido.
Este proceso sulfona una porción del vapor de benceno, mientras que la porción no convertida elimina continuamente agua de la mezcla de reacción. La mezcla condensada de benceno y vapor de agua se puede separar y el benceno se devuelve al evaporador.
La operación continua de este proceso produce un producto final que contiene 80,2% de ácido bencenosulfónico y 14,3% de ácido sulfúrico, mientras que la operación por lotes da como resultado un producto final que contiene 93,1% de ácido sulfónico y 4,8% de ácido sulfúrico. Agregar bencenosulfonato de sodio a la mezcla de sulfonación puede mantener la formación de sulfona por debajo del 2%.
4. Usos del ácido bencenosulfónico
El ácido bencenosulfónico se utiliza para diversas aplicaciones en diversas industrias de la siguiente manera:
- Producción de fenol: el ácido bencenosulfónico se utiliza para producir fenol mediante fusión con hidróxido de sodio o hidrólisis de sus sales, típicamente la sal de sodio.
- Síntesis de tensioactivos: el ácido bencenosulfónico es un componente clave en la creación de tensioactivos, particularmente cuando se combina con sales metálicas o de aminas. Las sales del ácido bencenosulfónico, tales como el bencenosulfonato de sodio (Ludigol) y el bencenosulfonato de monoetanolamina, se emplean como tensioactivos en formulaciones de detergentes para ropa.
- Síntesis de fármacos: el ácido bencenosulfónico participa en la síntesis de fármacos, donde estos fármacos se producen como sales de bencenosulfonato. Estas sales están reconocidas por la denominación común internacional como besilatos o por la denominación adoptada en los Estados Unidos como besilatos.
- Catalizador ácido: la naturaleza ácida del ácido bencenosulfónico lo hace valioso como catalizador ácido en diversas reacciones químicas.
- Estandarización de tintes: la sal sódica del ácido bencenosulfónico desempeña un papel en la estandarización de los tintes, asegurando la precisión de los procesos de coloración.
- Recuperación de petróleo mejorada con surfactantes (SEOR): el ácido bencenosulfónico es esencial en SEOR, una técnica que implica el uso de surfactantes para facilitar la extracción de petróleo de los yacimientos, también conocida como lavado con surfactantes.
5. Toxicología del ácido bencenosulfónico
Dosis letal 50 (LD50) en ratas (oral): 1170 miligramos por kilogramo
Efectos de la exposición a corto plazo:
El ácido bencenosulfónico es una sustancia corrosiva que puede causar daños graves a los ojos, la piel y el tracto respiratorio. También es corrosivo si se ingiere.
Síntomas de exposición:
- Inhalación: tos, dolor de garganta, dificultad para respirar, dificultad para respirar, sensación de ardor, dolor de cabeza, náuseas
- Piel: enrojecimiento, sensación de ardor, dolor, quemaduras en la piel.
- Ojos: enrojecimiento, dolor, quemaduras profundas graves.
- Ingestión: dolor de garganta, sensación de ardor en la garganta y el pecho, dolor abdominal, shock o colapso.
Referencias
- Benzenesulfonic Acids and Their Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_507
- BENZENESULFONIC ACID – ILO
- https://www.acs.org/molecule-of-the-week/archive/b/benzenesulfonic-acid.html
- https://en.wikipedia.org/wiki/Benzenesulfonic_acid
- Benzenesulfonic Acid (Surfactant)
