Acetamida: propiedades, producción y aplicaciones

¿Qué es la acetamida?
La acetamida, también conocida como etanamida o amida del ácido acético, es un compuesto orgánico con la fórmula química C2H5NO. Es un sólido blanco, inodoro e higroscópico formado a partir de ácido acético y amoníaco. La acetamida se encuentra de forma natural en las raíces de la remolacha azucarera y en los vertederos de minas de carbón como un subproducto menor de la degradación de materia orgánica.
Tabla de contenido
1. Propiedades físicas de la acetamida
La acetamida pura tiene un sabor amargo y es inodora. Su característico olor a ratón se atribuye a trazas de impurezas, posiblemente provenientes del acetonitrilo. La acetamida se presenta en dos formas cristalinas: una forma trigonal estable y una modificación ortorrómbica metaestable. Es muy soluble en agua, etanol, cloroformo, glicerina y benceno caliente, y ligeramente soluble en éter dietílico.
La Tabla 1 enumera las propiedades físicas importantes de la acetamida.
| Propiedad | Valor |
|---|---|
| Número de registro CAS | 60-35-5 |
| Fórmula molecular | C2H5NO |
| Masa molar | 59,07 g·mol−1 |
| Punto de fusión | 81–82 °C |
| Punto de fusión (trigonal) | 80,0–80,1 °C |
| Punto triple | 353,33 K |
| Punto de ebullición (1 atm) | ≈221 °C |
| Densidad (20 °C) | ≈1,16 g/cm3 |
| Densidad de fusión a 85 °C | 0,9986 g·mL-1 |
| Calor de fusión (ΔHm) | 264 kJ·kg-1 |
| Constante dieléctrica | 59 |
| Momento dipolar | 12,41 × 10−30 C·m |
| Presión de vapor a 272 K | 10 kPa |
| Presión de vapor a 278 K | 20 kPa |
| Presión de vapor a 281 K | 30 kPa |
| Presión de vapor a 284 K | 40 kPa |
| Presión de vapor a 285 K | 50 kPa |
| Presión de vapor a 287 K | 60 kPa |
| Presión de vapor a 288 K | 70 kPa |
| Presión de vapor a 290 K | 80 kPa |
| Presión de vapor a 291 K | 90 kPa |
| Presión de vapor a 292 K | 100 kPa |
2. Propiedades químicas de la acetamida
La acetamida es una amida alifática simple y presenta propiedades características del grupo funcional amida.
La acetamida muestra un comportamiento anfótero cuando se disuelve en agua. La hidrólisis en agua neutra ocurre lentamente, pero en presencia de ácidos o bases fuertes, reacciona instantáneamente para producir ácido acético y amoníaco.
La constante de autodisociación de la acetamida es de aproximadamente 3,2 × 10-11 a 94 °C, lo que demuestra una baja tendencia a la autoionización en condiciones térmicas.
La acetamida reacciona con ácidos minerales para formar complejos sólidos. Se han aislado y caracterizado sales de bromuro de hidrógeno, cloruro de hidrógeno y ácido nítrico con acetamida.
La fase fundida de la acetamida se utiliza para disolver sales metálicas cuya conductividad, estabilidad e idoneidad para la electrodeposición han sido evaluadas.
3. Producción de acetamida
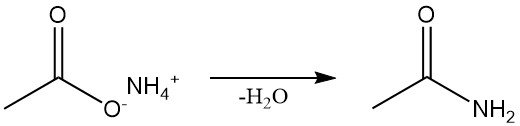
La acetamida se obtiene mediante diversas vías sintéticas. Se produce industrialmente mediante la deshidratación continua del acetato de amonio, que también es el método estándar de laboratorio.
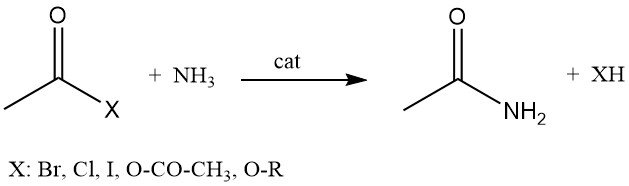
La acetamida también se puede producir mediante la reacción de haluros de acetilo, anhídrido acético o acetatos de alquilo con amoníaco.
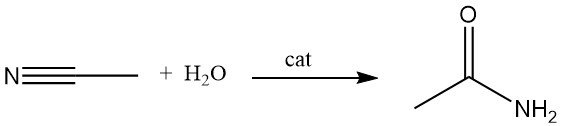
Un método alternativo para la fabricación de acetamida es la hidratación del acetonitrilo en presencia de catalizadores ácidos o básicos. Este proceso se utiliza ampliamente porque el acetonitrilo se produce como subproducto en la fabricación de acrilonitrilo.
La hidratación del acetonitrilo catalizada por cobre puede alcanzar eficiencias de conversión de hasta el 83 %. Ciertos microorganismos también son capaces de catalizar esta reacción cerca de la temperatura ambiente.
4. Usos de la acetamida
La acetamida se utiliza como disolvente y plastificante. Tiene una amplia gama de aplicaciones en diversas industrias.
La acetamida inhibe la acumulación de ácido en tintas de impresión, lacas, explosivos y perfumes. Se utiliza como humectante suave y suavizante para cuero, textiles, papel y ciertos plásticos.
La acetamida también se emplea como intermediario en la síntesis de productos farmacéuticos, pesticidas y antioxidantes para plásticos. Se han investigado derivados de la acetamida, incluidas las tioureas sustituidas que contienen acetamida, por su actividad antiviral contra los virus del herpes.
La acetamida se aplica como plastificante y estabilizador en la producción de polímeros. Se ha estudiado como agente crioprotector y como componente en lubricantes y formulaciones ignífugas.
Ciertos derivados de la acetamida se aplican como modificadores del comportamiento alimentario en estudios agrícolas.
En la investigación de laboratorio, la acetamida se utiliza a menudo como compuesto modelo para estudiar las propiedades estructurales y de enlace de hidrógeno de las amidas.
5. Toxicología de la acetamida
La acetamida se ha utilizado como fuente de nitrógeno no proteico en rumiantes, como ovejas y ganado lechero. Niveles dietéticos de aproximadamente el 2-3% parecen no ser tóxicos. La suplementación de la dieta con ácidos dibásicos permite una mayor ingesta al eliminar el amoníaco liberado durante la digestión.
La Agencia Internacional para la Investigación del Cáncer (IARC) clasifica la acetamida como un posible carcinógeno humano (Grupo 2B).
La exposición oral crónica en ratas demostró hepatocarcinogenicidad: la administración de acetamida al 2,36% en la dieta durante un año resultó en cáncer de hígado. Estudios adicionales revelaron efectos hepatotóxicos y hematopoyéticos.
El mecanismo preciso de la toxicidad de la acetamida sigue sin estar claro. Su perfil difiere del de la dimetilacetamida y parece estar relacionado con la formación de hidroxilamina a partir de su metabolito principal, el ácido acetohidroxámico.
La acetamida no presenta toxicidad para el desarrollo. Estudios reproductivos en roedores no han indicado alteraciones de la espermatogénesis, cambios hormonales ni daño a los órganos reproductores accesorios.
En ratones, la administración oral de acetamida produjo tumores hepáticos benignos y malignos. Los ratones macho también mostraron una mayor incidencia de linfomas malignos. En general, estos hallazgos respaldan la clasificación de la acetamida como hepatocarcinógeno en roedores con posible potencial carcinogénico en humanos.
Referencias
1. Wagner, F.S., Jr. (2002). Acetamide. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a02.pub2
2. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
3. Mohammadi, S.; Foroumadi, A. Acetamide. In *Encyclopedia of Toxicology*, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 39–42. DOI: 10.1016/B978-0-12-824315-2.01089-7
