Zinkoxid: Eigenschaften, Herstellung und Verwendung

Was ist Zinkoxid?
Zinkoxid ist eine anorganische Verbindung mit der chemischen Formel ZnO. Es ist ein weißes, wasserunlösliches Pulver. Obwohl es in der Natur als Mineral Zinkit vorkommt, wird das meiste kommerziell verwendete Zinkoxid synthetisch hergestellt.
In der Vergangenheit wurde Zinkoxid nur als Weißpigment verwendet und war unter verschiedenen Namen bekannt, darunter Zinkweiß (C.I. Pigment White 4), Chinesisches Weiß und Zinkblüten.
Zinkoxid entstand als Nebenprodukt der Kupferverhüttung. Die alten Römer nannten es „Cadmiumoxid“ und verwendeten es zur Messingherstellung. Sie veredelten es auch durch eine Reduktions-Oxidations-Sequenz für medizinische Salben. Mittelalterliche Alchemisten glaubten, dass Cadmiumoxid in Gold umgewandelt werden könnte.
Mitte des 18. Jahrhunderts stellte der deutsche Chemiker Cramer Zinkoxid durch Verbrennung von metallischem Zink her. Courtois begann 1781 in Frankreich mit der Produktion von Zinkweiß. Die industrielle Herstellung begann jedoch erst 1840 durch Leclaire im indirekten, auch französischen Verfahren.
Zinkoxid ersetzte Bleiweiß schnell aufgrund seiner überlegenen Eigenschaften wie Ungiftigkeit, Beständigkeit gegen Verfärbungen durch schwefelhaltige Gase und gute Opazität.
Um 1850 entwickelte S. Wetherill von der New Jersey Zinc Company einen Röstofen, in dem ein mit Kohle beladener Rost mit Kohle beschickt und anschließend mit einer Mischung aus Zinkerz und Kohle bedeckt wurde. Zink wurde durch teilweise Kohleverbrennung reduziert und beim Verlassen des Ofens reoxidiert.
Diese Methode wurde als direktes, auch amerikanisches Verfahren bekannt. Obwohl diese Öfen später verbessert wurden, werden sie heute nicht mehr verwendet.
In der zweiten Hälfte des 19. Jahrhunderts wurde Zinkoxid in Gummimischungen eingearbeitet, um die Vulkanisationszeit zu verkürzen. Die Entdeckung organischer Beschleuniger im Jahr 1906 verbesserte den Vulkanisationsprozess erheblich und steigerte damit die Bedeutung von Zinkoxid, das als Aktivator in der Gummiindustrie eingesetzt wurde.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Zinkoxid
Zinkoxid ist ein feines weißes Pulver, das sich bei Erhitzung über 300 °C gelb verfärbt. Es absorbiert ultraviolettes (UV) Licht bei Wellenlängen unter 366 nm.
Die Einführung von Spuren ein- oder dreiwertiger Elemente in sein Kristallgitter verleiht ihm Halbleitereigenschaften. Elementarteilchen von ZnO, die durch thermische Verfahren erzeugt werden, können körnig, knollenförmig (0,1–5 µm) oder nadelförmig sein.
ZnO ist wasserunlöslich (Löslichkeit ca. 0,16 mg/100 ml bei 30 °C). Aufgrund seiner amphoteren Natur löst es sich jedoch in verdünnten Säuren und starken Basen.
Wichtige physikalische Eigenschaften von Zinkoxid sind in der folgenden Tabelle zusammengefasst:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [1314-13-2] |
| Chemische Formel | ZnO |
| Molekulargewicht | 81,38 g/mol |
| Schmelzpunkt | 1975 °C |
| Siedepunkt | ca. 2360 °C |
| Dichte | 5,65–5,68 g/cm3 |
| Brechungsindex | 1,95–2,1 |
| Wärmekapazität bei 25 °C | 40,26 J mol-1 K-1 |
| Wärmekapazität bei 100 °C | 44,37 J mol-1 K-1 |
| Wärmekapazität bei 1000 °C | 54,95 J mol-1 K-1 |
| Wärmeleitfähigkeit | 25,2 W m-1 K-1 |
| Kristallstruktur | hexagonal, Wurtzit |
| Mohshärte | 4–4,5 |
| Ölabsorptionswert | 20–24 g/100 g |
| Scheinbare Dichte | 100 cm3/100 g |
| Mittlere Partikelgröße | 0,11–0,22 mm |
| BET-Oberfläche | 3–10 m2/g |
2. Chemische Eigenschaften von Zinkoxid
Zinkoxid ist amphoter. Es reagiert sowohl mit organischen als auch mit anorganischen Säuren. Es löst sich auch in alkalischen Lösungen und Ammoniak zu Zinkaten. ZnO reagiert leicht mit sauren Gasen wie Kohlendioxid, Schwefeldioxid und Schwefelwasserstoff. Hochtemperaturreaktionen mit anderen Oxiden führen zu Verbindungen wie Zinkferriten.
Es reagiert mit Säuren zu Zinksalzen und Wasser. Dies stellt eine Neutralisationsreaktion dar, bei der ZnO als Base wirkt.
ZnO + 2 HCl → ZnCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2 HNO3 → Zn(NO3)2 + H2O
Zinkoxid reagiert mit starken Basen zu löslichen Zinkaten. ZnO wirkt in diesen Reaktionen als Säure.
ZnO + 2 NaOH → Na2ZnO2 + H2O (Natriumzinkat)
Zinkoxid kann durch hohe Temperaturen und ein Reduktionsmittel zu metallischem Zink reduziert werden. Dies ist ein Standardschritt bei der Zinkerzgewinnung.
Kohlenstoff (Koks) reduziert Zinkoxid zu Zinkmetall, und Kohlenstoff wird zu Kohlenmonoxid oxidiert. Diese Reaktion ist historisch und industriell bedeutsam.
Wasserstoff oder reaktive Metalle wie Magnesium können Zinkoxid ebenfalls reduzieren.
Zinkoxid reagiert mit vielen organischen Verbindungen, insbesondere Carbonsäuren und Fettsäuren (z. B. Stearinsäure, die in Ölen und Gummiformulierungen vorkommt), zu Zinkcarboxylaten (Zinkseifen).
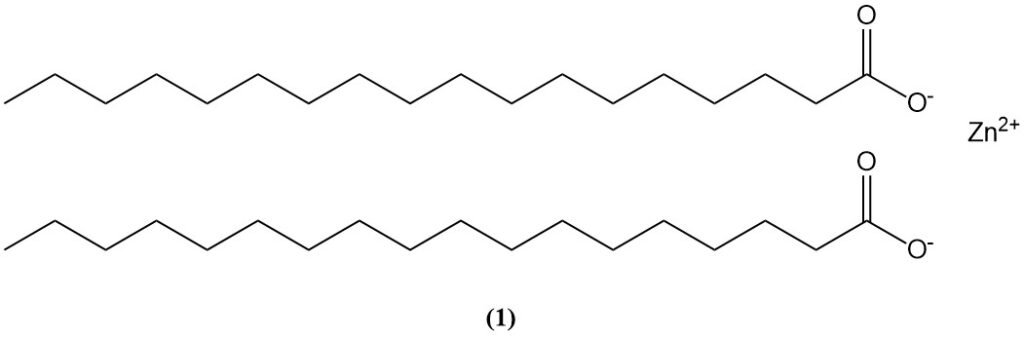
Zinkstearat (1), das durch die Reaktion von Stearinsäure mit Zinkoxid entsteht, wird als Beschleunigeraktivator verwendet und kann auch zum Abbau von Ölfarben mit ZnO-Pigmenten beitragen.
Zinkoxid ist thermisch stabil, kann aber bei extrem hohen Temperaturen dissoziieren. Diese thermische Zersetzung ist ein wichtiger Schritt in bestimmten thermochemischen Kreisläufen der Wasserstoffproduktion.
3. Industrielle Herstellung von Zinkoxid
Industriell wird Zinkoxid hauptsächlich nach zwei Hauptverfahren hergestellt: dem indirekten Verfahren (Französisches Verfahren) und dem direkten Verfahren (Amerikanisches Verfahren). Eine geringere Menge wird auch nasschemisch hergestellt.
Das Nassverfahren macht etwa 1–2 % der Zinkoxidproduktion aus. Das direkte Verfahren trägt 10–20 % bei, und das indirekte Verfahren liefert den restlichen Großteil.
Historisch bestanden die Rohstoffe für das direkte Verfahren hauptsächlich aus Zinkerzen oder -konzentraten. Das indirekte Verfahren verwendete reines metallisches Zink von Herstellern. Die heutige Zinkoxidherstellung verwendet überwiegend Rückstände und Sekundärzink.
Diese Tatsache, gepaart mit den Anforderungen der Anwender an hohe chemische Reinheit, führte zu Prozessmodifikationen und dem Einsatz verschiedener Reinigungstechniken.
3.1. Herstellung von Zinkoxid nach dem Direkt- oder Amerikanischen Verfahren
Das Direkt- oder Amerikanische Verfahren zur Herstellung von Zinkoxid zeichnet sich durch seine Einfachheit, Kosteneffizienz und hohe thermische Effizienz aus. Es beinhaltet die anfängliche Hochtemperaturreduktion (1000–1200 °C) zinkhaltiger Materialien. Kohle dient als Reduktionsmittel. Die Reduktion erfolgt nach den Boudouard-Reaktionen:
ZnO + C ⇌ Zn + CO
ZnO + CO ⇌ Zn + CO
2 C + O2 ⇌ CO
2 CO2 + C ⇌ 2 CO
Zinkdampf und Kohlenmonoxidgas werden anschließend oberhalb des Reaktionsbetts oder am Ofenausgang zu Zinkoxid und Kohlendioxid oxidiert.
Es werden verschiedene zinkhaltige Ausgangsstoffe verwendet. Dazu gehören Zinkkonzentrate, Metallisierungsrückstände, Zinkhydroxid als Nebenprodukt und vor allem Zinkschlacke aus Gießöfen oder Verzinkungsvorgängen. Schlacke sollte durch Erhitzen auf ca. 1000 °C in Drehrohröfen vorbehandelt werden, um Chlorid- und Bleiverunreinigungen zu entfernen.
Derzeit werden für das Direktverfahren ausschließlich Drehrohröfen eingesetzt. Statische Öfen sind nicht mehr im Einsatz. Rohstoffe enthalten typischerweise 60 bis 75 % Zink. Es gibt zwei Haupttypen von Drehrohröfen: lange, schmale Öfen und kürzere, breitere Öfen.
1. Lange, schmale Öfen: Diese Öfen sind ca. 30 m lang und haben einen Durchmesser von 2,5 m. Sie werden mit Gas oder Öl beheizt. Der Rohstoff, ein Gemisch aus zinkhaltiger Substanz und Kohle, wird kontinuierlich im Gegen- oder Gleichstrom zu den Verbrennungsgasen zugeführt.
Rückstände, die Zinkreste und unverbrannte Kohle enthalten, verlassen den Ofen kontinuierlich am gegenüberliegenden Ende der Einfüllstelle. Überschüssige Kohle wird gesiebt und recycelt. Die Verbrennungsgase, bestehend aus Zinkdampf, ZnO und CO, gelangen in eine Kammer, in der die Oxidation abgeschlossen wird und sich große Verunreinigungspartikel absetzen.
Die Gase werden anschließend über einen Wärmetauscher oder eine Luftverdünnung gekühlt. Zinkoxid wird anschließend in Schlauchfiltern gesammelt.
2. Kürzere, breitere Öfen: Dieser Drehrohrofentyp ist etwa 5 m lang und hat einen Durchmesser von 3 m. Die Beschickung mit Rohstoffen erfolgt kontinuierlich; entzinkte Rückstände werden jedoch chargenweise entfernt.
Die Betriebsbedingungen beider Ofentypen werden präzise kontrolliert, um eine hohe Ausbeute und das Erreichen der gewünschten Partikelform und -größe zu gewährleisten. Die chemische Reinheit wird, sofern keine äußeren Verunreinigungen vorliegen, ausschließlich durch die Zusammensetzung der Ausgangsrohstoffe bestimmt.
3.2. Herstellung von Zinkoxid im indirekten oder französischen Verfahren
Beim indirekten oder französischen Verfahren wird das Zink gekocht, und der entstehende Zinkdampf wird durch Verbrennung in Luft unter kontrollierten Bedingungen oxidiert. Die kristallographischen und physikalischen Eigenschaften des erzeugten Zinkoxids können durch Modifikation der Verbrennungsbedingungen, wie z. B. Flammenturbulenz und Luftüberschuss, eingestellt werden.
Die chemische Zusammensetzung des ZnO-Produkts hängt ausschließlich von der Zusammensetzung des Zinkdampfs ab.
Verschiedene Ofentypen ermöglichen die Herstellung von Zinkdampf mit der erforderlichen Reinheit aus unterschiedlichen Rohstoffen und gewährleisten so eine hohe Zinkausbeute.
Zu den in diesem Verfahren verwendeten Rohstoffen gehören reines Zink (Super High Grade, SHG; High Grade, HG) und zunehmend auch metallische Rückstände (z. B. Zinkschrott, Druckgusskrätze, Verzinkungskrätze). Vor der Oxidation werden Verunreinigungen wie Cadmium, Blei, Eisen und Aluminium durch Flüssig- oder Dampfphasentrennverfahren aus dem Zinkmetall entfernt.
Spezifische Verfahren zur Zinkverdampfung und -reinigung umfassen:
1. Muffelöfen oder Retorten (Graphit/Siliziumkarbid): Metallische Ausgangsstoffe werden entweder als feste Chargen oder als kontinuierliche Flüssigkeitsströme in den Ofen eingebracht. Die Verdampfungswärme wird durch externe Beheizung der Retorte mit einem Brenner zugeführt.
Nichtflüchtige Rückstände, wie Eisen und Blei aus der Schmelzkrätze, sammeln sich in der Retorte an. Diese Rückstände müssen regelmäßig entfernt werden, häufig durch Kippen der Retorten.
2. Fraktionierte Destillation: Zinkdampf, der Verunreinigungen wie Cd, Pb, Fe, Al und Cu enthält, kann durch fraktionierte Destillation gereinigt werden. Dieser Prozess erfolgt in Kolonnen, die häufig mit Siliziumkarbidplatten ausgestattet sind (z. B. nach dem Design der New Jersey Zinc Co.). Die Oxidation des gereinigten Zinkdampfes erfolgt am Kolonnenausgang.
3. Zweikammeröfen: Metallische Rohstoffe, meist in großen Stücken, gelangen in eine primäre Schmelzkammer, die mit einer sekundären, elektrisch beheizten Kammer verbunden ist. Die Destillation findet in der zweiten Kammer unter Luftabschluss statt.
Nichtmetallische Rückstände werden von der Oberfläche der Schmelzkammer abgesaugt. Verunreinigungen wie Eisen, Aluminium und ein Teil des Bleis sammeln sich in der Destillationskammer an und werden regelmäßig in flüssiger Form entfernt. Restbleispuren werden anschließend durch fraktionierte Destillation entfernt. Lundevall entwickelte die erste Version dieses Ofentyps.
4. Drehrohrofen-Schmelzverfahren: Indirektes Zinkoxid kann auch durch einen Schmelzprozess in einem Drehrohrofen unter Verwendung derselben Rohstoffe hergestellt werden. Schmelzen, Destillation und ein Teil der Oxidation erfolgen in einer einzigen Reaktionszone, wodurch ein Großteil der Zinkverbrennungswärme genutzt werden kann.
Durch die Kontrolle der Temperatur und der Partialdrücke von Kohlendioxid und Sauerstoff kann der Bleiverunreinigungsgehalt begrenzt und Form und Größe der ZnO-Partikel eingestellt werden, wenn auch mit geringerer Präzision als bei anderen Verfahren.
3.3. Herstellung von Zinkoxid im Nassverfahren
Zinkoxid wird im Nassverfahren hergestellt, bei dem basisches Zinkcarbonat aus gereinigten Zinksulfat- oder -chloridlösungen abgeschieden wird. Der Niederschlag wird gewaschen, gefiltert und anschließend zu Zinkoxid kalziniert. Dieses Verfahren erzeugt ZnO mit einer hohen spezifischen Oberfläche.
Ähnliche Produkte werden aus Abfallhydroxiden gewonnen, die chemisch gereinigt und anschließend kalziniert werden.
3.4. Nachbehandlung
Die thermische Nachbehandlung bei Temperaturen bis zu 1000 °C verbessert die Pigmenteigenschaften von ZnO und wird hauptsächlich bei direkt hergestelltem Oxid angewendet. Kontrollierte atmosphärische Kalzinierung verbessert die photoleitenden Eigenschaften des hochreinen Oxids zusätzlich. Dieses hochreine Oxid wird in Fotokopieranwendungen eingesetzt.
Die Oberfläche von Zinkoxid kann durch Beschichtung mit Öl und Propionsäure organophiler gemacht werden. Zinkoxid wird häufig entlüftet. Manchmal wird es pelletiert oder granuliert, um die Handhabungseigenschaften zu verbessern.
| A | B | C | D | |
|---|---|---|---|---|
| Parameter | Indirektes Verfahren | Indirektes Verfahren | Direktes Verfahren | Nasses Verfahren |
| ZnO (min.), Gew.-% | 99,5 | 99 | 98,5 | 93 |
| Pb (max.), Gew.-% | 0,004 | 0,25 | 0,25 | 0,001 |
| Cd (max.), Gew.-% | 0,001 | 0,05 | 0,03 | 0,001 |
| Cu (max.), Gew.-% | 0,0005 | 0,003 | 0,005 | 0,001 |
| Mn (max.), Gew.-% | 0,0005 | 0,001 | 0,005 | 0,001 |
| Wasserlösliche Salze (max.), Gew.-% | 0,02 | 0,1 | 0,65 | 1 |
| Glühverlust (max.), Gew.-% | 0,3 | 0,3 | 0,3 | 4 |
| Säuregehalt, g H2SO4/100 g | 0,01 | 0,1 | 0,3 | 0,2 |
| Spezifische Oberfläche, m2/g | 3–8 | 3–10 | 1–5 | 25 (min.) |
4. Verwendung von Zinkoxid

Zinkoxid hat vielfältige Verwendungsmöglichkeiten. Die mit Abstand wichtigste findet sich in der Gummiindustrie. Fast die Hälfte des weltweit produzierten ZnO wird als Aktivator für Vulkanisationsbeschleuniger in Natur- und Synthesekautschuk eingesetzt.
4.1. Verwendung von Zinkoxid bei der Herstellung von Natur- und Synthesekautschuk
Die Zugabe von Zinkoxid zu schwefel- und beschleunigerhaltigen Gummimischungen erhöht die Vernetzungsdichte. Bei Allzweckkautschuken, einschließlich Naturkautschuk und Styrol-Butadien-Kautschuk, führen ZnO-Dosierungen von bis zu ca. 5 phr (parts per hundred rubber) zu hohen Zugfestigkeits- und Spannungswerten. Höhere Dosierungen verbessern diese Eigenschaften nicht weiter.
Fettsäuren aktivieren das System Gummi-Schwefel-Beschleuniger-Zinkoxid. Häufig wird Stearinsäure oder Zinkstearat verwendet. Die Zugabe spezieller Zinksalze zusätzlich zu ZnO kann die Vernetzungsdichte erhöhen und das Reversionsverhalten verbessern.
Die Reaktivität von Zinkoxid hängt von seiner spezifischen Oberfläche ab und wird auch durch Verunreinigungen wie Blei und Sulfate beeinflusst. Zinkoxid sorgt für eine gute Haltbarkeit von vulkanisiertem Gummi und erhöht dessen Wärmeleitfähigkeit. Der ZnO-Gehalt liegt üblicherweise zwischen 2 % und 5 %.
4.2. Verwendung von Zinkoxid in Farben und Beschichtungen
Zinkoxid ist nicht mehr das primäre Weißpigment in Farben und Beschichtungen. Künstler verwenden es jedoch weiterhin wegen seiner hervorragenden weißen Farbe. Es wird als Zusatz in Holzschutzfarben für den Außenbereich sowie in Antifouling- und Korrosionsschutzfarben eingesetzt.
Zinkoxid wird üblicherweise mit anderen aktiven Korrosionsschutzpigmenten kombiniert. Seine inhibierende Wirkung beruht auf seiner Fähigkeit, mit korrosiven Substanzen zu reagieren und einen alkalischen pH-Wert in der Beschichtung aufrechtzuerhalten. Es reagiert außerdem mit sauren Bindemitteln zu Seifen und absorbiert ultraviolettes (UV-)Licht.
Der Bleigehalt von handelsüblichem Zinkoxid variiert je nach Hersteller zwischen 0,002 % und 1,5 %. Eine bleifreie Zinkoxidbeschichtung erfordert einen Bleigehalt unter 1,5 %.
Zinkoxid verbessert die Filmbildung, Haltbarkeit und Schimmelresistenz. Es zeigt eine synergistische Wirkung mit anderen Fungiziden, da es mit den sauren Oxidationsprodukten reagieren und UV-Strahlung absorbieren kann.
4.3. Verwendung von Zinkoxid in der Pharma- und Kosmetikindustrie
Die Pharma- und Kosmetikindustrie verwendet Zinkoxid aufgrund seiner bakteriziden Eigenschaften in Pulvern und Salben. Es wurde auch zur Herstellung von Zahnzementen durch Reaktion mit Eugenol verwendet, wird heute aber nur noch selten eingesetzt.
Die reaktiven Komponenten ZnO und Eugenol (80–96 Gew.-%) werden in zwei Pasten angeboten. Öle (z. B. Olivenöl, Mineralöl) und Füllstoffe (z. B. Talkum, Kaolin, Kolophonium, Vaseline) beeinflussen die Konsistenz. Zinkacetat und Magnesiumchlorid dienen als Beschleuniger der Zinkeugenolatbildung.
Zinkoxid wird auch als UV-Schutzadditiv in Kosmetika eingesetzt. Es dient als Sonnenschutzmittel auf und in der Hornschicht. Es wirkt als „physikalischer“ Lichtfilter, hauptsächlich durch Reflexion und Streuung von UVA- und UVB-Strahlung, und bietet so einen Breitbandschutz. Mikronisiertes und nanoskaliges ZnO wird häufig verwendet, um sichtbare weiße Rückstände zu reduzieren.
Es wird als Weißpigment zur Herstellung von Farbpudern und Perlglanzpigmenten wie Lidschattenpuder verwendet.
Zinkoxid wird aufgrund seiner beruhigenden, adstringierenden und antiseptischen Eigenschaften in verschiedenen Hautpflegeprodukten verwendet. Beispiele hierfür sind Cremes gegen Windelausschlag, Galmeilotion, antiseptische Salben und Aknebehandlungen.
4.4. Verwendung von Zinkoxid in der Keramik- und Glasindustrie
Zinkoxid wird in der Glas-, Keramik- und Emailleindustrie eingesetzt, um Schmelzpunkte zu senken und Glanz, Brillanz und Rissbeständigkeit zu verbessern (und so Haarrissbildung und -splitterung zu verhindern). Es kann auch zur Glanzmodifizierung oder zur Verbesserung der Opazität eingesetzt werden.
Höhere ZnO-Konzentrationen können matte und kristalline Oberflächen erzeugen. Seine hohe Wärmekapazität und Wärmeleitfähigkeit sind vorteilhaft für die Keramikproduktion.
4.5. Verwendung von Zinkoxid als Rohstoff
Zinkoxid wird als Rohstoff für verschiedene Produkte verwendet, darunter Stearate, Phosphate, Chromate, Bromate, organische Dithiophosphate und Ferrite (ZnO, MnO, Fe2O3). Es wird auch in der galvanischen Verzinkung (insbesondere in Cyanidbadformulierungen) eingesetzt.
Zinkoxid wird als Zinkquelle in Tierfutter und zur Entschwefelung von Gasen verwendet.
Zinkoxid wird als Katalysator in organischen Synthesen, beispielsweise der Methanol-Herstellung, eingesetzt, oft in Verbindung mit anderen Oxiden. Es ist auch Bestandteil einiger Klebstoffe.
4.6. Verwendung von Zinkoxid in der Elektronik
Hochreines ZnO, kalziniert mit Zusätzen wie Wismutoxid (Bi2O3), wird zur Herstellung von Varistoren verwendet, die sich durch einen spannungsabhängigen Widerstand, d. h. ein nichtohmsches Verhalten, auszeichnen.
Eine typische Zusammensetzung umfasst 96,5 Masse-% ZnO, 0,5 % Bi2O3, 1 % CoO, 0,5 % MnO, 1 % Sb2O3 und 0,5 % Cr2O3. Das nichtohmsche Verhalten resultiert aus halbleitenden ZnO-Körnern und einer dünnen isolierenden Korngrenzenphase.
Ein Metalloxid-Varistor auf Basis von Wismut-dotiertem ZnO ist den klassischen Siliziumkarbid-Varistoren (SiC) überlegen, da seine Spannungs-Strom-Kennlinie eine deutlich geringere Steigung aufweist und somit ein deutlich geringerer Spannungsanstieg pro Stromerhöhungseinheit entsteht.
Die photoleitenden Eigenschaften von ZnO werden in Fotoreproduktionsprozessen genutzt. Die Dotierung mit Aluminiumoxid reduziert den elektrischen Widerstand und kann daher in Beschichtungen auf Masterpapieren für die Offsetreproduktion eingesetzt werden.
Zinkoxid ist ein Halbleiter mit großer Bandlücke (3,3 eV). Diese Eigenschaft macht es geeignet für:
- UV-Laser und LEDs, insbesondere für kurzwellige optoelektronische Anwendungen.
- Gassensoren aufgrund seiner Empfindlichkeit gegenüber verschiedenen Gasen.
- Transparente leitfähige Elektroden in Bauelementen wie Solarzellen (z. B. als Pufferschicht in CIGS-Solarzellen).
- Transistoren und Dioden.
- Piezoelektrische Bauelemente, die für Sensoren und Energiegewinnung erforscht werden.
5. Toxikologie von Zinkoxid
Im Gegensatz zu anderen Schwermetallen gilt Zink nicht als inhärent giftig oder gefährlich. Es ist ein essentielles Element für die Physiologie von Mensch, Tier und Pflanze. Der menschliche Körper enthält etwa 2 g Zink. Eine tägliche Aufnahme von 10–20 mg wird empfohlen.
Die orale LD50 für Ratten beträgt 630 mg/kg. Die zulässigen Luftkonzentrationen für Zinkoxidstaub am Arbeitsplatz betragen 5 mg/m³ (MAK) und 10 mg/m³ (TLV-TWA). Für Zinkoxiddämpfe gelten Werte von 5 mg/m³ (TLV-TWA) und 10 mg/m³ (TLV-STEL).
Die Arbeitsplatzgrenzwerte (AGW) für Zinkoxid sind in Tabelle 3 aufgeführt.
| Land | 8-h-TWA, mg/m3 | 15-min-STEL, mg/m3 | Referenzen |
|---|---|---|---|
| USA | 5 (Rauch), 10 (Staub) | 10 (Rauch) (Decke) | ACGIH (1991, Richtwerte) |
| USA | 5 (Rauch), 15 (Staub; gesamt), 5 (Staub; lungengängig) | OSHA (1989, gesetzliche Grenzwerte) | |
| Niederlande | 5 (Rauch) | SZW (1997) | |
| Deutschland | 5 (Rauch), 6 (Staub) | DFG (1997) | |
| Großbritannien | 5 (Rauch), 10 (Staub) | HSE (1998) | |
| Schweden | 5 (Rauch) | Nationales Amt für Arbeitssicherheit und Gesundheitsschutz, Schweden (1993) | |
| Dänemark | 4 (Rauch), 10 (Staub) | Arbejdstilsynet (1992) |
Die versehentliche Einnahme oder Inhalation großer Mengen ZnO kann nach mehreren Stunden Fieber, Übelkeit und Reizungen der Atemwege auslösen. Diese Symptome sind vorübergehend und klingen schnell ab, ohne langfristige Folgen zu hinterlassen.
Referenzen
- Pigments, Inorganic, 2. White Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n01.pub2
- Rubber, 9. Chemicals and Additives. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a23_365.pub3
- Pigments, Inorganic, 5. Anticorrosive Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n04
- Pigments, Inorganic, 7. Transparent Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n06
- Dental Materials. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_251.pub2
- Skin Cosmetics. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_219
- Ceramics, Electronic. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_079.pub2
- The effect of formulation on the penetration of coated and uncoated zinc oxide nanoparticles into the viable epidermis of human skin in vivo
- Zinc Compounds. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a28_537.pub2
