Weinsäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
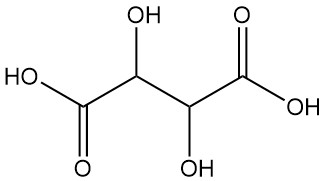
Weinsäure, auch bekannt als Acidum tartaricum, 2,3-Dihydroxybutandisäure (IUPAC-Nomenklatur), ist eine weiße kristalline organische Säure, die natürlicherweise in vielen Früchten dieser Formel vorkommt C4H6O6. Das Molekül besitzt zwei asymmetrische Kohlenstoffzentren mit zwei Carbonsäuregruppen und einem Dialkohol im selben Molekül, was zu vier Stereoisomeren führt.
Enantiomere:
- L(+)-Weinsäure und D(-)-Weinsäure sind optisch aktive Isomere, die die Ebene des polarisierten Lichts drehen. Diese spiegelbildlichen Moleküle (Enantiomere) haben bis auf die entgegengesetzte optische Drehung identische physikalische und chemische Eigenschaften.
Diastereomere:
- DL-Weinsäure (racemische Mischung) ist eine synthetische äquimolare Kombination der Formen L(+) und D(-). Aufgrund der internen Kompensation ist es optisch inaktiv.
- Meso-Weinsäure (nicht auflösbare Weinsäure) ist ein weiteres optisch inaktives Diastereomer mit unterschiedlichen physikalischen Eigenschaften im Vergleich zur aktiven und racemischen Form. Weder racemische noch meso-Weinsäure sind optisch aktive Säuren.
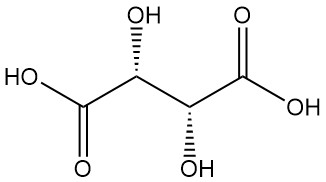
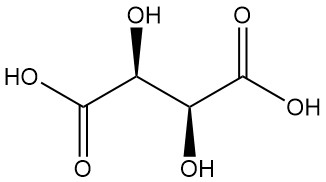
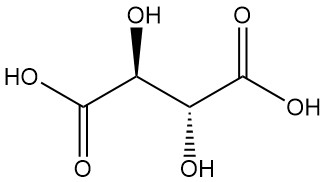
Weinsäure, seit der Antike für ihr Kaliumsalz (Weinstein) bekannt, wurde erstmals im 18. Jahrhundert von Scheele isoliert. Berzelius bestimmte 1830 seine Struktur. Pasteurs bahnbrechende Arbeit (1848–1860) über Weinsäuresalze revolutionierte die organische Chemie.
Er erklärte den Zusammenhang zwischen racemischen und optisch aktiven Formen, indem er Natrium-Ammoniumtartrat-Kristalle trennte und ihre entsprechenden optischen Drehungen demonstrierte.
L(+)-Weinsäure ist die vorherrschende natürliche Form und kommerziell hergestellte Variante. Es kommt als Säure oder Salz in verschiedenen Pflanzen vor, insbesondere in Trauben, wo es sich während der Weingärung als Kaliumbitartrat (Weinstein) anreichert. Dieser unlösliche Niederschlag ist die Hauptquelle für die kommerzielle Produktion von L(+)-Weinsäure.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Weinsäure
Die physikalischen Eigenschaften der natürlichen L(+)-Weinsäure sind in Tabelle 1 aufgeführt und sie sind identisch mit denen der D(-)-Weinsäure.
Weinsäure ist ein geruchloser Feststoff mit stark saurem Geschmack, der an der Luft stabil ist.
Weinsäurelösungen haben eine optische Drehung, die je nach Konzentration variiert, wie durch die folgende Gleichung dargestellt:
[α] =15,050-0,1535 c
Dabei ist c die Weinsäurekonzentration im Bereich von 20–50 % Gew./Vol.
Tabelle 2 zeigt die Löslichkeit bei verschiedenen Temperaturen.
Bei verschiedenen Temperaturen (°C) ist die relative Dichte von Weinsäurelösungen in Tabelle 3 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| Molekularmasse | 150,09 g/mol |
| Kristallform | Wasserfreie monokline Nadeln (über 5 °C) |
| Dichte | 1,7598 g/cm³ |
| Schmelzpunkt | 169–170 °C |
| Aussehen | Farblose Kristalle |
| Zerlegung | Über 220 °C (Geruch nach karamellisiertem Zucker) |
| Löslichkeit | |
| Wasser | Gut löslich |
| Alkohol (18 °C) | 20,4 g pro 100 g |
| Diethylether (18 °C) | 0,3 g pro 100 g |
| Optische Rotation bei 20 % Gewicht/Volumen | +11,98° (-11,98° für D(-)-Weinsäure) |
| Verbrennungsenthalpie | 1149,9 kJ/mol |
| Spezifische Wärmekapazität (0-100 °C) | 1237 kJ kg⁻¹ K⁻¹ |
| Säuredissoziationskonstanten (25 °C) |
K₁ = 1,17 × 10⁻³ K₂ = 5,0 × 10⁻⁵ |
| Siedepunkte von Lösungen |
25 %ige Lösung: 102,2 °C 50 %ige Lösung: 106,7 °C |
| Brechungsindex beim Schmelzpunkt (170 °C) | 1,464 |
| Temperatur (°C) | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Löslichkeit (g/100 g H₂O) | 115 | 120 | 125 | 139 | 156 | 176 | 195 | 218 | 244 | 273 | 307 | 343 |
| Temperatur (°C) | Dichte |
|---|---|
| 1 | 1,0045 |
| 10 | 1,0469 |
| 20 | 1,0969 |
| 30 | 1.1505 |
| 40 | 1,2078 |
| 50 | 1,2696 |
2. Chemische Reaktionen von Weinsäure
L(+)-Weinsäure schmilzt zwischen 170 und 180 °C und isomerisiert (ordnet ihre Struktur neu) ohne Wasserverlust zu Metaweinsäure. Weiteres Erhitzen ergibt amorphe Anhydride. Diese Anhydride verwandeln sich beim Kochen mit Wasser in Weinsäure.
Oberhalb von 220 °C zersetzt sich Weinsäure, quillt auf und entzündet sich, wobei ein kohlenstoffhaltiger Rückstand zurückbleibt.
Weinsäure reagiert sehr empfindlich auf Oxidationsmittel. Durch Oxidation von Weinsäure durch Wasserstoffperoxid und Eisensulfat (Fenton-Reagenz) entsteht Dioxobernsteinsäure.
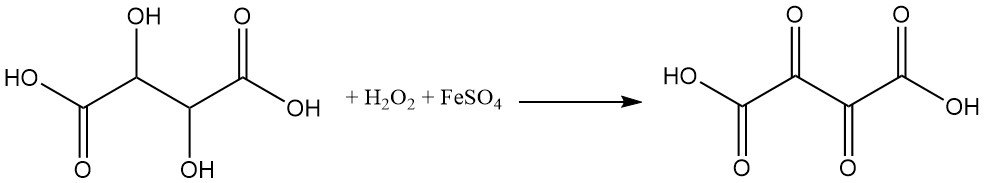
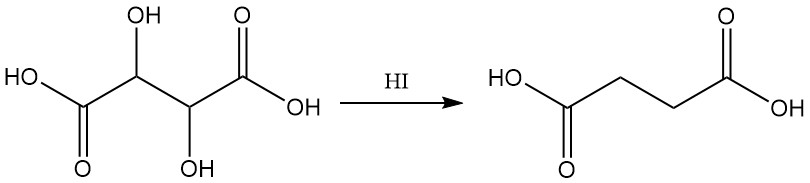
Durch Reduktion mit Jodwasserstoffsäure entsteht Bernsteinsäure.
In Lösung befindliche Tartrate reagieren mit Ammoniumsilbernitrat unter Bildung von metallischem Silber.
Weinsäure wird als Komplexbildner eingesetzt, um die Ausfällung von Schwermetallsalzen durch Basen zu verhindern.
Längeres Kochen von L(+)-Weinsäurelösungen mit Alkalien (KOH oder NaOH) führt zur Bildung von Racematen und meso-Weinsäuren.
3. Natürliche Ressourcen der Weinsäure
L(+)-Weinsäure ist das einzige kommerziell in großem Maßstab hergestellte Isomer. Das exklusive Ausgangsmaterial stammt aus natürlichen Reststoffen, die bei der Weinherstellung anfallen. Diese Rückstände enthalten hauptsächlich Weinsäure in Form von Kaliumbitartrat (Weinstein) und in geringerem Maße Calciumtartrat.
Weinsäurequellen sind wie folgt:
- Weinstein ist ein rötlicher Niederschlag, der sich an den Wänden von Weinfässern ablagert, wenn die Ethanol-Konzentration steigt. Es enthält eine hohe Konzentration (80–90 %) an Kaliumbitartrat.
- Trub: Diese Sedimente setzen sich am Boden von Weinfässern ab und enthalten eine geringere Konzentration (19–38 %) an Kaliumbitartrat.
- Getrocknete Hefe: Dabei handelt es sich um verarbeitete Hefe mit einem höheren (55–70 %) Kaliumbitartratgehalt.
- Brennereinebenprodukt: Brennereien gewinnen dieses Material aus Weinhefe oder Traubentrester (den nach der Traubenpressung übrig gebliebenen Feststoffen). Nach der Entfernung des Alkohols durch Destillation werden die Hefen oder Trester mit Calciumhydroxid behandelt, um Calciumtartrat auszufällen.
4. Herstellung von Weinsäure
Während es mehrere Weinsäure-Isomere gibt, ist L(+)-Weinsäure das einzige Isomer, das kommerziell in großem Maßstab hergestellt wird. Für bestimmte Anwendungen wird auch eine sehr geringe Menge Racematsäure synthetisiert.
4.1. Herstellung von L(+)-Weinsäure
Die größten Produzenten von L(+)-Weinsäure befinden sich in Spanien, Frankreich und Italien. So ist beispielsweise die 1784 gegründete Société Legré-Mante einer der ältesten Hersteller.
Alle Methoden zur Herstellung von L(+)-Weinsäure beruhen auf der Zersetzung von Calciumtartrat mit Schwefelsäure. Historisch gesehen wurden zwei konkurrierende Methoden zur Gewinnung des Ausgangsmaterials (Calciumtartrat) eingesetzt: das Scheurer-Kestner-Säureverfahren und das Scheele-Lowitz-Neutralverfahren (einschließlich der Desfosses-Variante).
Derzeit dominiert das wirtschaftlichere neutrale Verfahren.
Das getrocknete Ausgangsmaterial (Weinstein oder Trub) wird zunächst gemahlen und anschließend bei 160 °C für 2 Stunden im Röster geröstet. Dieser Schritt entfernt organische Verunreinigungen, die die Filtration in späteren Phasen erschweren könnten.
Das heiß geröstete Produkt wird in einen Reaktor überführt, wo es mit Wasser verdünnt und mit Calciumhydroxid auf einen pH-Wert von 5 neutralisiert wird. Die Reaktionstemperatur wird bei 70 °C gehalten.
Um die Reaktionseffizienz zu verbessern und Verluste zu minimieren, wird ein Überschuss von 10 % Calciumchlorid oder Calciumsulfat im Vergleich zur erforderlichen stöchiometrischen Menge zugesetzt. Es findet folgende chemische Reaktion statt:
2 KHC4H4O6 + Ca(OH)2 + CaCl2 → 2 CaC4H4O6 + 2 KCl + 2 H2O
Das gebildete Calciumtartrat wird durch Filtration über einen Rotationsfilter von der restlichen Flüssigkeit (Mutterlauge) getrennt und anschließend gewaschen. Wenn das Ausgangsmaterial aus Brennereien stammt, kann dieser Anfangsschritt umgangen werden.
Im zweiten Schritt wird das gewonnene Calciumtartrat in einer wässrigen Lösung mit Schwefelsäure zersetzt. Diese Reaktion ergibt Weinsäurelösung und unlösliches Calciumsulfat:
CaC4H4O6 + H2SO4 → H2C4H4O6 + CaSO4
Zur Optimierung der Reaktion wird ein Überschuss von ca. 5 % Schwefelsäure im Vergleich zur Weinsäuremenge eingesetzt. Die resultierende Mischung wird filtriert und gewaschen, um Verunreinigungen zu entfernen.
Die rote Weinsäurelösung mit einer Konzentration von etwa 200 g/L wird anschließend in Vakuumverdampfern bei 70 °C auf eine Konzentration von 650 g/L konzentriert. Eine weitere Konzentration unter Vakuum bei 70 °C erfolgt, bis sich Kristalle zu bilden beginnen (bei etwa 1300 g/L).
Diese Flüssigkristallmischung wird dann zur langsamen Abkühlung in Kristallisatoren überführt, um eine maximale Kristallausbeute zu erzielen. Nach dem Abkühlen wird die Mischung in Zentrifugen getrocknet, um die Kristalle von der Mutterlauge zu trennen.
Die Mutterlauge, die noch Weinsäure enthält, durchläuft wiederholte Zyklen der Eindampfung, Granulierung und Trocknung, um die Ausbeute an granulierter Weinsäure zu maximieren. Das erhaltene Granulat wird abgekühlt, um eine Weinsäurelösung mit 650 g/L zu bilden.
Diese Lösung wird einer weiteren Verarbeitung unterzogen, einschließlich der Entfärbung mit Aktivkohle und der chemischen Reinigung zur Entfernung von überschüssigem Eisen und Schwefelsäure, alles bei 70 °C. Anschließend wird filtriert und unter Vakuum eingeengt, bis die Kristallisation einsetzt.
Anschließend wird die Mischung in Kristallisatoren überführt oder abgekühlt, um die Kristallausbeute zu maximieren. Anschließend wird die Mischung durch Zentrifugation getrennt. Die Mutterlauge, die restliche Weinsäure enthält, durchläuft weitere Zyklen der Verdampfung, Granulierung und Trocknung, bevor sie erneut aufbereitet wird.
Das gereinigte Granulat wird in einem Ofen bei 140 °C getrocknet und anschließend in verschiedene Korngrößen von 2000 μm bis unter 100 μm (Pulver) gesiebt.
Während der oben beschriebene Prozess die primäre Methode ist, wurden auch andere Produktionsprozesse untersucht. Dazu gehören die fermentative Herstellung von L(+)-Weinsäure und die chemische Synthese von racemischer DL-Weinsäure.
4.2. L(+)-Weinsäureproduktion durch Fermentation
Während die herkömmliche Produktionsmethode von L(+)-Weinsäure auf chemischen Reaktionen beruht, wird derzeit an fermentationsbasierten Alternativen geforscht.
Zu diesem Zweck wurden zwei Hauptbakterienstämme untersucht:
- Acetobacter suboxydans: Diese Bakterienart wurde auf ihre Fähigkeit untersucht, Glucose in L(+)-Weinsäure umzuwandeln.
- Nocardia tartaricans: Dieses Bakterium ist vielversprechend bei der Umwandlung von cis-Epoxybernsteinsäure und ihren Natriumderivaten in das gewünschte Produkt.
4.3. Chemische Synthese von racemischer DL-Weinsäure
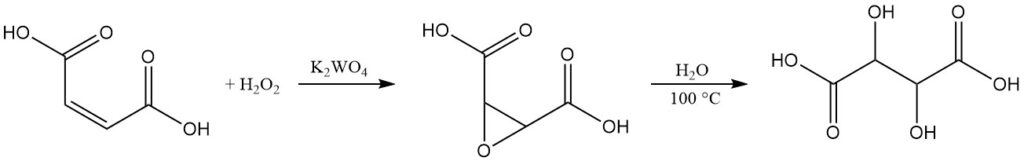
Während L(+)-Weinsäure den kommerziellen Markt dominiert, gibt es für racemische DL-Weinsäure ein Produktionsverfahren im kleinen Maßstab.
Diese Methode beginnt mit Maleinsäure oder ihren Salzen. In einer wässrigen Lösung wird Maleinsäure mit 35 %igem Wasserstoffperoxid in Gegenwart von Kaliumwolframat als Katalysator oxidiert. Diese Reaktion ergibt Epoxidbernsteinsäure, ein Zwischenprodukt.
Durch Kochen der Reaktionsmischung hydrolysiert die Epoxidbernsteinsäure unter Bildung von racemischer Weinsäure. Nach dem Abkühlen wird das Endprodukt durch Zentrifugieren, Waschen und Trocknen isoliert.
Mehrere Variationen dieses Prozesses wurden untersucht und in wissenschaftlichen Publikationen dokumentiert. Diese Forschungstätigkeit spiegelt sich auch in zahlreichen Patentanmeldungen für diese Methode wider.
Derzeit ist die kommerzielle Produktion von racemischer DL-Weinsäure noch begrenzt, da in Südafrika nur eine kleine Produktionsanlage in Betrieb ist.
5. Derivate der L(+)-Weinsäure
Weinsäure bildet leicht zahlreiche Salze und Ester, von denen einige bedeutende kommerzielle Anwendungen finden. In diesem Abschnitt werden die bekanntesten Verbindungen besprochen.
5.1. Natriumkaliumtartrat
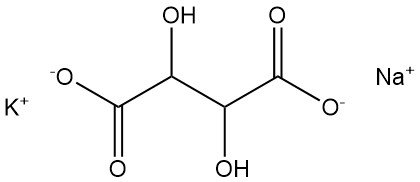
Natriumkaliumtartrat, auch Seignette-Salz oder Rochelle-Salz genannt, wurde 1672 von Pierre Seignette entdeckt.
Physikalische Eigenschaften:
- Formel: KNaC4H4O6 · 4 H2O
- CAS-Nummer: [6381-59-5]
- Molmasse: 282,23 g/mol
- Dichte: 1,79 g/cm³
- Schmelzpunkt: 70–80 °C (zersetzt sich bei 220 °C)
- Löslichkeit: 26 g/100 ml Wasser bei 0 °C, 66 g/100 ml Wasser bei 26 °C
Ausgangsstoff für die Herstellung von Natriumkaliumtartrat ist Weinstein mit einem Weinsäuregehalt von mindestens 68 %.
Diese Lösung wird mit Wasser verdünnt, mit heißem Natriumhydroxid neutralisiert, mit Aktivkohle entfärbt und dann filtriert. Das Filtrat wird durch Eindampfen konzentriert und dann durch Abkühlen kristallisiert, um das feste Salz zu erzeugen, das vor dem Verpacken abgetrennt, gewaschen, getrocknet und gesiebt wird.
Kommerzielle Korngrößen reichen von 2000 μm bis < 250 μm (Pulver).
5.2. Kaliumbitartrat
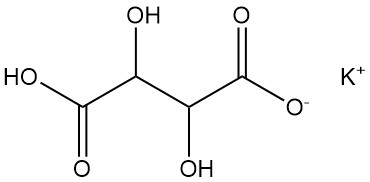
Kaliumbitartrat ist allgemein als Weinstein bekannt.
Physikalische Eigenschaften:
- Formel: KHC4H4O6
- CAS-Nummer: [868-14-4]
- Dichte: 1,96 g/cm³
- Löslichkeit: 0,57 g/100 ml Wasser bei 20 °C, 6,1 g/100 ml Wasser bei 100 °C
Es wird hauptsächlich aus der Mutterlauge gewonnen, die bei der Rochelle-Salzproduktion übrig bleibt. Kaliumbitartrat wird entfärbt, gereinigt, filtriert, mit Salzsäure oder Schwefelsäure angesäuert, ausgefällt, zentrifugiert, getrocknet, gemahlen und als feines Pulver verpackt.
5.3. Kaliumantimonyltartrat
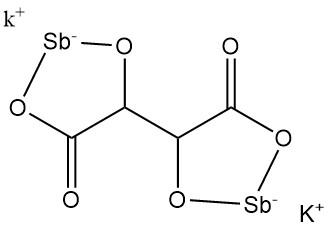
Kaliumantimonyltartrat (Brechstein-Brechmittel) wurde 1631 von Adrien de Mynsicht entdeckt.
Physikalische Eigenschaften:
- Formel: KSbC4H2O6 · 1,5 H2O
- CAS-Nummer: [28300-74-5]
- Molmasse: 333,93 g/mol
- Dichte: 2,61 g/cm³
- Löslichkeit: 8,7 g/100 ml Wasser bei 25 °C, 35,7 g/100 ml Wasser bei 100 °C
Kaliumantimonyltartrat wird durch die Reaktion von Antimonoxid mit der Weinsteincreme in Wasser hergestellt, gefolgt von die Konzentration der Restlösung und die Kristallisation. Nach der Filtration werden die Kristalle getrocknet und pulverisiert.
5.4. Metaweinsäure
Metaweinsäure entsteht durch Erhitzen von Weinsäure auf 170–180 °C. Diese Umwandlung beinhaltet eine interne Veresterung innerhalb der Weinsäuremoleküle, was zu einem mehr oder weniger polymerisierten Produkt führt. Metaweinsäure hat außergewöhnliche hemmende Eigenschaften gegen die Ausfällung von Weinsäuresalzen.
6. Verwendung von Weinsäure
L(+)-Weinsäure und ihre Derivate werden in verschiedenen Branchen verwendet, darunter in der Lebensmittel-, Pharma-, Weinbau- und anderen Industrie.
L(+)-Weinsäure (E 334) wird verwendet:
- als Säuerungsmittel in Weinmosten, Süßigkeiten, Gelees, Marmeladen, Fruchtnektaren, Eiscreme, Gelatine und Pasten und verbessert deren Geschmacksprofile.
- zur Konservierung von Obst, Gemüse oder Fisch als synergistisches Antioxidans, das pH-Wert, Farbe, Geschmack und Nährwert stabilisiert.
- Als Antioxidans in Fetten und Ölen.
- Bei der Zubereitung von kohlensäurehaltigen Getränken.
- Als Hilfsstoff oder Träger für pharmazeutische Wirkstoffe, der bei der Korrektur der Basizität hilft.
- Aufgrund seiner Stabilität und hohen Löslichkeit als Säuerungsmittel zum Aufschäumen von Tabletten und Pulvern
- Als Verzögerer in der Zementindustrie, insbesondere bei Gips und Gips.
- Beim Polieren und Reinigen von Metallen.
Weinstein (E 336) wird zur Beschleunigung der Ausfällung von Weinsäuresalzen in Wein, bei der Herstellung chemischer Hefen und als Abführmittel in einigen Arzneimittelformulierungen verwendet .
Seignette-Salz (E 337) wird in Galvanikprozessen zur Verbesserung der Abscheidung und Ausbeute, in der Elektronik und Piezoelektrizität, als Reduktionsmittel bei der Versilberung von Spiegeln usw. verwendet ein Bestandteil der Fehling-Lösung. Es wird auch als Verbrennungsregulator bei der Herstellung von Zigarettenpapier, als Abführmittel in einigen Arzneimitteln und als Beizmittel in der Textil- und Lederindustrie verwendet.
In geringen Mengen wird Kaliumantimonyltartrat als schleimlösendes Mittel in Hustensäften verwendet und hilft bei der Behandlung einiger Tropenkrankheiten.
Metaweinsäure wird verwendet, um die Weinsteinkristallisierung in Tafelweinen zu hemmen.
Tartrate von Fettsäuremonoglyceriden und -diglyceriden werden als Emulgatoren in der Backwarenindustrie verwendet.
7. Toxikologie von Weinsäure
Im Gegensatz zu Zitronensäure ist Weinsäure nicht direkt am Krebszyklus (Energieproduktionsweg) im menschlichen Körper beteiligt.
L(+)-Weinsäure, die natürliche Form, kommt in Früchten und Wein vor. Nach oraler Aufnahme werden etwa 20 % über den Urin ausgeschieden, während ein erheblicher Teil durch die Darmmikrobiota bakteriell abgebaut wird. Im Kot sind keine Spuren nachweisbar.
Resorbierte Weinsäure wird schnell aus dem Blutkreislauf ausgeschieden und entweder über die Nieren ausgeschieden oder in verschiedenen Geweben verstoffwechselt.
Langzeitstudien an Ratten mit L(+)-Natriumtartrat haben keine Anzeichen von Toxizität oder Karzinogenität ergeben. Darüber hinaus wurden bei einer Tagesdosis von 3 g/kg Körpergewicht keine negativen Auswirkungen auf die Nierenfunktion oder Pathologie beobachtet.
Racemische (DL)-Weinsäure wurde weniger umfassend untersucht und Forschungsergebnisse deuten darauf hin, dass sie sich anders verhält als das natürliche L(+)-Isomer.
DL-Weinsäure wird langsamer aus dem Blutkreislauf ausgeschieden und reichert sich über einen längeren Zeitraum in den Nieren an, was möglicherweise zu einer Gewichtszunahme in diesen Organen führt. Aufgrund dieser nephrotoxischen Wirkung ist die DL-Form nicht für die Verwendung in Lebensmitteln oder Arzneimitteln zugelassen.
Referenzen
- Tartaric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_163
- Tartaric Acid; Van Nostrand’s Encyclopedia of Chemistry. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471740039.vec2453
- Organic Acids in Fruits. https://onlinelibrary.wiley.com/doi/abs/10.1002/9781119431077.ch8
- Tartaric acid. https://www.sciencedirect.com/science/article/abs/pii/B9780128190968000197
