Trichloracetaldehyd (Chloral)
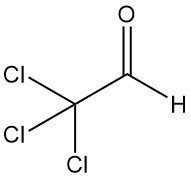
Trichloracetaldehyd [75-87-6], auch bekannt als Chloral oder 2,2,2-Trichlorethanal (CCl3CHO), ist eine farblose Flüssigkeit mit einem Molekulargewicht von 147,39 g/mol. Es wurde erstmals 1832 von Justus von Liebig durch Chlorierung von Ethanol hergestellt.
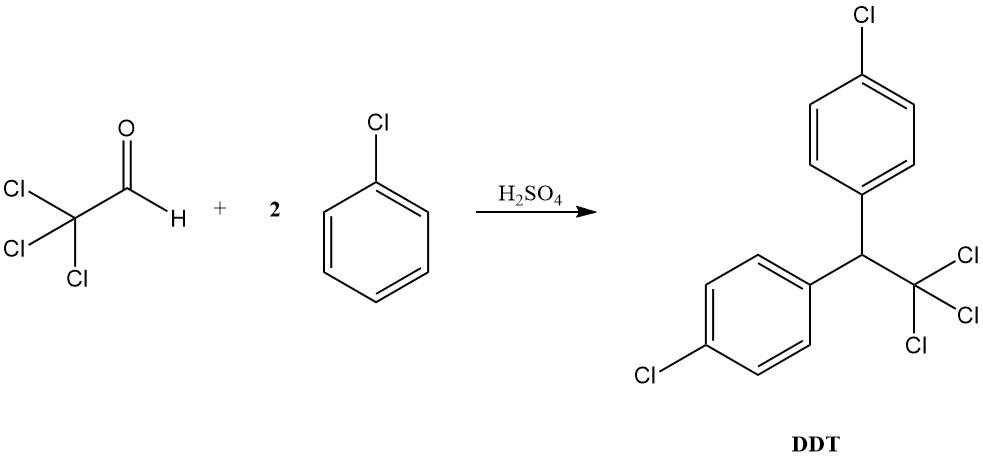
Chloral hat historische Bedeutung als erstes hypnotisches Medikament, das 1869 eingeführt wurde. Darüber hinaus dient es als Vorläufer des bekannten Insektizids DDT (1,1,1-Trichlor-2,2-bis(4-chlorphenyl)ethan). 1941 entdeckt.
Während Chloral in den 1960er Jahren eine wertvolle Chemikalie war, ist seine Verwendung seitdem aufgrund der aus Umweltgründen bestehenden Beschränkungen für DDT und andere chlorierte Insektizide erheblich zurückgegangen.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Trichloracetaldehyd
Chloral, auch bekannt als Trichloracetaldehyd oder Trichlorethanal, weist die folgenden physikalischen Eigenschaften auf:
- Schmelzpunkt: −56,5 °C
- Siedepunkt: 97,8 °C bei 101,3 kPa
- Dichte: 1,5121 g/cm³ bei 20 °C
- Brechungsindex: 1,4557 bei 20 °C
- Dampfdruck: 4,7 kPa bei 20 °C
- Aussehen: Farblose, bewegliche, ölige Flüssigkeit
- Geruch: Durchdringend
- Löslichkeit: Leicht löslich in Wasser, Alkohol, Ether und Chloroform
- Octanol-Wasser-Verteilungskoeffizient: 0,99 (niedrig)
- Azeotropbildung: Bildet Azeotrope mit 1,2-Dichlorethan, Heptan und Benzol
2. Chemische Reaktionen von Trichloracetaldehyd
Trichloracetaldehyd weist im Vergleich zu typischen Aldehyden besondere chemische Eigenschaften auf, die vor allem auf den starken elektronenziehenden Einfluss seiner drei Chloratome zurückzuführen sind. Es zersetzt sich bei Einwirkung von Sonnenlicht oder Hitze.
Chloral reagiert leicht mit Nukleophilen und bildet verschiedene Additionsprodukte. Mit Alkoholen bildet es isolierbare Halbacetale (CCl3CH(OH)OR) und bildet mit Wasser das bekannte Chloralhydrat [302-17-0] (CCl3CH(OH)2, Schmelzpunkt 53 °C und Siedepunkt 97,5 °C).
Im Gegensatz zu den meisten Aldehyden kann Chloral an vielen basenkatalysierten Kondensationen nicht teilnehmen. Starke Basen neigen dazu, die Kohlenstoff-Kohlenstoff-Bindung zu spalten, was je nach spezifischem Reagenz zu Produkten wie Chloroform und HCO2Na oder HCONR2 (R = Alkyl) führt.
CCl3CHO + NaOH → CHCl3 + HCO2Na
CCl3CHO + R2NH → CHCl3 + HCONR2 (R = alkyl)
Unter sauren Bedingungen verhält sich Chloral eher wie ein typischer Aldehyd, bildet Acetale mit Alkoholen und kondensiert mit aromatischen Verbindungen, um Diaryltrichlorethane zu erzeugen, wie beispielsweise die DDT-Bildung aus Chlorbenzol zeigt.
In Gegenwart anionischer Initiatoren wie Lithium-tert-butoxid polymerisiert Chloral zu einem unlöslichen, nicht brennbaren Hochpolymer der Formel [CH(CCl3)O]n Für dieses Polymer sind jedoch keine kommerziellen Anwendungen bekannt.
Durch Oxidation von Trichloracetaldehyd entsteht Trichloressigsäure.
3. Herstellung von Trichloracetaldehyd
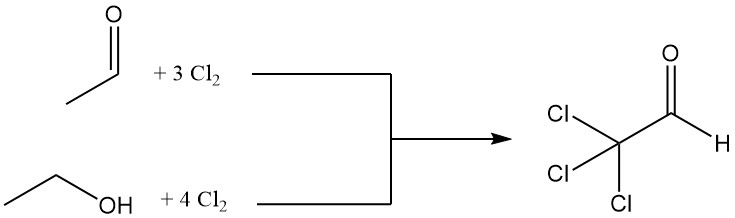
Chloral wird durch Chlorierung von Acetaldehyd oder Ethanol hergestellt, wobei Acetaldehyd aufgrund seiner wirtschaftlichen Vorteile häufig bevorzugt wird.
CH3CHO + 3 Cl2 → CCl3CHO + 3 HCl
Acetaldehyd reagiert mit Chlor in einer Salzsäure-Lösung, um Kondensationsnebenprodukte und Oxidation des Aldehyds zu reduzieren. Als Katalysator wird Antimontrichlorid verwendet.
Um die Reaktionsgeschwindigkeit aufrechtzuerhalten, wird die Temperatur schrittweise von 0 °C auf 90 °C erhöht.
Chloral wird aus der Mischung als Hydrat abdestilliert, das dann mit konzentrierter Schwefelsäure zersetzt wird, um es von der schwereren Säureschicht abzutrennen. Anschließend wird es über eine Fraktionierkolonne destilliert.
Für die Chlorierung von einem Mol Ethanol werden vier Mol Chlor benötigt, wobei ein Mol für die Oxidation zu Acetaldehyd verwendet wird.
CH3CH2OH + Cl2 → CH3CHO + 2 HCl
Reaktionsgefäße und Rohrleitungen sind mit säurebeständigen Materialien (Keramik usw.) ausgekleidet, um heißer Salzsäure standzuhalten. Ventile bestehen aus Nickel-Molybdän-Legierungen (Hastelloy B) für Korrosionsbeständigkeit.
Die technische Reinheit von Chloral liegt zwischen 94 % und 99 %, wobei Wasser die Hauptverunreinigung darstellt.
4. Verwendung von Trichloracetaldehyd
Ursprünglich wurde Chloral bei der Herstellung des Insektizids DDT eingesetzt, seine Einsatzmöglichkeiten gehen jedoch weit darüber hinaus. Obwohl DDT in vielen Ländern verboten ist, wird Chloral bei der Herstellung verschiedener anderer Insektizide wie Methoxychlor und Naled sowie bei Herbiziden (Trichloressigsäure) verwendet.
Es wird auch bei der Herstellung von Polyurethan-Hartschaum verwendet.
Trichloracetaldehyd kann bei Raumtemperatur zum Quellen von Stärkekörnern führen, was möglicherweise Auswirkungen auf verschiedene stärkebasierte Industrien hat.
Chloralhydrat, die Hydratform von Chloral, wurde in der Medizin als Beruhigungs- und Hypnotikum verwendet (Chloralbetain, α-Chloralose und Triclofos-Natrium). Während es hauptsächlich zur kurzfristigen Behandlung von Schlaflosigkeit eingesetzt wird, wird es auch zur Bewältigung von Angstzuständen, zur Sedierung vor Eingriffen und zur Behandlung von Entzugssymptomen bei Alkohol und anderen Drogen eingesetzt.
Die Verwendung bei Kindern ist zugunsten sichererer Alternativen zurückgegangen, in bestimmten medizinischen Situationen findet sie jedoch immer noch Anwendung.
In der Mikroskopie wird Hoyers Lösung, die Chloralhydrat enthält, verwendet, um verschiedene Organismen wie Moose, Farne, Samen und Arthropoden für eine detaillierte Beobachtung zu montieren.
5. Toxikologie von Chloral
Expositionssymptome:
- Chloral und sein Hydrat weisen identische Eigenschaften auf und wirken dämpfend auf das Zentralnervensystem.
- Therapeutische Dosen (0,5–1,0 g) wirken sich nur minimal auf Atmung und Blutdruck aus, höhere Dosen senken jedoch beides.
- Mit Ethanol treten synergistische Effekte auf, die die Wirkung von Chloral verstärken.
- Haut- und Schleimhautreizungen sind eine bekannte Nebenwirkung.
- Der Stoffwechsel wandelt Chloral in Trichlorethanol um, der Hauptfaktor für seine physiologischen Wirkungen.
- Die Ausscheidung erfolgt überwiegend durch Urin-Glucuronid-Konjugation.
Toxizität:
- Die orale Einnahme von 4–30 g hat sich bei Erwachsenen als tödlich erwiesen.
- Inhalationsstudien an Ratten zeigen eine hohe Toxizität, mit einem LC50 von 440 mg/m³ bei 4-stündiger Exposition.
- Chronische Exposition bei niedrigeren Konzentrationen (75–78 mg/m³) führt bei Ratten zu schweren Lungenschäden und zum Tod.
- Mutagenität wird im Ames-Test beobachtet.
- Für Chloral gibt es keine festgelegten Grenzwerte (TLV) oder maximal zulässigen Konzentrationen (MAK), was zu einer vorsichtigen Handhabung ähnlich wie bei chloracetaldehyd.
Karzinogenität:
- Die Internationale Agentur für Krebsforschung (IARC) klassifiziert Chloral und Chloralhydrat in Gruppe 3: „nicht klassifizierbar hinsichtlich seiner Karzinogenität für den Menschen“.
- Während in Tierversuchen nur begrenzte Beweise auf Karzinogenität schließen lassen, sind die Daten am Menschen nach wie vor unzureichend.
EU-Klassifizierung:
- Auf der Grundlage der Richtlinie 67/548/EWG werden Chloral und Chloralhydrat als „giftig“ (T) mit den Gefahrensätzen R25–36/38 bezeichnet, die auf Toxizität hinweisen Verschlucken und Haut-/Augenreizungen.
Referenz
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
