Titandioxid: ein vollständiger Überblick

Was ist Titandioxid?
Titandioxid ist eine anorganische Verbindung mit der chemischen Formel TiO2. Es ist ein weißer Feststoff, der wasserunlöslich ist. Titandioxid kommt in der Natur in den polymorphen Formen Rutil, Anatas und Brookit vor.
Rutil und Anatas werden industriell zur Herstellung von Pigmenten, Katalysatoren, Keramik und verschiedenen anderen technischen Materialien verwendet.
Titandioxid ist aufgrund seiner außergewöhnlichen Streueigenschaften, seiner hohen chemischen Stabilität und seiner Ungiftigkeit das wichtigste Weißpigment. Im Jahr 2007 wurden rund 5,0 Millionen Tonnen Titandioxidpigmente produziert.
Titandioxid gehört zu den fünf wirtschaftlich bedeutendsten anorganischen Chemikalien mit einem weltweiten Jahresumsatz von über 12 Milliarden US-Dollar.
Die Titandioxidproduktion stieg von 1,389 Millionen Tonnen im Jahr 1965 auf 3,220 Millionen Tonnen im Jahr 1995. Das Sulfatverfahren dominierte die Produktion zunächst (90,3 % im Jahr 1965), sank jedoch bis 1995 auf 46,0 %, da das Chloridverfahren von 9,7 % auf 54,0 % anstieg. Die Produktionskapazität erreichte 2008 5,915 Millionen Tonnen, wobei das Chloridverfahren mit 53,2 % gegenüber dem Sulfatverfahren mit 46,8 % leicht dominierte.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Titandioxid
Titandioxid kommt in drei kristallinen Formen vor: Rutil, Anatas und Brookit. Rutil ist thermodynamisch am stabilsten. Dennoch weisen Anatas und Brookit ähnliche Gitterenergien auf, was zu ihrer Langzeitstabilität beiträgt. Anatas wandelt sich oberhalb von 700 °C irreversibel in Rutil um. Brookit ist aufgrund seiner schwierigen Herstellung nur begrenzt industriell einsetzbar.
In allen drei Titandioxidformen ist jedes Titanatom oktaedrisch von sechs Sauerstoffatomen und jedes Sauerstoffatom trigonal von drei Titanatomen koordiniert. Die drei kristallinen Strukturen entsprechen unterschiedlichen Verknüpfungsarten der Oktaeder an ihren Ecken und Kanten.
Tabelle 1 zeigt die Kristallgitterkonstanten und -dichten dieser TiO2-Modifikationen.
Rutil und Anatas kristallisieren im tetragonalen System, Brookit im rhombischen System. Titandioxid schmilzt bei etwa 1800 °C. Oberhalb von 1000 °C steigt der Sauerstoffpartialdruck durch Sauerstofffreisetzung und Bildung niederer Titanoxide an. Dieser Prozess führt zu Farbveränderungen und verändert die elektrische Leitfähigkeit. Oberhalb von 400 °C tritt durch thermische Gitterausdehnung eine reversible Gelbfärbung auf.
Rutil weist die höchste Dichte und Atompackung auf, was zu einer höheren Härte (Mohs 6,5–7,0) als Anatas (Mohs 5,5–6,0) führt. Additive können die Härte dieser Materialien in praktischen Anwendungen erheblich beeinflussen.
Ein hoher Brechungsindex in Kombination mit minimaler Absorption im sichtbaren Spektrum macht Titandioxid zu einem außergewöhnlichen Weißpigment. Die durchschnittlichen Brechungsindizes betragen 2,55 für Anatas und 2,80 für Rutil und sind wellenlängenabhängig.
Titandioxid ist ein lichtempfindlicher Halbleiter, der elektromagnetische Strahlung im nahen UV-Bereich absorbiert. Die Bandlückenenergie, die den Energieunterschied zwischen Valenz- und Leitungsband darstellt, beträgt 3,03 eV für Rutil und 3,15 eV für Anatas, was Absorptionskanten bei 415 nm bzw. 385 nm entspricht.
Basierend auf dem Wendepunkt der Absorptionskurve betragen diese Werte 3,13 eV (397 nm) für Rutil und 3,29 eV (377 nm) für Anatas. Spurenverunreinigungen, wie z. B. Eisen (ppm) können eine Absorption im sichtbaren Bereich verursachen und zu einer Abweichung von reinem Weiß führen.
Die Absorption von Lichtenergie regt ein Elektron vom Valenzband in das Leitungsband an. Das entstehende mobile Elektron und Elektronenloch kann an der Oberfläche des Festkörpers wandern und dort an Redoxreaktionen teilnehmen.
| Phase | CAS-Registrierungsnummer | Kristallsystem | Gitterkonstanten, nm | Dichte, g/cm3 |
|---|---|---|---|---|
| Rutil | [1317-80-2] | tetragonal | a = 0,4594, c = 0,2958 | 4,21 |
| Anatas | [1317-70-0] | tetragonal | a = 0,3785, c = 0,9514 | 4,06 |
| Brookit | [12188-41-9] | rhombisch | a = 0,9184, b = 0,5447, c = 0,5145 | 4,13 |
2. Chemische Eigenschaften von Titandioxid
Titandioxid weist amphotere Eigenschaften mit schwach sauren und basischen Eigenschaften auf. Daher sind Alkalimetalltitanate und freie Titansäuren in wässrigen Umgebungen instabil und hydrolysieren zu amorphen Titanoxidhydroxiden.
Titandioxid ist chemisch sehr stabil und reagiert nicht mit den meisten organischen und anorganischen Reagenzien. Es löst sich in konzentrierter Schwefelsäure bei längerem Erhitzen und in Flusssäure auf. Auch geschmolzene alkalische und saure Substanzen greifen es an und lösen es auf.
Bei erhöhten Temperaturen reagiert TiO2 mit Reduktionsmitteln wie Kohlenmonoxid, Wasserstoff und Ammoniak zu niederwertigen Titanoxiden ohne Bildung von metallischem Titan. Oberhalb von 500 °C reagiert Titandioxid in Gegenwart von Kohlenstoff mit Chlor zu Titantetrachlorid.
3. Oberflächeneigenschaften von Titandioxidpigmenten
Die spezifischen Oberflächen von handelsüblichem Titandioxid liegen je nach Anwendung zwischen 0,5 und über 300 m²/g. Standardpigmente weisen Oberflächen von 5–30 m²/g auf.
Die Oberfläche von Titandioxid ist von Natur aus mit koordinativ gebundenem Wasser bedeckt, wodurch Hydroxylgruppen entstehen. Dadurch ist die Oberfläche von unbeschichtetem Titandioxid polar. Die Hydroxylgruppen an der Oberfläche beeinflussen Pigmenteigenschaften wie Dispergierbarkeit und Wetterbeständigkeit.
Das Vorhandensein dieser Hydroxylgruppen an der Oberfläche ermöglicht verschiedene photochemische Reaktionen, wie die photokatalytische Zersetzung von Wasser in Wasserstoff und Sauerstoff und die Reduktion von Stickstoff zu Ammoniak und Hydrazin.
4. Industrielle Produktion von Titandioxid
Kommerzielle Titandioxidproduktion erfolgt hauptsächlich nach zwei unterschiedlichen industriellen Verfahren: dem Sulfatverfahren und dem Chloridverfahren. Beide Verfahren dienen der Herstellung von Titandioxidpigmenten.
Das Sulfatverfahren ist ein älteres Verfahren, bei dem titanreiche Rohstoffe, wie z. B. Ilmenit, bei hohen Temperaturen (150–220 °C) mit konzentrierter Schwefelsäure reagieren. Dabei entsteht eine Lösung, die Titan, Eisen und andere Verunreinigungen enthält. Durch anschließende Hydrolyse- und Reinigungsschritte wird ein Titanoxidhydrat ausgefällt. Dieses Hydrat wird anschließend kalziniert (auf hohe Temperaturen erhitzt), gemahlen und häufig beschichtet, um das endgültige Pigment zu erhalten.
Beim Chloridverfahren werden titanhaltige Rohstoffe wie Ilmenit oder Rutil bei noch höheren Temperaturen (700–1200 °C) chloriert. Dabei entsteht Titantetrachlorid (TiCl4), das anschließend bei 900–1400 °C zu Titandioxid oxidiert wird. Ähnlich wie beim Sulfatverfahren wird das entstandene TiO2 anschließend gemahlen und beschichtet.
Obwohl diese beiden Verfahren die Pigmentproduktion dominieren, gibt es auch andere spezialisierte Methoden zur Herstellung von Titandioxid ohne Pigmenteigenschaften, insbesondere für die Nanopartikelsynthese. Zu diesen alternativen Methoden gehören Techniken wie die Hydrolyse von Titanalkoholaten oder die pyrolytische Reaktion von Titantetrachlorid mit Wasser.
Detaillierte Informationen zu den Herstellungsprozessen von Titandioxid finden Sie im folgenden Artikel.
4.1. Herstellung von Titandioxid nach dem Sulfatverfahren
Das Sulfatverfahren zur Herstellung von Titandioxid umfasst mehrere Schritte. Es beginnt mit der Vermahlung titanhaltiger Rohstoffe zu einem feinen Pulver (unter 40 μm) nach der Trocknung. Anschließend erfolgt der Aufschluss, bei dem das gemahlene Material bei hohen Temperaturen (bis zu 220 °C) mit konzentrierter Schwefelsäure (80–98 %) vermischt wird. Dabei entsteht eine feste Aufschlussmasse.
Diese feste Masse wird anschließend in kaltem Wasser oder verdünnter Säure gelöst und reduziert, um eine Titandioxidlösung zu bilden. Dabei wird dreiwertiges Eisen zu zweiwertigem Eisen reduziert, um Verunreinigungen zu vermeiden. Anschließend wird die Lösung geklärt, um alle ungelösten Feststoffe durch Absetzen und Filtrieren zu entfernen. Bei Lösungen aus Ilmenit wird Eisensulfat durch Abkühlung kristallisiert, um seine Konzentration zu reduzieren.
Der Schlüsselschritt ist die Hydrolyse, bei der Titanoxidhydrat bei 94–110 °C aus der Lösung abgeschieden wird. Dabei werden häufig Keime zur Steuerung der Partikeleigenschaften eingesetzt. Dieses Hydrolysat wird anschließend durch Reduktion (Bleichen) mit Mitteln wie Zink- oder Aluminiumpulver gereinigt, um verbleibende farbige Verunreinigungen zu entfernen. Anschließend erfolgt eine zweite Filtration und Wäsche.
Vor dem letzten Erhitzungsschritt wird das Hydrat mit Alkalimetallverbindungen und Phosphorsäure sowie manchmal mit Rutilkeimen und Stabilisatoren dotiert, um spezifische Pigmenteigenschaften zu erzielen.
Abschließend wird das dotierte Hydrat in Drehrohröfen bei 800–1100 °C kalziniert, um Wasser und restliche Schwefelsäure zu entfernen und das Hydrat in kristallines Titandioxid umzuwandeln. Der entstehende Klinker wird anschließend (nass oder trocken) gemahlen, um die gewünschte Pigmentfeinheit zu erreichen.
4.2. Herstellung von Titandioxid nach dem Chloridverfahren
Das Chloridverfahren zur Herstellung von Titandioxidpigment beginnt mit der Chlorierung. Dabei werden titanhaltige Rohstoffe und Petrolkoks in einem Wirbelschichtreaktor bei hohen Temperaturen (800–1200 °C) mit Chlor und Sauerstoff zu Titantetrachlorid (TiCl4) umgesetzt.
Die entstehenden heißen Reaktionsgase werden gekühlt, um zunächst andere feste Chloride und Staub vom TiCl4 zu trennen und anschließend den Großteil des Titantetrachlorids durch Abkühlung auf unter 0 °C zu kondensieren.
Das kondensierte TiCl4 wird anschließend durch Destillation gereinigt, um feste Chloride und gelöste Verunreinigungen wie Chlor, Vanadiumtetrachlorid und Phosgen zu entfernen und so ein hochreines Titantetrachloridprodukt zu erhalten.
Abschließend wird der gereinigte TiCl4-Dampf erhitzt und in einem speziell konstruierten Reaktor bei sehr hohen Temperaturen (900–1400 °C) mit vorgewärmtem Sauerstoff umgesetzt. Dabei entstehen Titandioxidpigment und Chlorgas.
Das TiO2-Pigment wird anschließend vom Gasstrom abgetrennt, und das Chlorgas wird häufig wieder in den Chlorierungsschritt zurückgeführt. Die Qualität des Pigments (Partikelgröße und -verteilung) wird durch Faktoren wie Reaktionstemperatur und die Zugabe spezifischer Verbindungen sorgfältig kontrolliert.
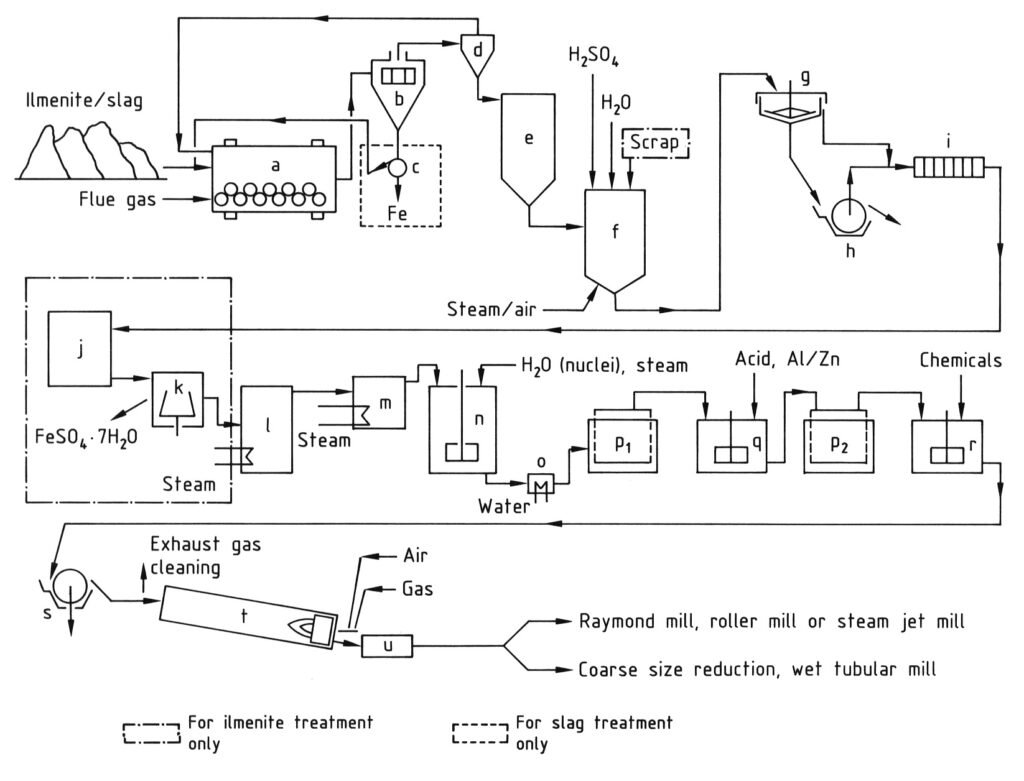
a) Kugelmühle/Trockner; b) Sieb; c) Magnetabscheider; d) Zyklon; e) Silo; f) Aufschlussbehälter; g) Eindicker; h) Rotationsfilter; i) Filterpresse; j) Kristallisator; k) Zentrifuge; l) Vakuumverdampfer; m) Vorwärmer; n) Rührbehälter zur Hydrolyse; o) Kühler; p) Moore-Filter; q) Rührbehälter zum Bleichen; r) Rührbehälter zum Dotieren; s) Rotationsfilter zur Entwässerung; t) Drehrohrofen; u) Kühler
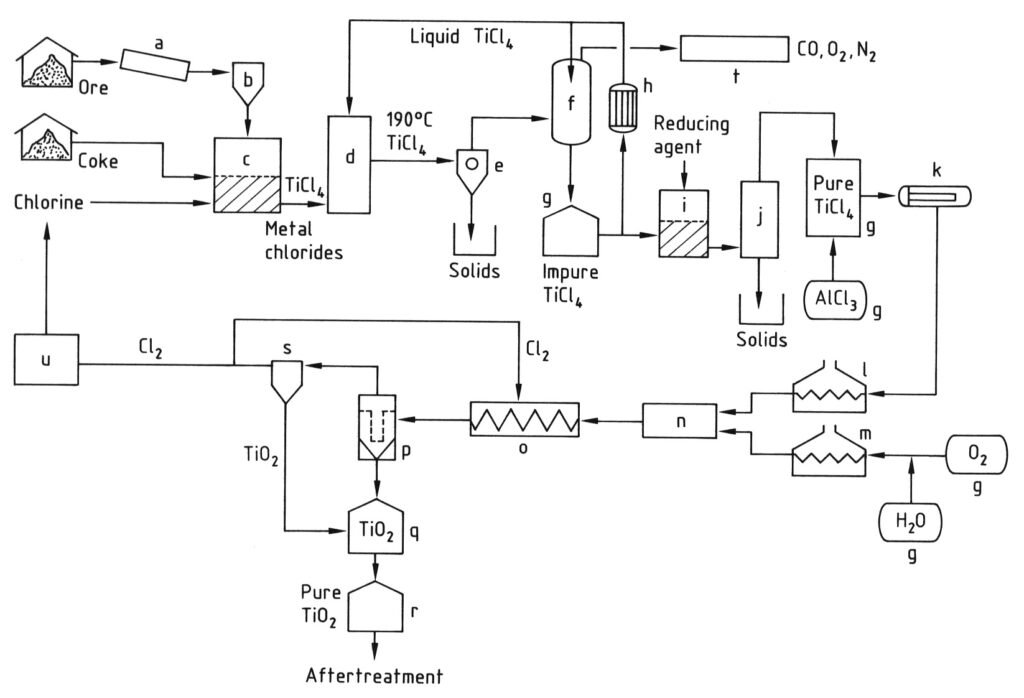
a) Mühle; b) Silo; c) Wirbelschichtreaktor; d) Kühlturm; e) Abtrennung der Metallchloride; f) TiCl4-Kondensation; g) Tank; h) Kühler; i) Vanadiumreduktion; j) Destillation; k) Verdampfer; l) TiCl4-Überhitzer; m) O2-Überhitzer; n) Brenner; o) Kühlschlange; p) Filter; q) TiO2-Reinigung; r) Silo; s) Gasreinigung; t) Abgasreinigung; u) Cl2-Verflüssigung
5. Pigmenteigenschaften von Titandioxid
Zu den wichtigen Pigmenteigenschaften von Titandioxid gehören Streuvermögen, Deckvermögen, Helligkeit, Vollton, Glanzbildung, Glanzschleier, Dispergierbarkeit, Lichtechtheit und Wetterbeständigkeit. Diese Eigenschaften hängen von chemischer Reinheit, Gitterstabilisierung, Partikelgrößenverteilung und Oberflächenbeschichtung ab. Die Bewertung der Eigenschaften erfordert die Berücksichtigung der Pigment-Matrix-Wechselwirkungen.
5.1. Streuvermögen
Die Brechungsindizes von Rutil (n = 2,80) und Anatas (n = 2,55) sind sogar höher als die von Diamant (n = 2,42). Die relativen Brechungskoeffizienten liegen typischerweise zwischen 1,5 und 2,0 für verschiedene Bindemittelsysteme.
Die optimale Streuung erfolgt gemäß der Mie-Theorie bei einer Partikelgröße von 0,2 μm. Das Streuvermögen hängt von der Wellenlänge ab; kleinere Titandioxidpartikel streuen blaue Untertöne, größere Partikel gelbe Untertöne.
5.2. Körperfarbe und Farbe
Der Weißgrad von Titandioxid hängt von Reinheit, kristalliner Modifikation und Partikelgröße ab. Anataspigmente haben im Vergleich zu Rutilpigmenten einen geringeren Gelbstich, da ihre Absorptionsbande (385 nm) in den UV-Bereich verschoben ist.
Das Vorhandensein von Verunreinigungen durch Übergangselemente beeinflusst den Weißgrad. Daher weisen Chlorid-Pigmente eine höhere Farbreinheit auf, da das TiCl4 vor der Oxidation destillativ gereinigt wird.
5.3. Dispersion
Eine effektive Zerkleinerung und Dispersion von Titandioxidpigmenten ist entscheidend für hohen Glanz und minimalen Glanzschleier. Sie wird durch intensives Mahlen und organische Oberflächenbeschichtung erreicht. Die Wahl der Oberflächenbehandlung hängt von den Anwendungsanforderungen ab.
5.4. Lichtechtheit und Wetterbeständigkeit
Die Verwitterung titandioxidhaltiger Farben und Beschichtungen führt zur Auskreidung der Pigmente. Sauerstofffreiheit oder eine geringe Sauerstoffdurchlässigkeit in Bindemitteln (z. B. Melamin-Formaldehyd-Harzen) verhindert zwar die Kreidung, führt aber zu einer reversiblen Vergrauung. In Abwesenheit von Wasser wird die Vergrauung deutlich reduziert.
Anatas ist anfälliger für beide Effekte. Pigmenthersteller nutzen Stabilisierungsmethoden wie die Dotierung mit Zink oder Aluminium vor der Kalzinierung oder während der Oxidation.
In Gegenwart eines stabilen Bindemittels wirken Titandioxidpigmente als Photokatalysatoren und induzieren den Bindemittelabbau. Bei Bindemitteln mit geringer Stabilität schützen sie das Bindemittel vor Abbau. Daher sind für Haltbarkeitsprüfungen hochstabile Bindemittelsysteme erforderlich.
Der Abbaumechanismus folgt einem fünfstufigen Zyklus:
- Durch Wasseradsorption bilden sich Hydroxygruppen an der Oberfläche.
- Die Absorption kurzwelligen Lichts (Anatas <385 nm, Rutil <415 nm) erzeugt ein Elektron und ein Elektronenloch (Exziton) im Kristallgitter, die zur Pigmentoberfläche wandern.
- An der Oberfläche wird ein OH–-Ion durch das Elektronenloch zu einem OH•-Radikal oxidiert. Dieses OH•-Radikal desorbiert und kann das Bindemittel oxidativ abbauen. Gleichzeitig wird Ti4+ durch das verbleibende Elektron zu Ti3+ reduziert.
- Das Ti3+-Ion wird durch adsorbierten Sauerstoff zu einem O2–-Ion oxidiert, das mit H+ zu einem HO2•-Radikal reagiert.
- Der Zyklus endet mit der Bindung von Wasser an die regenerierte TiO2-Oberfläche.
Zusammenfassend lässt sich sagen, dass der Kreidungsprozess die Reaktion von Wasser und Sauerstoff zur Bildung von OH•– und HO2•-Radikalen unter dem Einfluss kurzwelliger Strahlung und der katalytischen Aktivität der Titandioxidoberfläche ist.
Dieser Zyklus kann durch Luft- oder Wasserausschluss unterbrochen werden. Sauerstoffausschluss oder geschwindigkeitsbegrenzende Sauerstoffdiffusion im Bindemittel führt zur Ansammlung von Ti3+-Ionen und Vergrauung, die sich bei allmählicher Sauerstoffeinwirkung wieder auflöst. Wasserausschluss verhindert die Rehydratation und die Bildung von Oberflächenhydroxylen.
Trotz dieser photochemischen Aktivität stabilisieren behandelte Rutilpigmente viele Bindemittel, indem sie das Eindringen von Licht in Beschichtungsschichten verhindern. Hochwertige TiO2-Pigmente müssen eine ausgezeichnete Witterungsbeständigkeit aufweisen, z. B. dürfen sie nach einem zweijährigen Florida-Test nicht deutlich auskreiden oder ihren Glanz verlieren.
5.5. Abrasivität
Abrasivität ist eine unerwünschte Eigenschaft von Titandioxidpigmenten. Anatas weist eine geringere Abrasivität (Mohs 5,5–6,0) als Rutil (Mohs 6,5–7,0) auf. Obwohl die intrinsischen Härtewerte ähnlich erscheinen, beeinflussen Dotierstoffe die praktische Härte erheblich.
So weisen beispielsweise mit Aluminiumoxid dotierte Rutilpigmente eine deutlich höhere Abrasivität auf als Anataspigmente ohne Aluminiumoxid. Pigmente aus dem Chloridprozess, die typischerweise mehr Aluminiumoxid enthalten, weisen oft eine höhere Abrasivität auf als Sulfatpigmente.
Dieses Phänomen wird auf die Segregation von Akzeptorionen wie Al2O3 an der Oberfläche während der Kalzinierung zurückgeführt, selbst bei niedrigen Konzentrationen (<0,4 %). Daher erfordern Untersuchungen der Oberflächentopologie und der Gitterparameter von Titandioxid ultrahochreine Materialien, um Fehlinterpretationen zu vermeiden.
6. Verwendung von pigmentärem Titandioxid
Titandioxid hat sich weltweit durchgesetzt und andere Weißpigmente nahezu verdrängt. Im Jahr 2007 war Asien weltweit führend im Verbrauch, gefolgt von Europa und Nordamerika. Rutil macht etwa 90 % des Gesamtverbrauchs aus, Anatas 10 %.
6.1. Verwendung in Farben und Lacken
Farben und Lacke sind der größte Verbraucher von Titandioxid. Das TiO2-Pigment verbessert die Schutzeigenschaften von Beschichtungsmaterialien. Moderne TiO2-Pigmente können dünne Schichten (wenige Mikrometer) bilden und so eine vollständige Substratabdeckung gewährleisten. Die Pigmentvolumenkonzentrationen liegen in Glanzfarben zwischen 10 % und 35 % und in matten Dispersionsfarben bei über 80 %.
Handelsübliche Pigmente ermöglichen die Farbherstellung mit einfachen Dispersionsgeräten wie Scheibendissolvern. Eine organische Behandlung vor der Dampfstrahlmikronisierung verbessert den Glanz und reduziert den Glanzschleier in Einbrennlacken. Bei der Lagerung dieser Produkte kommt es nicht zu Sedimentation, und sie weisen eine gute Lichtechtheit und Wetterbeständigkeit auf.
6.2. Verwendung in Druckfarben
Moderne Druckverfahren arbeiten mit Schichtdicken unter 10 μm und erfordern daher möglichst feine Titandioxidpigmente. Diese ultradünnen Schichten sind nur mit TiO2-Pigmenten möglich, deren aufhellende (reduzierende) Wirkung siebenmal höher ist als die von Lithopone.
Eine hervorragende Dispergierbarkeit ist entscheidend für den Glanz. Der neutrale Vollton von Titandioxid macht es besonders geeignet zum Aufhellen von Buntpigmenten.
6.3. Verwendung in Kunststoffen
Titandioxid wird häufig zum Einfärben von langlebigen und nicht langlebigen Kunststoffprodukten verwendet, darunter Spielzeug, Haushaltsgeräte, Autos, Möbel und Verpackungsfolien. TiO2-Pigmente absorbieren UV-Strahlung unter 415 nm und werden daher zum Schutz pigmentierter Kunststoffe vor schädlicher Strahlung eingesetzt.
Schon geringe Mengen Titandioxid verleihen Kunststoffen Opazität und werden daher dunklen Produkten zugesetzt, um ein durchscheinendes, schmieriges Aussehen zu verhindern.
6.4. Verwendung in Fasern
Titandioxidpigmente verleihen synthetischen Fasern ein solides Aussehen, indem sie die durchscheinenden Eigenschaften und das damit verbundene fettige Aussehen beseitigen. Anataspigmente werden in dieser Anwendung bevorzugt, da sie im Vergleich zu Rutil eine geringere abrasive Wirkung auf Spinnmaschinen haben. Eine geeignete Beschichtung kann die schlechte Lichtechtheit von Anataspigmenten in Polyamidfasern verbessern.
6.5. Verwendung in Papier
In Europa werden Füllstoffe wie Kaolin, Kreide oder Talkum häufig zum Aufhellen und Opazifizieren von Papier verwendet. Titandioxidpigmente eignen sich ideal für hochweißes Papier, das bei sehr dünnen Stärken Opazität erfordert (z. B. Luftpost- oder Dünndruckpapier).
TiO2 kann dem Papierbrei zugesetzt oder als Beschichtung für eine hervorragende Kunstpapierqualität aufgetragen werden. Laminierte Papiere werden typischerweise mit extrem lichtechten Rutilpigmenten eingefärbt, bevor sie mit Melamin-Harnstoff-Harz für dekorative Schichten oder Folien imprägniert werden.
6.6. Weitere Anwendungen
Titandioxidpigmente werden in der Emaille- und Keramikindustrie, der Weißzementherstellung sowie zur Einfärbung von Gummi und Linoleum eingesetzt. Darüber hinaus werden sie als UV-Absorber in Sonnenschutzmitteln, Seifen, Kosmetikpudern, Cremes, Zahnpasta und Zigarrenhüllen verwendet.
Titandioxid wird aufgrund seiner Eigenschaften wie Ungiftigkeit (orale Aufnahme), Haut- und Schleimhautverträglichkeit und guter Dispergierbarkeit in verschiedenen Lösungen und Bindemitteln auch als Lebensmittelfarbstoff und in der Kosmetikindustrie allgemein eingesetzt.
Elektrisch leitfähige TiO2-Pigmente wurden durch Oberflächenbehandlung mit Indium-Zinn- oder Antimon-Zinn-Mischoxidbeschichtungen hergestellt. Diese Pigmente werden in Fasern für elektrofotografische Papiere und bei der Herstellung antistatischer Kunststoffe verwendet.
7. Verwendung von nichtpigmentärem Titandioxid

Nichtpigmentäres TiO2 wird in Emaille, Glas und Glaskeramik, Elektrokeramik, Katalysatoren und Katalysatorträgern, Schweißflussmitteln, Farbpigmenten, elektrischen Leitern, chemischen Zwischenprodukten (z. B. Kaliumfluortitanat), Strukturkeramik, UV-Absorbern und feuerfesten Auskleidungen verwendet.
7.1. Elektrokeramik
Titanate (z. B. Barium-, Strontium-, Calcium- und Bleititanat), die aus hochreinen Titandioxidsubstraten synthetisiert werden, werden zur Herstellung von Kondensatoren, PTC-Widerständen und piezoelektrischen Materialien verwendet.
Die Anforderungen an TiO2-Ausgangsmaterialien hinsichtlich Reinheit, Reaktivität und Sintereigenschaften steigen aufgrund des Miniaturisierungstrends bei elektronischen Bauteilen, der dünnere Keramikschichten und kleinere Partikel erfordert.
Jüngste Fortschritte bei der Verwendung von Titanoxidhydrat (aus dem Sulfatverfahren) ermöglichen die Festkörperproduktion von hochreinem, ultrafeinem BaTiO3 bei Temperaturen unter 500 °C.
Piezokeramische Mehrschichtkomponenten, wie z. B. Aktuatoren für Kraftstoffeinspritzsysteme, erfordern niedrigsinternde Keramiken. Hochreaktive TiO2– und ZrO2-Komponenten für Blei-Zirkonat-Titanat (PZT) ermöglichen die Bildung von Perowskitstrukturen und das anschließende Sintern bei Temperaturen, die niedrig genug sind, um den teuren Palladiumgehalt in den Elektroden dieser Aktuatoren deutlich zu reduzieren.
Der weltweite Titandioxidverbrauch für Elektrokeramiken liegt bei über 10.000 Tonnen pro Jahr. Trotz der Miniaturisierung elektrokeramischer Komponenten, die zu einem geringeren Rohstoffbedarf pro elektronischem Bauteil führt, ist mit einem weiteren jährlichen Wachstum zu rechnen.
7.2 Katalysatoren
Titandioxid wird als aktiver Katalysator für verschiedene thermische und photochemische Reaktionen eingesetzt, an denen sowohl anorganische als auch organische Verbindungen beteiligt sind. Es kann selbsttragend oder auf anderen Materialien abgeschieden sein. Die Dotierung mit zusätzlichen Elementen verstärkt typischerweise die gewünschte katalytische Wirkung.
Die primäre katalytische Anwendung von Titandioxid ist die Entfernung von Stickoxiden aus industriellen Abgasen (Kraftwerke, Müllverbrennungsanlagen und Dieselfahrzeuge). Bei diesem Prozess, der sogenannten selektiven katalytischen Reduktion (SCR), reagieren Stickoxide in Gegenwart von Sauerstoff mit Ammoniak über dem Katalysator zu Stickstoff und Wasser.
Der weltweite Verbrauch von Titandioxid für SCR-Katalysatoren beträgt ca. 25.000 t/a. Diese Katalysatoren enthalten typischerweise bis zu 15 % Wolframoxid und etwa 1 % V2O5 neben TiO2. Zu den Herstellungsverfahren für Katalysatoren gehören die Extrusion in Wabenform, die Beschichtung von Substraten (z. B. Cordierit) oder die Beschichtung von Metallblechen.
Um eine dauerhafte katalytische Aktivität über lange Lebensdauern zu gewährleisten, gelten strenge Anforderungen an Reinheit, Partikelgröße und Porosität. Es wird mit einer steigenden Nachfrage nach Stickoxidentfernungslösungen für stationäre und mobile Dieselmotoren gerechnet.
Zahlreiche weitere katalytische Anwendungen nutzen reines TiO2, TiO2 mit eingearbeiteten Additiven oder TiO2 mit oberflächlich abgeschiedenen Metallen (z. B. Rh, Pt, Pd, Au, Ag).
7.3. Photokatalysatoren
Umfassende globale Forschung konzentriert sich auf die Nutzung der Photoaktivität unbehandelter oder behandelter Titandioxid-Nanopartikel. Titandioxid kann für den katalytischen Abbau organischer Verbindungen in Abwässern oder für die photokatalytische Luftreinigung eingesetzt werden.
Die Photokatalyse von reinem TiO2 erfordert aufgrund der Halbleiterbandlücke von ca. 3,1 eV UV-Strahlung und wird daher nur im Außenbereich eingesetzt. Die Dotierung von Titandioxid mit Metallen, Kohlenstoff oder Stickstoff ermöglicht jedoch photokatalytische Reaktionen im sichtbaren Spektrum. Dennoch kann die Strahlungsintensität selbst für Anwendungen mit sichtbarem Licht ein limitierender Faktor sein.
Beispiele für aktuelle photokatalytische Anwendungen sind selbstreinigende Architekturbeschichtungen (Außenbeschichtungen), Innenbeschichtungen zum Abbau von Luftschadstoffen in Gebäuden sowie Bodenfliesen, Beschichtungen oder Beton mit nanostrukturiertem Titandioxid zum Abbau von Stickoxiden in Städten.
Diese Technologien sind auf spezielle Anwendungen beschränkt, wie z. B. Krankenhäuser oder Orte von besonderem öffentlichen Interesse.
7.4. Mischmetalloxidpigmente
Anataspigmente oder Titandioxidhydrolysate werden mit Übergangsmetalloxiden kalziniert, um Chromrutil- oder Nickelrutilpigmente (Mischmetalloxidpigmente) zu bilden.
7.5. UV-Absorption
Nanostrukturierte TiO2-Partikel (5–50 nm) werden in Sonnenschutzmitteln für die Kosmetikindustrie und für UV-Schutzbeschichtungen (z. B. für Holz) eingesetzt. Üblicherweise werden nanostrukturierte Rutilpartikel mit anorganischen und optional organischen Beschichtungen verwendet.
Nanostrukturiertes Titandioxid erscheint transparent; es absorbiert effektiv UV-B- (280–320 nm) und UV-A-Strahlung (320–400 nm). Aufgrund ihrer geringen Partikelgröße benötigen diese nanostrukturierten Titandioxidpartikel im Vergleich zu pigmentiertem TiO2 eine stärkere anorganische oder organische Beschichtung.
7.6. Weitere Anwendungen
Nichtpigmentiertes Titandioxid wird auch in Batterien, Brennstoffzellen, Wasserspaltungs- und Photovoltaiksystemen eingesetzt. Lithiumtitanat-basierte Batterien gewinnen als wiederaufladbare Energiespeicher für verschiedene Anwendungen an Bedeutung.
Während die TiO2-basierten Photovoltaiksysteme (Grätzel-Zellen) gut verstanden sind, bedarf die Anwendung von Titandioxid in Brennstoffzellen und zur photokatalytischen Wasserstofferzeugung aus Wasser mittels Sonnenlicht noch erheblicher Forschungsarbeit.
8. Toxikologie von Titandioxid
Titandioxid weist nach oraler Verabreichung eine gute Stabilität und völlige Ungiftigkeit auf. Langzeitstudien an Tieren mit diätetischem TiO2 zeigten keine Hinweise auf eine Titanaufnahme.
In der Vergangenheit wurde die Aufnahme von fein verteilten Titandioxidpigmenten in die Lunge nicht mit spezifischen krebserregenden Wirkungen in Verbindung gebracht. Infolgedessen stufte die Internationale Agentur für Krebsforschung (IARC) Titandioxid zunächst als Stoff der Klasse 3 ein, was bedeutete, dass es „nicht hinsichtlich seiner Karzinogenität für den Menschen klassifizierbar“ war.
2007 stufte die IARC TiO2 jedoch als Stoff der Klasse 2B neu ein und gab an, dass es „möglicherweise krebserregend für den Menschen“ sei. Diese Einstufung gilt sowohl für Titandioxid in Pigmentqualität (Primärpartikelgröße 200–300 nm) als auch für ultrafeine Qualitäten (Primärpartikelgröße unter 50 nm).
Trotz dieser Neuklassifizierung haben epidemiologische Studien zur Exposition von Arbeitnehmern gegenüber Titandioxidstaub keine erhöhte Mortalität oder Lungenkrebsinzidenz gezeigt.
Referenzen
- Auer, G., Woditsch, P., Westerhaus, A., Kischkewitz, J., Griebler, W.-d., Rohe, M. and Liedekerke, M. (2017). Pigments, Inorganic, 2. White Pigments. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.n20_n01.pub2
- Kang, X.; Liu, S.; Dai, Z.; He, Y.; Song, X.; Tan, Z. „Titanium Dioxide: From Engineering to Applications.“ Catalysts, 2019, 9 (2), 191. DOI: 10.3390/catal9020191.
- Haider, A. J.; Jameel, Z. N.; Al-Hussaini, I. H. M. „Review on: Titanium Dioxide Applications.“ Energy Procedia, 2019, 157, 17-29. DOI: 10.1016/j.egypro.2018.11.159.
- Fujishima, A.; Rao, T. N.; Tryk, D. A. „Titanium dioxide photocatalysis.“ Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2000, 1 (1), 1-21. DOI: 10.1016/S1389-5567(00)00002-2.
- Diebold, U. „The surface science of titanium dioxide.“ Surface Science Reports, 2003, 48 (5–8), 53-229. DOI: 10.1016/S0167-5729(02)00100-0.
- Chen, X.; Mao, S. S. „Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications, and Applications.“ Chem. Rev., 2007, 107 (7), 2891–2959. DOI: 10.1021/cr0500535.
- Racovita, A. D. „Titanium Dioxide: Structure, Impact, and Toxicity.“ Int. J. Environ. Res. Public Health, 2022, 19 (9), 5681. DOI: 10.3390/ijerph19095681.
- Weir, A.; Westerhoff, P.; Fabricius, L.; Hristovski, K.; von Goetz, N. „Titanium Dioxide Nanoparticles in Food and Personal Care Products.“ Environ. Sci. Technol., 2012, 46 (4), 2242–2250. DOI: 10.1021/es204168d.
- Ghamarpoor, R.; Fallah, A.; Jamshidi, M. „Investigating the use of titanium dioxide (TiO2) nanoparticles on the amount of protection against UV irradiation.“ Sci Rep, 2023, 13, 9793. DOI: 10.1038/s41598-023-37057-5.
- Middlemas, S.; Fang, Z. Z.; Fan, P. „A new method for production of titanium dioxide pigment.“ Hydrometallurgy, 2013, 131–132, 107-113. DOI: 10.1016/j.hydromet.2012.11.002.
- Gázquez, M.; Bolívar, J.; Garcia-Tenorio, R.; Vaca, F. „A Review of the Production Cycle of Titanium Dioxide Pigment.“ Materials Sciences and Applications, 2014, 5, 441-458. DOI: 10.4236/msa.2014.57048.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. „Titanium Dioxide.“ In Some Organic Solvents, Resin Monomers and Related Compounds, Pigments and Occupational Exposures in Paint Manufacture and Painting; IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 47; International Agency for Research on Cancer: Lyon (FR), 1989. Available from: https://www.ncbi.nlm.nih.gov/books/NBK524874/.
- Goparaju, V. R. R.; Marshall, D. F.; Kazerooni, V. „Process for manufacturing titanium dioxide pigments using ultrasonication.“ U.S. Patent 9,353,266, 2016. Available from: https://patents.google.com/patent/US9353266B2/en.
- Davis, B. R.; Rahm, J. A. „Process for manufacturing titanium dioxide.“ U.S. Patent 4,288,418, 1981. Available from: https://patents.google.com/patent/US4288418A/en.
- Ayorinde, T.; Sayes, C. M. „An updated review of industrially relevant titanium dioxide and its environmental health effects.“ J. Hazard. Mater. Lett., 2023, 4, 100085. DOI: 10.1016/j.hazl.2023.100085.
