Sulfaminsäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
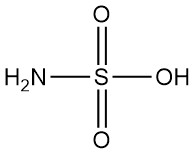
Was ist Sulfaminsäure?
Sulfaminsäure, auch bekannt als Amidoschwefelsäure, ist eine starke anorganische Säure mit der chemischen Formel H3NSO3. Sie ist ein weißer, geruchloser, kristalliner und nicht hygroskopischer Feststoff, der in Wasser stark dissoziiert ist.
Sulfaminsäure wird seit etwa einem halben Jahrhundert industriell hergestellt. Im Zeitraum von 1950 bis 1980 wurden in mehreren Industrieländern Produktionsanlagen errichtet, um einer erhöhten Marktnachfrage zu begegnen.
Der darauf folgende Rückgang der Produktnachfrage sowie Produktionsherausforderungen und Schwierigkeiten im Zusammenhang mit der Entsorgung von Nebenprodukten führten jedoch zur Schließung aller Produktionsstätten in Europa und den USA. Die Produktion wird in Japan (Nissan) und Taiwan (mehrere Hersteller) fortgesetzt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Sulfaminsäure
Sulfaminsäure ist bei Raumtemperatur ein weißer, kristalliner und nichtflüchtiger Feststoff. Sie bildet eine stark saure wässrige Lösung mit einem pH-Wert von 1,18 bei nur 1 %iger Lösung. Die Löslichkeit von Sulfaminsäure in Wasser wird durch Zugabe anderer Säuren oder Salze erhöht und zeigt eine begrenzte Löslichkeit in konzentrierten anorganischen Säuren und den meisten organischen Lösungsmitteln.
Die Wasserlöslichkeit ist temperaturabhängig, wie in Tabelle 1 aufgeführt.
| Temperatur (°C) | Löslichkeit (g/100 g) | Konzentration (Gew.-%) |
|---|---|---|
| 0 | 14,7 | 12,8 |
| 10 | 18,5 | 15,6 |
| 20 | 21,3 | 17,5 |
| 30 | 26,1 | 20,7 |
| 40 | 29,5 | 22,8 |
| 50 | 32,8 | 24,7 |
| 60 | 37,1 | 27,0 |
| 70 | 41,9 | 29,5 |
| 80 | 47,0 | 32,0 |
Wichtige physikalische Eigenschaften der Sulfaminsäure sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [5329-14-6] |
| Chemische Formel | H3NSO3 |
| Molekulargewicht | 97,1 g/mol |
| Schmelzpunkt | 205 °C |
| Dissoziationskonstante | 1,10 x 10-1 |
| Dichte bei 25 °C | 2,126 g/cm3 |
| Spezifische Wärmekapazität | 1,1467 J/g |
| Dampfdruck bei 20 °C | 0,8 Pa |
| Dampfdruck bei 100 °C | 0,25 Pa |
2. Chemische Reaktionen von Sulfaminsäure
Durch Erhitzen von Sulfaminsäure über 209 °C zersetzt sie sich in Schwefeltrioxid, Schwefeldioxid, Wasser, Ammoniak und Stickstoff.
Wässrige Sulfaminsäurelösungen hydrolysieren zu Ammoniumhydrogensulfat:
NH2SO3H + H2O → NH4HSO4
Die Hydrolyserate hängt von Konzentration, pH-Wert und Temperatur ab. Verdünnte wässrige Lösungen sind bei Raumtemperatur stabil. Eine 10%ige Sulfaminsäurelösung wird bei einer Temperatur von 80 °C 10 Stunden lang auf 50 % hydrolysiert.
Sulfaminsäure kann in Gegenwart von Chlor, Brom und Chloraten oxidiert werden, um Schwefelsäure zu erzeugen.
2 NH2SO3H + KClO3 → 2 H2SO4 + N2 + KCl + H2O
Durch Erhitzen von konzentrierter Salpetersäure mit Sulfaminsäure entsteht Distickstoffoxid.
NH2SO3H + HNO3 → H2SO4 + N2O + H2O
Salpetrige Säure reagiert vollständig mit Sulfaminsäure zu Stickstoff und Schwefelsäure, daher kann diese Reaktion für die quantitative Analyse verwendet werden.
NH2SO3H + HNO2 → H2SO4 + H2O + N2
Die Reaktion mit Thionylchlorid führt zur Bildung von Sulfamylchlorid:
NH2SO3H + SOCl2 → ClSO2NH2 + SO2 + HCl
Amidosulfonsäure löst Metallhydroxide, -oxide und -carbonate.
Primäre und sekundäre Alkohole reagieren mit Amidosulfonsäure zu Alkylammoniumsulfaten.
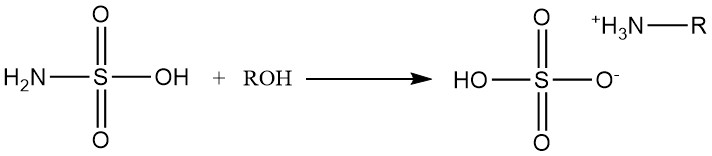
Sekundäre Alkoholreaktionen erfordern die Anwesenheit von Aminkatalysatoren, und tertiäre Alkohole reagieren nicht mit Sulfaminsäure.
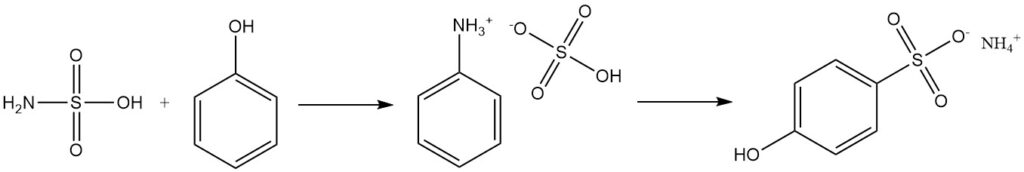
Aromatische Alkohole wie Phenol reagieren mit Sulfaminsäure zu Sulfonaten, wobei Phenylammoniumsulfat als Zwischenprodukt entsteht.
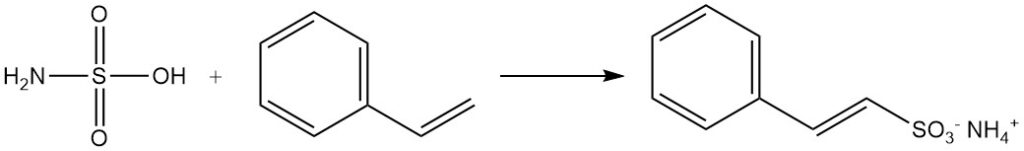
Aldehyde bilden Additionsprodukte mit Sulfaminsäuresalzen. Aromatische Verbindungen mit ungesättigten Seitenketten, wie Styrol, werden durch Sulfaminsäure sulfoniert, wobei die Doppelbindung der Seitenkette erhalten bleibt.
3. Herstellung von Sulfaminsäure
Bei der Herstellung von Sulfaminsäure wird ausschließlich das Harnstoffverfahren verwendet. Anlagen, die Ammoniak und Schwefeltrioxid verwenden, wurden eingestellt.
Sulfaminsäure wird direkt durch die Reaktion äquimolarer Mengen von Harnstoff, Schwefeltrioxid und Schwefelsäure hergestellt.
NH2CONH2 + SO3 + H2SO4 → 2 NH2SO3H + CO2
Diese Reaktion ist stark exotherm und umfasst einen zweistufigen Prozess gemäß den folgenden Reaktionen:
NH2CONH2 + SO3 → NH2CONHSO3H
NH2CONHSO3H + H2SO4 → 2 NH2SO3H + CO2
In der Anfangsphase wird Harnstoff mit überschüssiger Schwefelsäure und Schwefel gerührt. Trioxid. Die Temperatur wird unter 40 °C gehalten, um die Bildung von Kohlendioxid zu verhindern. In der zweiten Stufe wird das Produkt aus der ersten Stufe in Gegenwart von überschüssigem Schwefeltrioxid bei einer Temperatur von 50–80 °C umgesetzt, um Sulfaminsäure und Kohlendioxid zu erhalten.
Nach der Entfernung von überschüssigem Schwefeltrioxid wird Sulfaminsäure mit einer Reinheit von über 95 % erhalten und durch Umkristallisation wird ein hochreines Produkt erhalten.
Laut einem Nissan-Patent wird Sulfaminsäure durch die Reaktion von Harnstoff mit Oleum (xH2SO4 · ySO3) hergestellt.
Das Reaktionsprodukt wird nass umkristallisiert, gefolgt von der Trennung und Trocknung der kristallisierten Säure. Durch Hochdruckmahlen mit einem Druck von 600–1500 kg/m2 entsteht ein feinkristallines Produkt mit einem durchschnittlichen Partikeldurchmesser von ≤ 500 μm.
4. Verwendung von Sulfaminsäure
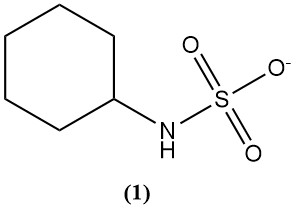
Sulfaminsäure wird hauptsächlich zur Synthese von Cyclamat (1) verwendet, einem künstlichen Süßstoff.
Sulfaminsäure wird aufgrund ihrer Fähigkeit, lösliche Salze zu bilden, und ihrer relativ geringen Korrosivität gegenüber Metallen auch in Reinigungsprodukten verwendet, um Karbonat- und Phosphatablagerungen wie Kesselstein zu entfernen.
Sie wird zum Reinigen von Maschinen und Instrumenten in Branchen wie der Papier-, Zucker-, Milch- und Brauereiindustrie sowie zum Entfernen von Ablagerungen in Verdampfungsanlagen, Wärmetauschern und Kühlsystemen verwendet.
In einigen Ländern wird Sulfaminsäure verwendet, um Fettalkohole oder ethoxylierte Alkohole in einem großtechnischen Verfahren zur Herstellung von Wachsvorläufern zu behandeln.
Sulfaminsäure wird auch als Chlorstabilisator, in der Farbstoffproduktion, in Galvanisierungsprozessen sowie in der Papier- und Textilindustrie verwendet.
In Laboren wird sie in der analytischen Chemie eingesetzt.
5. Toxikologie der Sulfaminsäure
Sulfaminsäure gilt allgemein als wenig toxisch. Ihre physiologischen Eigenschaften sind charakteristisch für eine starke Mineralsäure.
Sulfaminsäurestaub kann die Schleimhäute von Nase und Rachen sowie die Bindehaut der Augen reizen. Dies ist eine häufige Wirkung vieler starker Säuren.
Die orale Verabreichung von 1,6 g/kg Sulfaminsäure an Ratten hat sich als tödlich erwiesen. Dies weist auf ein gewisses Maß an Toxizität hin, aber es ist wichtig zu berücksichtigen, dass dies eine relativ hohe Dosis ist und dass die Studie an Ratten durchgeführt wurde. Die Toxizität beim Menschen kann abweichen.
Sulfaminsäure ist wie andere starke Säuren ätzend für Haut, Augen und Atemwege. Direkter Kontakt sollte vermieden werden.
Bei der Arbeit mit Sulfaminsäure sind ordnungsgemäße Handhabungsverfahren, einschließlich der Verwendung persönlicher Schutzausrüstung (PSA) wie Handschuhe, Schutzbrille und Atemschutz, unerlässlich.
Referenz
- Sulfamic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a25_439
