Dimethylamin
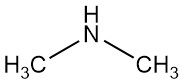
Dimethylamin ist eine organische Verbindung mit der Formel (CH3)2NH. Es ist ein farbloses, brennbares Gas mit einem ammoniakähnlichen Geruch, obwohl es in geringen Konzentrationen nach Fisch riechen kann und sein Geruch stärker ist als Methylamin und weniger als Trimethylamin. Dimethylamin kommt im Handel üblicherweise als Lösung in Wasser in Konzentrationen von bis zu etwa 40 % vor.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Dimethylamin
Dimethylamin ist ein schädliches, farbloses Gas oder eine komprimierte Flüssigkeit, die leicht entzündlich ist und einen sehr starken Fisch- oder Ammoniakgeruch hat. Es ist wasserlöslich und wird entweder als wässrige Lösung oder in reiner Form verkauft.
Beim Abkühlen wässriger Lösungen von Dimethylamin entsteht das kristalline Hydrat (CH3)2NH·7 H2O. Dimethylamin ist in verschiedenen organischen Lösungsmitteln löslich.
Wässrige Lösungen von Dimethylamin sind gute Lösungsmittel für viele anorganische und organische Verbindungen; Allerdings muss die potenzielle Reaktivität des gelösten Stoffes mit Dimethylamin berücksichtigt werden.
Tabelle 1 listet die physikalischen Eigenschaften von Dimethylamin auf.
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht, g/mol | 45,08 |
| Siedepunkt (101,33 kPa), °C | 6.8 |
| Schmelzpunkt, °C | -92,2 |
| Dichte bei 25 °C (flüssig), g/cm3 | 0,6556 |
| pKa (bei 25 °C) | 10,77 |
| Brechungsindex bei 17 °C | 1.350 |
| Oberflächenspannung (25 °C), 10-3 N/m | 16.33 |
| Verdampfungswärme bei 25 °C, kJ/mol | 23.663 |
| Schmelzwärme, kJ/mol | 5.945 |
| Standardbildungswärme, kJ/mol bei 25 °C (flüssig) | -43,96 |
| Standardbildungswärme, kJ/mol bei 25 °C (Gas) | -18,46 |
| Verbrennungswärme, Standardzustand bei 25 °C, Flüssigkeit, kJ/mol | -1744,63 |
| Wärmekapazität, ideales Gas (25 °C), J K-1 mol-1 | 70,7 |
| Kritische Temperatur, °C | 164,5 |
| Kritischer Druck, MPa | 5.31 |
| Dielektrizitätskonstante (25°C), Flüssigkeit | 5.26 |
| Dipolmoment in Benzol (25°C), D | 1,18 |
| Flammpunkt (geschlossener Tiegel), °C | -57 |
| Zündtemperatur in Luft, °C | 400 |
| Untere Explosionsgrenze in Luft, Vol. % | 2,8 |
| Obere Explosionsgrenze in Luft, Vol. % | 14.4 |
2. Chemische Reaktionen von Dimethylamin
Dimethylamin ist basisch und reagiert daher mit Wasser und Säuren unter Bildung von Dimethylammoniumverbindungen. Aufgrund der Anwesenheit elektronenspendender Methylgruppen besitzt Dimethylamin eine größere Basizität als Ammoniak.
Diese Methylgruppen stabilisieren die bei der Protonierung entstehende positive Ladung. Allerdings bleibt seine Basizität im Vergleich zu Hydroxid- und Alkoxidionen schwächer.
Dimethylamin verhält sich aufgrund des Vorhandenseins eines ungeteilten Elektronenpaars am Stickstoffatom wie ein Nukleophil. Dimethylamin reagiert leicht mit einer Vielzahl von Substraten, einschließlich Carbonsäuren, Acylhalogeniden, Anhydriden, Estern, Lactonen, Isocyanaten, α,β-ungesättigten Nitrilen und Estern, Epoxiden, Alkylhalogeniden, Kohlendioxid und Schwefelkohlenstoff.
Die Reaktion von Dimethylamin mit einer organischen Säure oder dem Ester einer organischen Säure führt zur Bildung eines Dimethyl-substituierten Amids.
Dimethylamin und Phosgen reagieren zu Tetramethylharnstoff. Die Reaktion mit Harnstoff führt zum erwarteten N,N-Dimethylharnstoff.
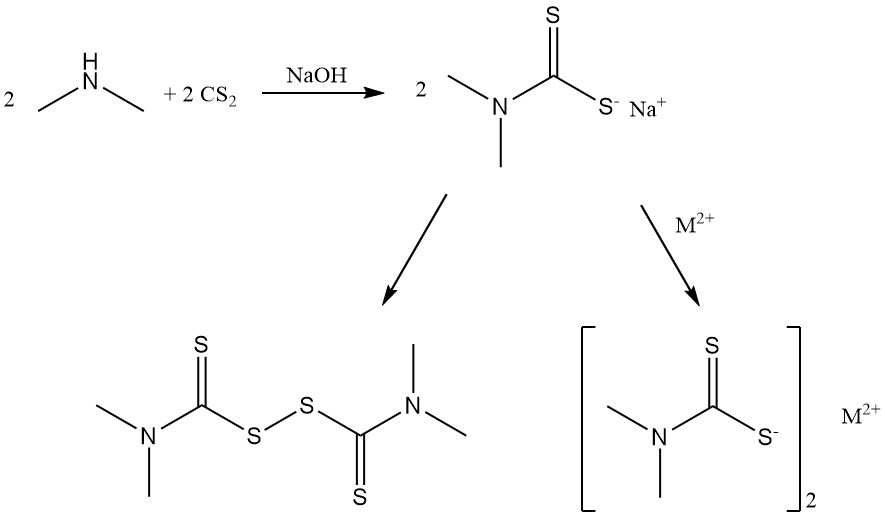
Durch die Reaktion von Dimethylamin mit Schwefelkohlenstoff entstehen Dimethyldithiocarbamatsalze und Bis(dimethyldithiocarbamoyl)disulfid, die als Gummibeschleuniger verwendet werden.
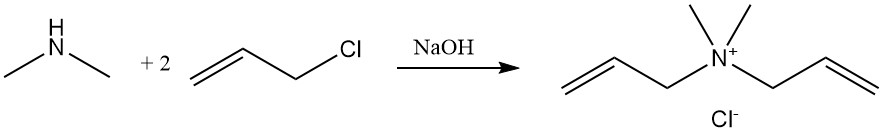
Bei der Reaktion von Dimethylamin mit Allylchlorid entsteht Diallyldimethylammoniumchlorid, ein Monomer, das polymerisiert und als Flockungsmittel in Wasseraufbereitungsanwendungen verwendet wird.
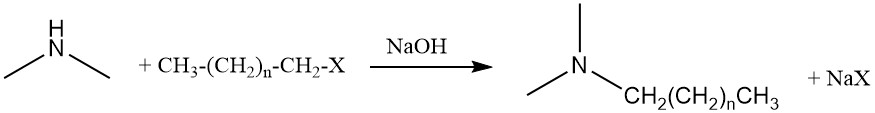
Dimethylamin kann auch eine weitere Aminierungsreaktion mit Fettalkoholen oder Fetthalogeniden eingehen, um Alkyldimethylamine zu erzeugen, die Vorläufer von Aminoxid-Tensiden sind.
Sowohl salpetrige Säure als auch Nitrosylchlorid wandeln Dimethylamin in das entsprechende Nitrosamin um.
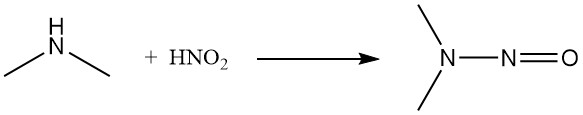
Ethylenoxid reagiert mit Dimethylamin zu Dimethylethanolamin.

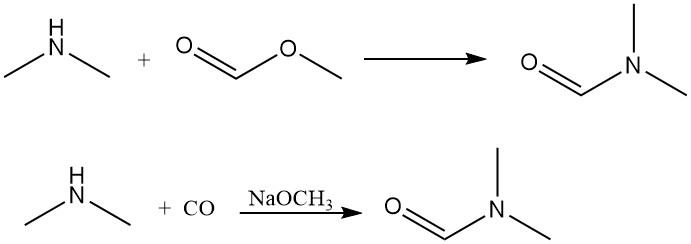
Dimethylamin reagiert mit Methylformiat unter Bildung von Dimethylformamid, einem dipolaren aprotischen Lösungsmittel. Diese Reaktion kann auch effizient durch direkte Kohlenmonoxidzugabe mit einer Base als Katalysator erreicht werden.
Dimethylamin reagiert mit Kohlendioxid unter wasserfreien Bedingungen zu Dimethylamincarbamaten und in Gegenwart von Wasser zu Dimethylamincarbonaten.
Dimethylamin wirkt korrosiv gegenüber Aluminium, Kupfer, Kupferlegierungen, verzinktem Metall, Magnesium, Zink und Zinklegierungen. Wasserfreies Dimethylamin und seine wässrigen Lösungen können mit Materialien aus Stahl gehandhabt werden.
3. Herstellung von Dimethylamin
Kommerziell wird Dimethylamin durch Aminierung von Methanol mit Ammoniak hergestellt. Dieser Prozess findet in der Dampfphase (300–500 °C und 790–3550 kPa) über Festbettreaktoren statt und ergibt eine Mischung aus Mono-, Di- und Trimethylamin.

Methode 1: Säurekatalysierte Methanolaminierung (Leonard-Prozess)
Diese traditionelle Methode verwendet einen festen Säurekatalysator, typischerweise amorphes Siliciumdioxid-Aluminiumoxid, um die Hochtemperaturumwandlung von Methanol zu fördern. Die Reaktion erreicht ein Gleichgewicht und begünstigt die Bildung von Trimethylamin bei niedrigeren Ammoniak-zu-Methanol-Verhältnissen. Die Marktanforderungen priorisieren jedoch Dimethylamin, gefolgt von Methylamin und Trimethylamin.
Methode 2: Formselektive säurekatalysierte Methanolaminierung
Diese Methode begegnet den Selektivitätsherausforderungen von Methode 1 durch den Einsatz formselektiver Zeolithkatalysatoren (z. B. modifizierte Mordenite, RHO und Chabazit). Diese Katalysatoren begrenzen die Bildung sperriger Trimethylaminmoleküle in ihren Poren, was zu einer mit Dimethylamin angereicherten Produktmischung führt.
Methanolaminierung umfasst aufeinanderfolgende Substitutionsreaktionen, bei denen Methanol in primäre, sekundäre und tertiäre Amine umgewandelt wird. Darüber hinaus kommt es zu Disproportionierungsreaktionen, die ein Gleichgewicht zwischen den verschiedenen Methylaminprodukten herstellen.
Methode 1 arbeitet typischerweise mit einer hohen Methanolumwandlung und beruht auf schnellen Disproportionierungsreaktionen. Dies führt zu einer Gleichgewichtsmischung, die durch das Verhältnis von Ammoniak zu Methanol bestimmt wird. Um die gewünschte Produktverteilung zu erreichen, werden überschüssiges, nicht umgesetztes Methylamin und Trimethylamin häufig recycelt, was energieintensiv ist.
Das Aufkommen formselektiver Zeolithkatalysatoren bot eine Lösung zur Optimierung der Produktselektivität. Aufgrund ihrer begrenzten Porengröße schränken diese Katalysatoren die Bildung und Diffusion von Trimethylaminmolekülen ein und begünstigen so die Produktion von Dimethylamin.
Beispiele für kommerzielle Prozesse sind die folgenden:
- Mitsubishi Rayon-Prozess: Dieser Zwei-Reaktor-Aufbau verwendet einen nicht-selektiven Katalysator für die anfängliche Trimethylamin-Disproportionierung, gefolgt von einem formselektiven Zeolith Katalysatorbett zur weiteren Produktanpassung.
- Chemischer Prozess von Mitsui: Dieser Prozess recycelt Trimethylamin kontinuierlich als azeotrope Mischung mit Ammoniak und fördert so dessen Disproportionierung und anschließende Umwandlung in das gewünschte Dimethylamin ein formselektiver silylierter Mordenit-Katalysator.
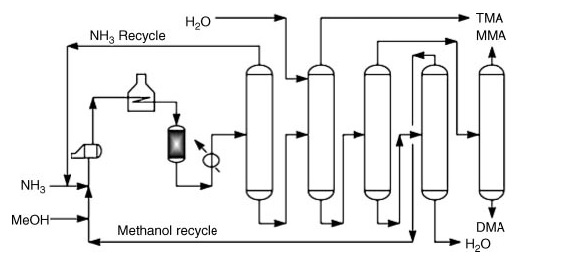
*MMA: Methylamin; DMA: Dimethylamin und TMA: Trimethylamin
Im Anschluss an die Reaktionsstufen umfasst die reine Produktrückgewinnung eine Reihe von Destillationsschritten:
- Ammoniakabtrennung und -recycling.
- Trimethylamin-Rückgewinnung mit Wasser für erhöhte Flüchtigkeit.
- Abtrennung von Methylamin und Dimethylamin aus Wasser und nicht umgesetztem Methanol.
- Individuelle Rückgewinnung von gereinigtem Methylamin und Dimethylamin.
- Trennung von nicht umgesetztem Methanol von Wasser.
4. Verwendung von Dimethylamin
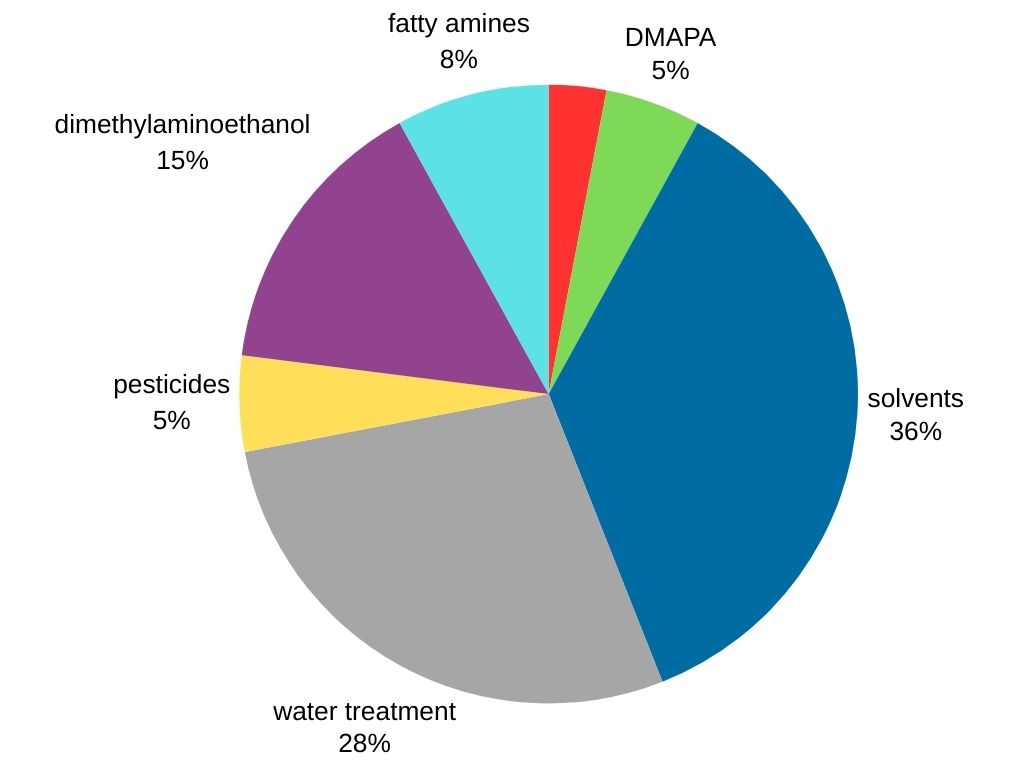
Dimethylamin ist das am meisten nachgefragte Methylamin auf dem Weltmarkt. Es wird in verschiedenen Branchen eingesetzt, darunter:
- Lösungsmittelproduktion: Dimethylamin dient als entscheidender Vorläufer für die Synthese beliebter Lösungsmittel wie Dimethylformamid (DMF) und Dimethylacetamid (DMAC).
- Wasseraufbereitung
- Tenside: Dimethylamin wird bei der Herstellung von 3-Dimethylaminopropylamin (DMAPA) verwendet, einem Tensid-Zwischenprodukt.
- Gummiverarbeitung: Dimethylamin reagiert mit Schwefelkohlenstoff zu Dimethyldithiocarbamat, einem entscheidenden Bestandteil bei der Gummivulkanisierung, der die Gummieigenschaften stärkt und verbessert.
- Agrochemikalien (Pestizide)
- Andere chemische Produkte (Dimethylaminoethanol und Fettamine).
5. Toxikologie von Dimethylamin
Dimethylamin ist eine brennbare Flüssigkeit oder ein brennbares Gas, das eine erhebliche Brandgefahr darstellt.
Akute Expositionseffekte
- Haut- und Augenreizende und ätzende Stoffe: Kontakt kann schwere Verbrennungen und Reizungen verursachen.
- Einatmen reizend: Das Atmen reizt Nase, Rachen und Lunge. Hohe Konzentrationen können zu Flüssigkeitsansammlungen in der Lunge (Lungenödem) führen, einem medizinischen Notfall.
Chronische Expositionseffekte
- Kann bei wiederholter Exposition die Leber schädigen.
- Potenzielle Gefahr für die Fortpflanzung (Auswirkungen auf männliche Hoden).
- Kann die Lunge reizen und zu Bronchitis mit Husten, Schleim und Atemnot führen.
Dimethylamin wird nach aktuellem Kenntnisstand nicht als krebserregend eingestuft.
Grenzwerte für die Exposition am Arbeitsplatz
- OSHA PEL (zulässiger Expositionsgrenzwert): 10 ppm gemittelt über einen 8-Stunden-Arbeitstag.
- NIOSH REL (empfohlener Expositionsgrenzwert): 10 ppm gemittelt über einen 10-Stunden-Arbeitstag.
- ACGIH TLV (Grenzwert): 5 ppm gemittelt über einen 8-Stunden-Arbeitstag, 15 ppm kurzfristiger Expositionsgrenzwert (STEL).
Vorsichtsmaßnahmen
- Technische Kontrollen: Priorität einschließender Vorgänge und Verwendung lokaler Absaugung, um die Luftbelastung zu minimieren.
- Arbeitspraktiken: Behalten Sie gute Hygienepraktiken bei, vermeiden Sie Haut- und Augenkontakt und essen, trinken oder rauchen Sie nicht in kontaminierten Bereichen.
- Persönliche Schutzausrüstung: Wenn die technischen Kontrollen nicht ausreichen, tragen Sie geeignete chemikalienbeständige Handschuhe, Kleidung, Schutzbrillen oder Schutzbrillen und anschließend Atemschutzgeräte etablierte Protokolle.
Speicherung und Handhabung
- In dicht verschlossenen Behältern an einem kühlen, gut belüfteten Ort fern von Wärmequellen und unverträglichen Chemikalien (z. B. Oxidationsmitteln, starken Säuren und Quecksilber) lagern.
- Metallbehälter während des Transfervorgangs erden und verkleben.
- Verwenden Sie nicht funkenbildende Werkzeuge und Geräte, insbesondere beim Umgang mit Behältern.
Referenzen
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/0737.pdf
