Cyanurchlorid: Eigenschaften, Reaktionen, Herstellung und Verwendung
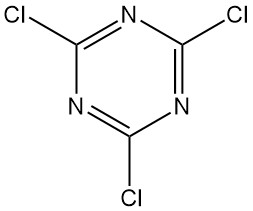
Was ist Cyanurchlorid?
Cyanurchlorid, auch bekannt als 2,4,6-Trichlor-1,3,5-triazin, ist eine organische Verbindung mit der Formel C3N3Cl3. Es erscheint als farbloser, kristalliner Feststoff mit stechendem Geruch. Es ist das chlorierte Derivat von 1,3,5-Triazin und das Trimer von Cyanogenchlorid.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Cyanurchlorid
Cyanurchlorid bildet farblose monokline Kristalle mit stechendem Geruch, der an Acetamid und Säurechloride erinnert. Es ist in den meisten organischen Lösungsmitteln löslich, jedoch unlöslich in Wasser.
Tabelle 1 zeigt die Löslichkeit (in Gew.-%) von Cyanurchlorid in verschiedenen Lösungsmitteln bei 25 °C.
| Lösungsmittel | Löslichkeit (Gew.-%) |
|---|---|
| Aceton | 25,0 |
| Acetonitril | 21,0 |
| Acrylnitril | 19,0 |
| Benzol | 19,0 |
| Chlorbenzol | 16,0 |
| Tetrachlormethan | 7,5 |
| Diethylether | 14,0 |
| Dioxan | 55,0 |
| Ethylacetat | 21,0 |
| Methylvinylketon | 27,0 |
| Nitrobenzol | 18,0 |
| Tetrahydrofuran | 43,0 |
| Trichlormethan | 20,0 |
| Toluol | 18,5 |
Cyanurchlorid sublimiert, bevor es den Siedepunkt erreicht. Der Dampfdruck des flüssigen Cyanurchlorids als Funktion der Temperatur ergibt sich aus der folgenden Gleichung:
ln p (mmHg) = -0,33480-742,7311/T(K)+11,15147 ln T(K)
Wichtige physikalische Eigenschaften von Cyanurchlorid sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [108-77-0] |
| Formel | C3N3Cl3 |
| Molekulargewicht | 184,5 g/mol |
| Tripelpunkt | 145,7 °C bei 255 kPa |
| Siedepunkt Punkt | 194 °C |
| Dichte (fest) | 1,92 g/cm3 |
| Dichte (Schmelze) | 1,48 g/cm3 |
| Wärmekapazität | 0,99 kJ kg-1 K-1 bei 150 °C |
| Schmelzwärme | 123 kJ/kg |
| Verdampfung | 256 kJ/kg |
2. Reaktionen von Cyanurchlorid
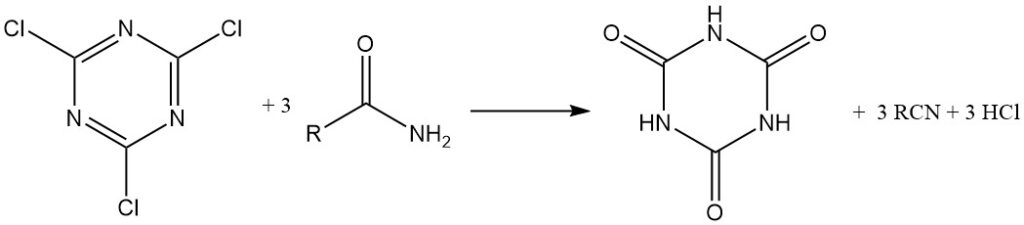
Unter wasserfreien Bedingungen wirkt Cyanurchlorid als Chlorierungsmittel. Alkohole und tertiäre Amine werden in Alkylchloride umgewandelt, während Carbonsäuren in wasserfreiem Aceton mit Triethylamin Säurechloride bilden, die isoliert oder in situ zur Herstellung von Estern und Amiden verwendet werden. Cyanursäure ist in beiden Fällen ein Nebenprodukt.
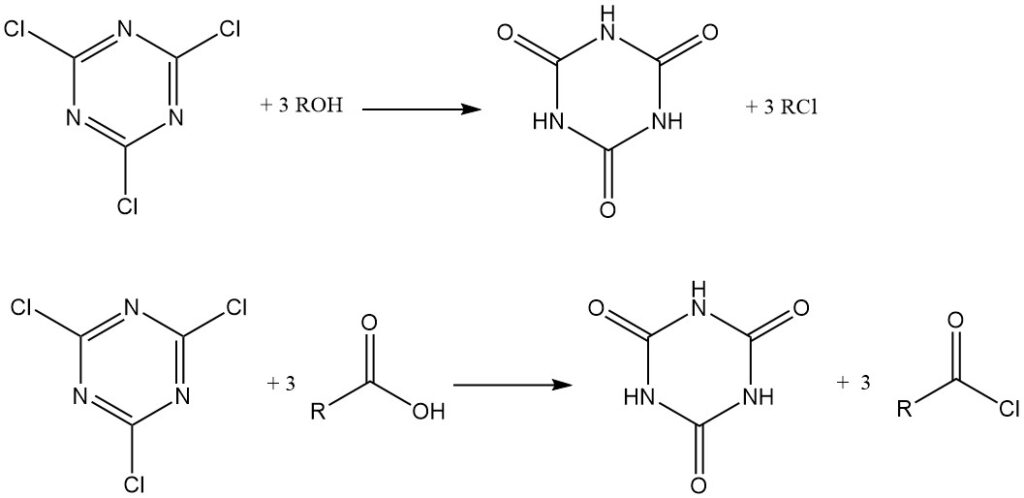
Es kann auch als Kondensationsreagenz (Dehydratisierungsreagenz) verwendet werden. Amide, Thioamide und Aldoxime können in Nitrile umgewandelt werden.
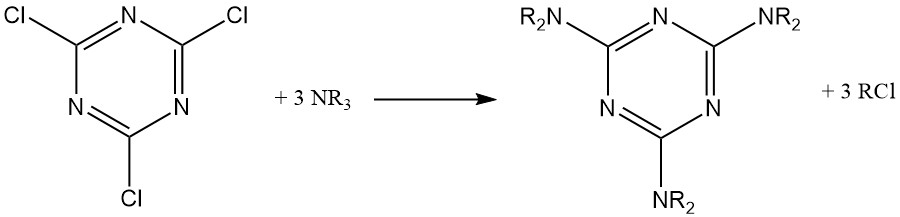
Unter wasserfreien Bedingungen reagieren tertiäre aliphatische Amine mit Cyanurchlorid zu substituierten Melaminderivaten, wobei eine Alkylgruppe in das entsprechende Alkylchlorid umgewandelt wird.
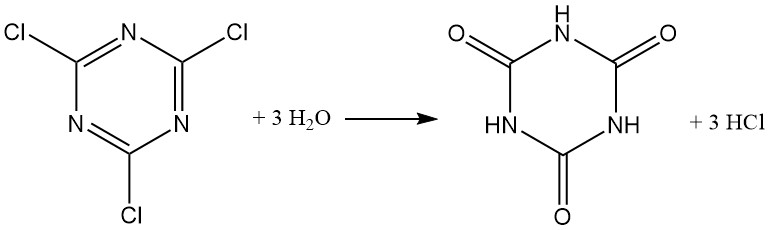
Cyanurchlorid reagiert typischerweise wie Säurechlorid und bildet Chlorwasserstoff. Während eine Suspension in Eiswasser eine gewisse Stabilität aufweist (bis zu 12 Stunden bei 0 °C), wird die Hydrolyse bei steigender Temperatur beschleunigt, wobei über 40 % innerhalb von 1 Stunde bei 30 °C hydrolysiert werden. Cyanursäure ist das endgültige Hydrolyseprodukt.
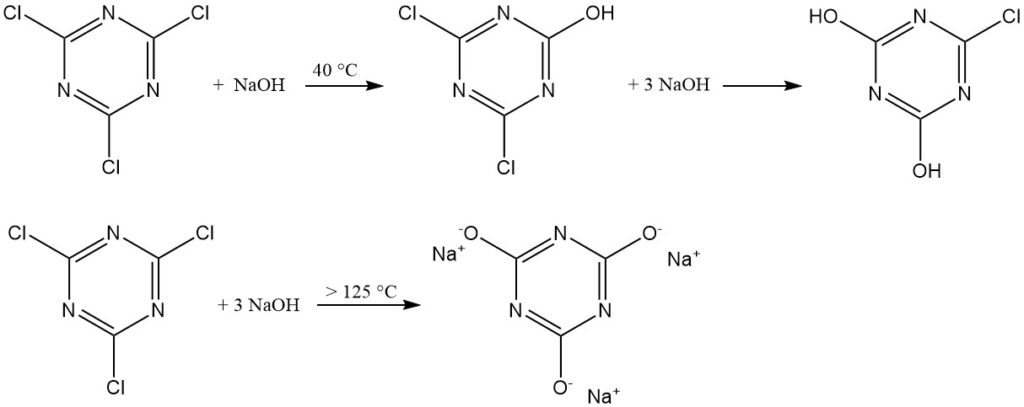
Alkalische wässrige Medien (NaOH oder NaHCO3 bei 40 °C) fördern die Bildung von 2,4-Dichlor-6-hydroxy-1,3,5-triazin. Überschüssige Base ergibt 2,4-Dihydroxy-6-chlor-1,3,5-triazin. Die Bildung von Trinatriumcyanurat erfolgt erst über 125 °C.
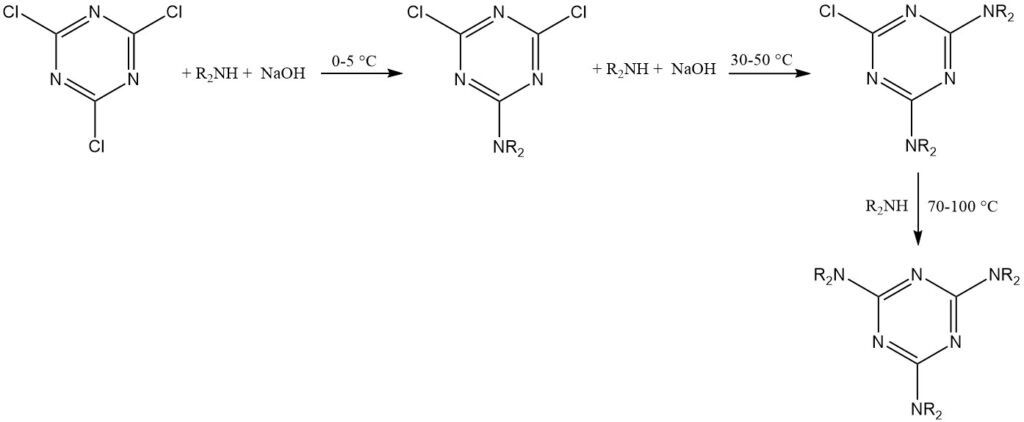
Die vorübergehende Stabilität von Cyanurchlorid in Wasser ermöglicht Reaktionen mit starken Nukleophilen (wie Alkoholen, Thiolen und primären und sekundären Aminen) in Eiswassersuspensionen. Diese Reaktionen verlaufen oft schrittweise, um eine Trisubstitution bei kontrollierten Temperaturen zu erreichen.
Eine empirische Regel schlägt vor, das erste Chlor bei 0–5 °C, das zweite bei 30–50 °C und das dritte bei 70–100 °C für Aminsubstituenten zu ersetzen. Zu den HCl-Fängern gehören Natriumhydroxid, Natriumhydrogencarbonat, Dinatriumhydrogenphosphat und tertiäre Amine.
Das Triazinprodukt wird typischerweise durch Filtration oder Zentrifugation isoliert. Aceton, Methylethylketon oder Toluol sind übliche Lösungsmittel für diese Reaktionen.
Cyanurchlorid (Schmelze oder Pulver) wird mit dem Nukleophil im Lösungsmittel gelöst/suspendiert und dann mit wässriger NaOH behandelt. Das Produkt wird durch Verdampfen oder Filtration von der organischen Schicht isoliert.
Diese Methode ermöglicht die sequenzielle Einführung verschiedener Substituenten bei unterschiedlichen Temperaturen. Zum Ersetzen des dritten Chloratoms können hochsiedende Lösungsmittel oder der geschmolzene Reaktant erforderlich sein.
Die Neutralisierung der freigesetzten Salzsäure und die Wärmeableitung während der Reaktionen sind entscheidend. Die exotherme Hydrolyse von Cyanurchlorid (ΔH = -2164 kJ/kg) kann unkontrollierbar werden, insbesondere bei der Cyanuratherstellung aus Alkoholen.
Mit Wasser mischbare Lösungsmittel beschleunigen die Hydrolyse. Die Lagerung von Cyanurchloridlösungen in wässrigem Aceton ohne ordnungsgemäße Wärmeabfuhr kann selbst bei Raumtemperatur zu unkontrollierten Reaktionen führen.
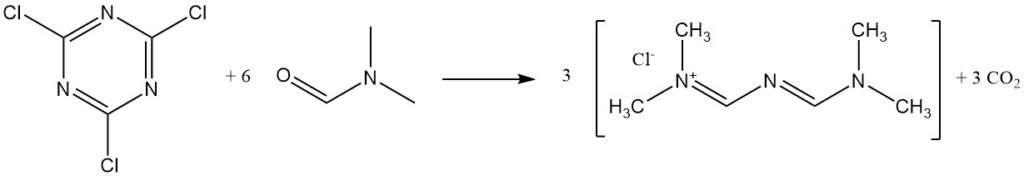
Cyanurchlorid reagiert mit DMF zu Goldsalz.
3. Produktion von Cyanurchlorid
Cyanurchlorid-Produktionsanlagen befinden sich typischerweise in der Nähe von Blausäureanlagen (HCN), dem primären Rohstoff. Natriumcyanid kann ebenfalls verwendet werden, jedoch in geringerem Umfang.
Der Produktionsprozess von Cyanurchlorid umfasst zwei Hauptschritte: Chlorierung von HCN zu Chlorcyan (ClCN) und Trimerisierung von ClCN zu Cyanurchlorid.
Zunächst reagiert HCN mit Chlor (Cl2) in einem Kreislaufreaktor bei moderaten Temperaturen zwischen 20 und 40 °C zu ClCN. Diese Reaktion ist exotherm (ΔH = -89 kJ/mol).
Anschließend wird das ClCN abgetrennt, gereinigt und dann auf Aktivkohle bei Temperaturen über 300 °C trimerisiert (drei Moleküle zu einem kombiniert). Auch dieser Schritt ist exotherm (ΔH = -233 kJ/mol).
Abbildung 1 veranschaulicht einen detaillierten Prozess zur Herstellung von Cyanurchlorid aus Chlor und Blausäure.
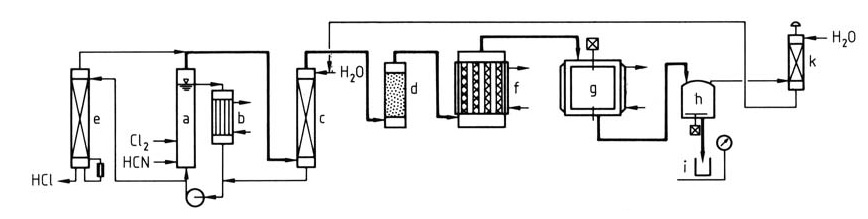
a) ClCN-Reaktor; b) Wärmetauscher; c) Wäscher; d) Trockner; e) Abwasserstripper; f) Trimerisierer; g) Kondensator; h) Speicher; i) Trommel; k) Abgaswäscher
Eine Mischung aus HCN und Cl2 wird in den Kreislaufreaktor eingespeist (a & b). Die gesättigte wässrige ClCN-Lösung verlässt den Kreislauf, dann wird das ClCN mit Wasser gewaschen (c), um Verunreinigungen zu entfernen, und getrocknet (d).
Das HCl-haltige Waschwasser wird zu einem Stripper (e) geleitet, um das gelöste ClCN zurückzugewinnen und konzentriertes HCl zur weiteren Verwendung freizusetzen. Alternativ können die Abschnitte (e), (a) und (c) zu einer einzigen Einheit kombiniert werden. Das gereinigte, trockene ClCN wird auf Aktivkohle trimerisiert (f), um Cyanurchloriddämpfe zu bilden.
Die Dämpfe werden zu geschmolzenem oder festem Cyanurchlorid kondensiert (g). Das Produkt kann in einem Lösungsmittel zur Eigenverwendung gelöst oder in Behälter verpackt werden (h & i). Abgase werden gewaschen und recycelt (k), um Abfall zu minimieren.
Mit diesem Verfahren werden typischerweise ClCN-Ausbeuten von über 95 % und Cyanurchlorid-Ausbeuten von über 90 % erzielt.
Mehrere Varianten zielen darauf ab, die Bildung von verdünntem HCl während der ClCN-Produktion zu vermeiden. Dazu gehören einstufige Gasphasenreaktionen unter Verwendung von Kohle, Tetrachlorethan oder Cyanogen und Chlor auf Kohle.
Andere Katalysatoren für die ClCN-Trimerisierung, wie geschmolzenes Cyanurchlorid, Metallchloride, eutektische Mischungen und Zeolithe, wurden untersucht.
In Laboren können ClCN-Lösungen in organischen Lösungsmitteln wie Benzol und Chloroform mit HCl trimerisiert werden. Kommerzielle Prozesse könnten das Chlorwasserstoff-Dimethylether-Azeotrop zur Trimerisierung verwenden.
Die Ausrüstung für die ClCN-Produktion verwendet korrosionsbeständige Materialien wie Glas, Fluorpolymere, Graphit oder spezielle Harze. In Produktionsanlagen für Cyanurchlorid werden üblicherweise Nickel, rostfreier Stahl oder Aluminium verwendet.
Feuchtigkeit ist bei diesem Verfahren ein erhebliches Problem und kann zu schwerer Korrosion führen. Um dieses Risiko zu verringern, sind geeignete Geräte, Materialien und Handhabungsverfahren wichtig.
4. Verwendung von Cyanurchlorid
Cyanurchlorid wird als Vorläufer für Pestizide und Herbizide, bei der Herstellung von Farbstoffen, Aufhellern und UV-Lichtstabilisatoren in Kunststoffen sowie bei der organischen Synthese verwendet.
Die wichtigsten Derivate von Cyanurchlorid sind Aminotriazine, insbesondere Alkylaminotriazine, die als Pestizide und Herbizide verwendet werden. Herbizide auf Triazinbasis gehören nach wie vor zu den kommerziell erfolgreichsten, wobei die meisten Formulierungen 2-Chlor- oder 2-Methylthio-4,6-dialkylamino-1,3,5-triazine enthalten.
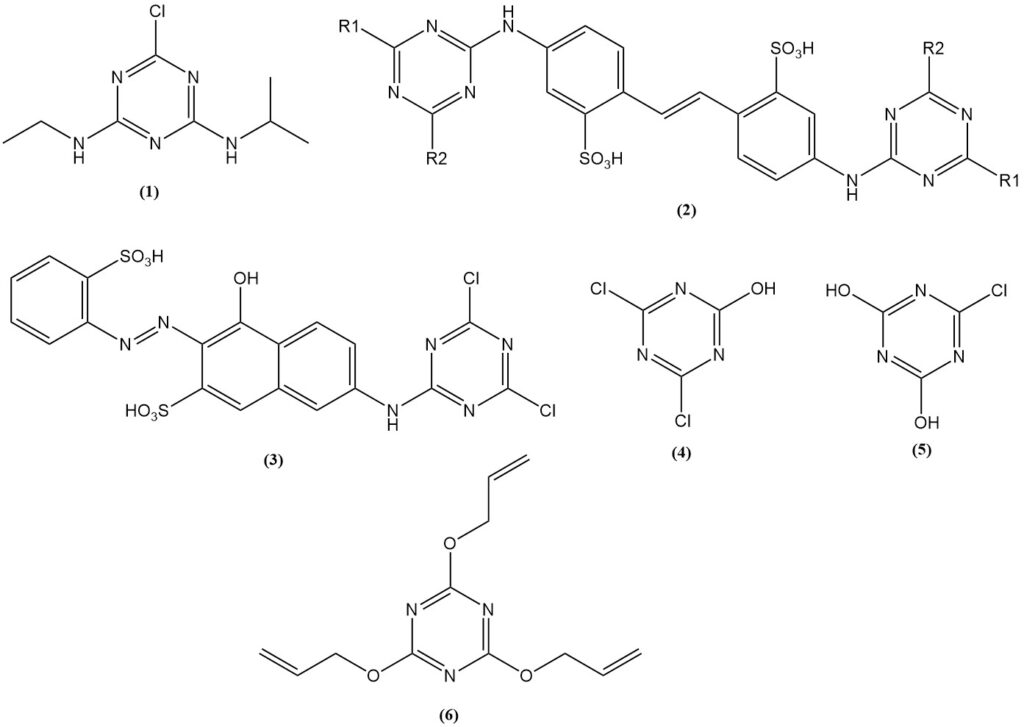
Atrazin (1) ist das wichtigste Triazinherbizid und macht über 70 % des Cyanurchloridverbrauchs aus, der für die Herbizidproduktion verwendet wird. Triazinherbizide werden weltweit hergestellt.
Weniger als 30 % der Cyanurchloridproduktion wird in anderen industriellen Anwendungen verwendet, beispielsweise als optische Aufheller, UV-Stabilisatoren, Reaktivfarbstoffe und Vernetzungsmittel.
Reaktionsprodukte von Aminostilbenen mit substituierten Triazinen, insbesondere Bis(triazinylamino)stilbendisulfonsäuren (2), werden als Aufheller für Stoffe und Papier verwendet.
Aus Cyanurchlorid hergestellte Farbstoffderivate können chemisch mit Stoffen reagieren. Die Procion-Farbstoffe (3) gehörten zu den ersten.
Cyanurchlorid und Cyanurate werden bei der Herstellung von Gelatine und Klebstoffen verwendet. Beispiele hierfür sind Natriumsalze von 2,4-Dichlor-6-hydroxy-1,3,5-triazin (4) und 2,4-Dihydroxy-6-chlor-1,3,5-triazin (5). Auch Triallylcyanurat (6) wird in der Gummi- und Kunststoffindustrie verwendet.
Triazine haben verschiedene andere Verwendungszwecke, darunter als Modifikatoren, Beschleuniger, Flammschutzmittel, Arzneimittel, Antioxidantien, Ozonschutzmittel und Schwermetallfänger.
5. Toxikologie von Cyanurchlorid
Cyanurchlorid ist ein starker Reizstoff für Haut, Schleimhäute (einschließlich Augen), Atemwege und Magen-Darm-Trakt. Seine 1-Minuten-Reizschwelle für Schleimhäute ist mit 0,3 mg/m³ außergewöhnlich niedrig. Es können auch allergische Reaktionen auftreten.
Direkter Kontakt mit Cyanurchlorid muss strikt vermieden werden. Sorgen Sie für ausreichende Belüftung in Arbeitsumgebungen.
Tragen Sie beim Umgang mit Cyanurchloriddampf oder -staub eine Vollmaske mit Aktivkohlebehälter oder verwenden Sie ein umluftunabhängiges Atemschutzgerät.
Cyanurchlorid ist mit dem Gefahrensymbol Xi gekennzeichnet und den Risikosätzen (R-Sätzen) R 36/37/38 zugeordnet, die auf Reizungen der Augen, Atemwege und Haut hinweisen. Darüber hinaus betonen die Sicherheitssätze (S) 28 die Notwendigkeit, geeignete Schutzkleidung zu tragen.
Zur umfassenden Sicherheitskennzeichnung sollten auch die folgenden R- und S-Sätze verwendet werden:
- R 22: Gesundheitsschädlich beim Verschlucken
- R 26: Sehr giftig beim Einatmen
- R 41/43: Sensibilisierung durch Einatmen und Hautkontakt möglich
- S 36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen
- S 45: Bei Unfall oder Unwohlsein sofort ärztlichen Rat einholen
Wenn Sie Cyanurchloridpulver brennbaren Lösungsmitteln hinzufügen, verwenden Sie geerdete Trichter, um elektrostatische Entladungen zu vermeiden. Nur qualifiziertes Personal, das in der richtigen Handhabung geschult ist, sollte zum Arbeiten mit Cyanurchlorid ermächtigt werden.
Referenz
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191
