Chlormethan: Eigenschaften, Produktion und Verwendung
Chlormethan, auch Methylchlorid genannt, ist das einfachste chlorierte Derivat von Methan mit der chemischen Formel CH3Cl. Es handelt sich um ein farbloses Gas mit einem schwachen, süßlichen Geruch, das natürlicherweise in Spuren vorkommt, aber hauptsächlich industriell hergestellt wird.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Chlormethan
Chlormethan ist ein farbloses und brennbares Gas ohne Geruch. Seine Löslichkeit in Wasser ist temperaturabhängig und es bildet mit Wasser ein Azeotrop. Die folgende Tabelle 1 stellt seine Löslichkeit bei 0,1 MPa (1 bar) dar:
| T (°C) | Löslichkeit (g CH3Cl/kg H2O) |
|---|---|
| 15 | 9.0 |
| 30 | 6,52 |
| 45 | 4,36 |
| 60 | 2,64 |
Die wichtigen physikalischen Eigenschaften von Chlormethan sind in der folgenden Tabelle 2 aufgeführt:
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht (MW) | 50,49 g/mol |
| Siedepunkt bei 1 bar | -24,0 °C |
| Schmelzpunkt | -97,7 °C |
| Dampfdruck bei 20°C | 4900 mbar |
| Verdampfungsenthalpie | 21,67 kJ/mol |
| Schmelzenthalpie am Schmelzpunkt | 6,4 kJ/mol |
| Dichte der Flüssigkeit (25°C) | 911 kg/m3 |
| Dampfdichte am Siedepunkt | 2,558 kg/m3 |
| Kubischer Ausdehnungskoeffizient einer Flüssigkeit (0–40 °C) | 0,00209 K-1 |
| Enthalpie der Dampfbildung (25°C, 1 bar) | -80,83 kJ/mol |
| Gibbs freie Energie der Dampfbildung (25°C, 1 bar) | -57,37 kJ/mol |
| Spezifische Wärmekapazität von Dampf (25°C, 1 bar) | 0,807 kJ kg-1 K-1 |
| Kritische Temperatur (Tc) | 143 °C |
| Kritischer Druck | 65,9 atm |
| Kritisches Volumen | 0,13645 ml/mol |
| Wärmeleitfähigkeit von Dampf | 0,00841 W K-1 m-1 |
| Wärmeleitfähigkeit der Flüssigkeit (20°C) | 0,161 W K-1 m-1 |
| Oberflächenspannung bei 20°C | 16,2 mN/m |
| Viskosität der Flüssigkeit bei 20°C | 0,244 cP |
| Dipolmoment | 1,86 D |
| Brechungsindex der Flüssigkeit (25°C) | 1.3712 |
| Dielektrizitätskonstante von Dampf bei 20°C | 1.01 |
| Dielektrizitätskonstante einer Flüssigkeit bei 20°C | 12.9 |
| Zündtemperatur | 618 °C |
| Untere Entflammbarkeitsgrenze in der Luft | 7,1 Vol.-% |
| Obere Entflammbarkeitsgrenze in der Luft | 18,5 Vol.-% |
| Verteilungskoeffizient Luft/Wasser (20°C) | 0,3 |
| Verteilungskoeffizient n-Octanol/Wasser (20°C) (log Pow) | 0,91 |
2. Chemische Eigenschaften von Chlormethan
Chlormethan ist eine einzigartige aliphatische Chlorverbindung, die thermisch stabil ist. Im Gegensatz zu vielen verwandten Verbindungen widersteht es der Zersetzung bis über 400 °C, selbst in Gegenwart der meisten Metalle.
Seine Selbstentzündungstemperatur an der Luft beträgt hohe 632 °C, gemessen in einem Stahlapparat. Während bei der Verbrennung hauptsächlich CO2 und HCl entstehen, können sich auch Spuren von COCl2 und CO bilden. Bei der Photooxidation entstehen hauptsächlich Kohlendioxid und Phosgen.
Hydrolyse von Chlormethan erzeugt Methanol und Chlorwasserstoff; unter neutralen oder sauren Bedingungen bei Raumtemperatur ist sie jedoch vernachlässigbar. Eine starke Alkalipräsenz beschleunigt den Prozess und verkürzt die Halbwertszeit von Chlormethan von Jahrzehnten auf nur noch Monate.
Chlormethan nimmt leicht an metallorganischen Reaktionen mit Elementen wie Lithium, Magnesium, Zink und Aluminium teil und bildet Verbindungen wie CH3MgCl und Al( CH3)3⋅AlCl3. Diese Verbindungen finden wertvolle Anwendungen in der präparativen organischen Chemie und der Katalyse der Polymerproduktion.
Es hat die Fähigkeit, bei zahlreichen chemischen Reaktionen als Methylierungsmittel zu wirken. Es dient als Reagenz in der Friedel-Crafts-Reaktion mit Benzol für die Toluolsynthese und methyliert leicht Hydroxylgruppen, um Ether zu bilden, einschließlich Methylcellulose aus Cellulose und verschiedenen Phenol Methylether.
Monochlormethan findet auch industrielle Verwendung bei der Herstellung quartärer Methylammoniumverbindungen durch Reaktion mit tertiären Aminen und verschiedenen Methylaminen mit Ammoniak.
Das Grignard-Reagenz Methylmagnesiumchlorid wird direkt aus Chlormethan und Magnesium synthetisiert, während die Wurtz-Reaktion mit Natrium Ethan ergibt.
Eine besonders bedeutende Reaktion betrifft Chlormethan und Silizium und erzeugt Methylchlorsilane (SiCl2(CH3)2) durch die Müller-Rochow-Synthese. Diese Silane wiederum sind wichtige Ausgangsstoffe für die Silikonherstellung durch Umwandlung in intermediäre Siloxane.
Schließlich kann Chlormethan unter Druck und erhöhter Temperatur mit Natriumhydrogensulfid in Methylmercaptan umgewandelt oder durch Reaktion mit einer Mononatriumbleilegierung in Tetramethylblei umgewandelt werden.
3. Herstellung von Chlormethan
Chlormethan wird durch zwei Hauptmethoden hergestellt: Methanol-Hydrochlorierung und Substitutionschlorierung von Methan.
Beim Methanol-Hydrochlorierungsprozess reagiert Methanol (CH3OH) mit Chlorwasserstoff (HCl) zu Monochlormethan (CH3Cl) und Wasser (H2O).
CH3OH + HCl → CH3Cl + H2O
Bei der Substitutionschlorierung reagiert Methan (CH4) mit Chlor (Cl2) und erzeugt eine Mischung aus Chlormethan und Chlorwasserstoff.
CH4 + Cl2 → CH3Cl + CH2Cl2 + CHCl3 + CCl4 + HCl
Viele Industrieanlagen kombinieren beide Methoden für eine optimierte Produktion. Durch Substitutionschlorierung entsteht die Mischung aus Chlormethan und HCl. Bei der Methanol-Hydrochlorierung wird ein Teil des erzeugten HCl verbraucht, um mehr Chlormethan zu produzieren und den gesamten HCl-Verbrauch zu reduzieren.
3.1. Herstellung von Chlormethan durch Methanol-Hydrochlorierung
Beim Prozess der Methanol-Hydrochlorierung wird die Hydroxylgruppe (–OH) von Methanol durch ein Chloratom aus Chlorwasserstoff (HCl) ersetzt. Diese exotherme Reaktion erzeugt Monochlormethan (CH3Cl) und Wasser (H2O) mit einer Wärmefreisetzung von 33 kJ/mol:
CH3OH + HCl → CH3Cl + H2O ⇔ ΔH = -33 kJ/mol
Diese Reaktion kann entweder in der Dampf- oder Flüssigphase durchgeführt werden. In der flüssigen Phase gibt es sowohl katalytische als auch nichtkatalytische Methoden, während bei Dampfphasenprozessen typischerweise Katalysatoren eingesetzt werden, um die Reaktionsgeschwindigkeit zu erhöhen.
In den meisten industriellen Umgebungen wird in der Reaktionsatmosphäre ein Überschuss an HCl im Verhältnis zu Methanol aufrechterhalten, um die Umwandlung in Richtung Monochlormethanproduktion voranzutreiben.
3.1.1. Gasphasen-Hydrochlorierungsprozess
Der Gasphasen-Hydrochlorierungsprozess verwendet einen festen Säurekatalysator unter kontrolliertem Druck (0,3–0,6 MPa) und Temperatur (280–350 °C). Diese Umwandlung von Methanol in Monochlormethan erfolgt über einen Eley-Rideal-Mechanismus, bei dem chemisorbiertes Methanol mit HCl in der Gasphase auf der Katalysatoroberfläche reagiert.
Die hohe Selektivität (0,2–1 % Dimethylether als Nebenprodukt) wird auf die Fülle an sauren Stellen zurückgeführt, die die gewünschte Reaktion fördern und die konkurrierende Dehydratisierung zu Dimethylether unterdrücken.
Übliche Katalysatoren umfassen Zinkchlorid, Kupferchlorid und Aluminiumoxid, oft auf Trägern wie Kohlenstoff oder Siliziumdioxid. γ-Aluminiumoxid ist eine gängige industrielle Wahl. Studien haben die Kinetik, Alterung und Regeneration dieser Katalysatoren untersucht.
Die Reaktion zeigt eine Abhängigkeit erster Ordnung von HCl, aber eine minimale Abhängigkeit vom Methanoldruck. Bemerkenswert ist, dass die Geschwindigkeitskonstante mit der Oberfläche korreliert und höhere Temperaturen zu Einschränkungen aufgrund der Porendiffusion führen.
Frischer Katalysator bindet zunächst Chlor und bildet saure Stellen für die Methanoladsorption. Die Porendiffusion schränkt die Chloraufnahme ein und führt zur Bildung von Oxid- und Oxidhydratstellen.
Die Alterung des Katalysators wird hauptsächlich durch Kohlenstoffablagerungen aufgrund von Nebenreaktionen und Porenblockierung verursacht, während das Sintern bei hohen Temperaturen die aktive Oberfläche verringert.
Hochreine Rohstoffe, einschließlich technisch reinem Methanol und sauberer HCl, sind entscheidend für die Minimierung von Nebenreaktionen und die Verlängerung der Katalysatorlebensdauer. Wenn HCl aus einem angrenzenden Chlorierungsprozess stammt, ist eine gründliche Reinigung erforderlich, um restliches Chlormethan zu entfernen.
Typische Gasphasenreaktoren verwenden zahlreiche dünne Nickelröhren, die mit Katalysator gefüllt sind. Aufgrund der exothermen Natur der Reaktion ist eine effiziente Wärmeübertragung unerlässlich.
Ein vereinfachtes Flussdiagramm (Abbildung 1) veranschaulicht den Prozess:
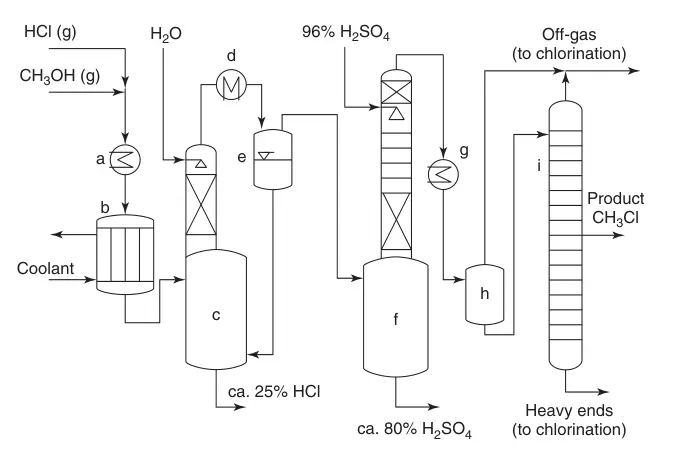
(a) Wärmetauscher; (b) Mehrrohrreaktor; (c) Abkühlen des Produktstroms mit Wasser und Absorption von überschüssigem HCl; (d) Kondensation; (e) Quench-System; (f) Entfernung von Wasser; (g) CH3Cl-Kondensation; (h) Zwischenaufgabe; und (i) Monochlormethan-Reinigung
- Mischen und Erhitzen: HCl und Methanol werden gemischt, erhitzt und dem Reaktor zugeführt.
- Umwandlung und Abschreckung: Das Katalysatorbett treibt die Umwandlung voran, wobei überschüssiges HCl die Bildung des gewünschten Produkts fördert und Dimethylether unterdrückt. Das Reaktionsgas wird mit Wasser gequencht, wodurch überschüssiges HCl absorbiert wird.
- HCl-Absorption und Kühlung: Der Produktstrom durchläuft einen Kühler, wobei Wasser kondensiert und weiteres HCl absorbiert. Das zurückgewonnene HCl wird recycelt, während das Wasser-HCl-Gemisch einer nachgeschalteten Reinigung zur Methanolrückgewinnung unterzogen wird.
- Entfernung von Dimethylether: Der Produktstrom gelangt in eine Schwefelsäuresäule, um Dimethylether und restliches Wasser zu entfernen. Die verbrauchte Säure kann zur Düngemittelproduktion oder zur Schwefelsäurespaltung genutzt werden.
- Chlormethan-Kondensation und Destillation: Trockenes, rohes Chlormethan wird kondensiert und durch eine Hochdruck-Destillationskolonne weiter gereinigt. Der gasförmige Kopf- und Destillationsrückstand kann recycelt werden.
Mit diesem Verfahren wird eine hohe Methanol-basierte Ausbeute von ca. 99 % erreicht.
3.1.2. Flüssigphasen-Hydrochlorierungsprozess
Die Hydrochlorierung von Methanol zu Chlormethan kann in der flüssigen Phase erfolgen, entweder katalytisch oder nichtkatalytisch. Beide Methoden beinhalten einen bimolekularen nukleophilen Substitutionsmechanismus:
- Protonierung: Der erste Schritt beinhaltet die Protonierung des Alkohols durch HCl, wodurch ein positiv geladenes Zwischenprodukt entsteht. (ROH + HCl → ROH2+ + Cl–)
- Nukleophiler Angriff: Im zweiten Schritt greift ein Chloridion den protonierten Alkohol an, was zur Bindungsspaltung und der Bildung des gewünschten Produkts führt . (ROH2+ + Cl–) → [𝛿−Cl · · · R · · · 𝛿+OH2] → RCl + H2O
1. Katalytischer Prozess
Bei der typischen katalytischen Methode wird ein Rührreaktor verwendet, der mit einer wässrigen Metallchloridlösung, häufig ZnCl2 (70–80 Gew.-%), gefüllt ist. Anschließend werden Methanol und HCl-Gas oder Salzsäure in den Reaktor eingespeist.
2. Nichtkatalytischer Prozess
Der von Shin-Estu und Dow entwickelte nichtkatalytische Prozess arbeitet im Vergleich zur katalytischen Methode bei niedrigeren Temperaturen und Drücken und minimiert so die Bildung von Dimethylether als Nebenprodukt . Während nichtkatalytische Gasphasenvarianten existieren, dominiert der Flüssigphasenprozess industrielle Anwendungen.
Das nichtkatalytische Verfahren von Dow nutzt einen Siedebettreaktor, der unter überatmosphärischem Druck (7–21 bar) gehalten wird, um das Reaktionsmedium flüssig auf der gewünschten Temperatur (≥ 50 °C, vorzugsweise 100–180 °C). Dem Reaktor werden Methanol und ein mindestens 10 %iger molarer Überschuss an HCl zugeführt. Die dampfförmigen Produkte gelangen dann in einen Rektifizierturm, wo:
- Zunächst wird Wasserdampf an das HCl-reiche Rückflussprodukt gebunden, wodurch das Produkt effektiv getrocknet wird.
- Dann reagiert überschüssiges HCl mit dem im Reaktor erzeugten Dimethylether und minimiert so dieses unerwünschte Nebenprodukt.
3.2. Chlormethan als Nebenprodukt
Chlormethan entsteht als Nebenprodukt bei der Silikonproduktion durch kupferkatalysierte Methanol-Hydrochlorierung von SiCl2(CH3)2. Es wird aus Si(OH)2(CH3)2 gewonnen und dann wieder in den als Müller-Rochow-Synthese bekannten Prozess der Silanbildung eingeführt .
4. Verwendungsmöglichkeiten von Chlormethan
Chlormethan ist bekannt für seine Verwendung als Rohstoff für die weitere Chlorierung zu Dichlormethan und Trichlormethan. Seine primäre industrielle Verwendung liegt jedoch in der Herstellung von Silikonen, einschließlich Flüssigkeiten, Elastomeren und Harzen.
Diese Materialien finden weit verbreitete Verwendung in verschiedenen Bereichen, von Antischaummitteln in industriellen Prozessen bis hin zu Konsumgütern wie Beschichtungen, Dichtungsmitteln und sogar Körperpflegeprodukten.
Chlormethan wird bei der Synthese von Celluloseethern verwendet. Diese modifizierten Cellulosederivate wie Methylcellulose, Hydroxypropylmethylcellulose (HPMC) und Hydroxyethylmethylcellulose (HEMC) dienen in einer Vielzahl von Anwendungen als Verdickungs-, Emulgier- und Geliermittel. Von Baumaterialien und Kosmetika bis hin zu Lebensmitteln und Pharmazeutika verbessern sie die Produktfunktionalität und -stabilität.
Die methylierenden Eigenschaften von Monochlormethan machen es zu einem wesentlichen Reagens bei der Herstellung kationischer Polymere. Diese Polymere werden häufig in der Wasseraufbereitung für verschiedene Zwecke eingesetzt, darunter Flockung, Koagulation und Schlammentwässerung.
Es trägt auch zur Synthese quartärer Ammoniumverbindungen (Quats) bei, die als Weichspüler und organisch modifizierte Tone für Öl- und Gasbohrungen, in Pflanzenschutzmitteln und in kationischen Polymeren zur Wasseraufbereitung verwendet werden.
Während seine Verwendung in der Kühlung in entwickelten Ländern aufgrund von Sicherheitsbedenken eingestellt wurde, bleibt Chlormethan in bestimmten industriellen Prozessen weiterhin unverzichtbar. Es dient als kryogenes Lösungsmittel bei der Herstellung von Butylkautschuk und im Labor.
Es ist wichtig zu beachten, dass die Wiedereinführung von Chlormethan in Kühlgeräte auf Aluminiumbasis ein erhebliches Sicherheitsrisiko darstellt. Die langsame Grignard-ähnliche Reaktion mit Aluminium kann zu Explosionen mit möglicherweise tödlichen Folgen führen.
Ebenso wurde die Verwendung von Monochlormethan zur Herstellung von Antiklopfadditiven für Kraftstoffe wie Tetraethylblei und Tetramethylblei aus Umwelt- und Gesundheitsgründen weitgehend eingestellt.
Monochlormethan bleibt jedoch bei der Herstellung metallorganischer Verbindungen wie Methyllithium, Methylmagnesiumchlorid, Trimethylaluminium und Methylzinnverbindungen relevant.
Diese Verbindungen sind wesentliche Zwischenprodukte in der Feinchemiesynthese und wirksame Katalysatoren in verschiedenen Polymerisationsreaktionen. Darüber hinaus findet Trimethylaluminium Anwendung bei der chemischen Gasphasenabscheidung und ermöglicht die Herstellung dünner Filme aus hochbeständigem und dielektrischem Aluminiumoxid auf verschiedenen Substraten.
5. Toxikologie von Chlormethan
Chlormethan ist ein geruchloses Gas, was bedeutet, dass der primäre Expositionsweg das Einatmen ist, was besondere Sicherheitsbedenken aufwirft. Seine Auswirkungen auf das Zentralnervensystem (ZNS) sind gut dokumentiert, wobei sowohl Tierversuche als auch Fälle von Exposition beim Menschen darauf hindeuten, dass es zu Verletzungen und sogar zum Tod kommen kann.
Eine übermäßige Exposition gegenüber Chlormethan führt zu Symptomen, die denen einer Alkoholvergiftung ähneln, einschließlich Gangstörungen, Inkohärenz, Orientierungslosigkeit und Persönlichkeitsveränderungen.
Diese Wirkungen können im Vergleich zu Alkohol länger anhalten und in schweren Fällen sogar dauerhaft sein. Interessanterweise traten bei freiwilligen Probanden, die 2 Stunden lang 10 ppm ausgesetzt waren, keine Reizungen oder ZNS-Effekte auf.
Reproduktions- und Entwicklungstoxizität: Übermäßige Exposition bei männlichen Ratten wirkt sich auf die Hoden aus, während Entwicklungstoxizität und mögliche Auswirkungen auf das Herz bei Tieren als geringer angesehen werden Aufgrund höherer Expositionswerte für den Menschen relevant.
Chlormethan zeigt in vitro schwache mutagene Eigenschaften; Allerdings gibt es in vivo Hinweise auf Genotoxizität nur bei hohen, bereits toxischen Konzentrationen.
Zweijährige Karzinogenitätsstudien an Nagetieren ergaben Nierentumoren nur bei männlichen Mäusen bei der höchsten Expositionsstufe (1000 ppm); Dies hängt wahrscheinlich mit wiederholten Organverletzungen zusammen. Die Internationale Agentur für Krebsforschung (IARC) stuft es als „nicht klassifizierbar hinsichtlich seiner Karzinogenität für den Menschen (Gruppe 3)“ ein.
Expositionsgrenzwerte und Sicherheit: Studien mit wiederholter Gabe an Tieren deuten auf eine Konzentration ohne beobachtete schädliche Wirkung (No Observed Adverse Effect Concentration, NOAEC) von mehr als 150 ppm hin. Die Arbeitsplatzgrenzwerte (OELs) variieren weltweit und liegen typischerweise zwischen 20 und 100 ppm.
Referenz
- Chloromethanes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_233.pub4
