Chemische Reaktionen aliphatischer Amine
Aliphatische Amine, die durch das Vorhandensein einer an eine Kohlenstoffkette gebundenen funktionellen Aminogruppe gekennzeichnet sind, zeigen aufgrund des freien Elektronenpaars am Stickstoffatom und der Tendenz der an Stickstoff gebundenen Wasserstoffatome, durch andere Gruppen ersetzt zu werden, vielfältige chemische Reaktionen.
Inhaltsverzeichnis
1. Bildung von Aminsalzen
Ein wichtiger Aspekt aliphatischer Amine ist ihre Fähigkeit, bei Reaktion mit Säuren Salze zu bilden. Aufgrund der Alkylsubstituenten, die sie tragen, sind aliphatische Amine stärkere Basen als Ammoniak. Folglich reagieren sie leicht mit Säuren unter Bildung wasserlöslicher Salze, die in organischen Lösungsmitteln unlöslich sind.

Diese Eigenschaft macht Amine zu hervorragenden Säureakzeptoren und nützlichen Lösungsmitteln bei Gaswäsche- und Extraktionsprozessen (z. B. bei der Synthese halbsynthetischer Penicilline).
Insbesondere tertiäre Amine wie Trimethylamin, Tributylamin und Ethyldiisopropylamin werden häufig als Protonenakzeptoren und Katalysatoren in der organischen Synthese eingesetzt, da sie nach der Reaktion aus der organischen Mischung entfernt werden können.
2. Umwandlung in Carbonsäureamide
Die Reaktion zwischen Aminen und Carbonsäuren sowie deren Estern, Chloriden und Anhydriden führt zur Bildung substituierter Carbonsäureamide:

Diese Umwandlung führt im Allgemeinen zu hohen Ausbeuten, insbesondere beim Einsatz von Carbonsäurechloriden, bei denen es sich um eine stark exotherme Reaktion handelt. Bei der Reaktion mit Carbonsäuren bricht die Reaktion häufig bei der Bildung des anfänglichen Ammoniumsalzes ab.
Dieser Reaktionstyp findet bedeutende industrielle Anwendung, beispielsweise bei der Synthese verschiedener Herbizide mit einer Säureamidstruktur.
Wenn durch diesen Prozess ein Alkylamin mit einem Lacton reagiert, entsteht ein Lactam. Ein bemerkenswertes Beispiel für diese Reaktion ist die Bildung von 1-Ethyl-2-pyrrolidon aus der Kombination von Ethylamin und γ-Butyrolacton.
3. Umwandlung von Aminen in Sulfonamide
Die Reaktion aliphatischer Amine mit Benzolsulfonylchlorid wird zur Unterscheidung zwischen primären, sekundären und tertiären Aminen verwendet, allgemein bekannt als Hinsberg-Test. Darüber hinaus kann diese Reaktion zur präparativen Trennung dieser Amintypen eingesetzt werden.
In diesem Test ergeben primäre Amine alkalilösliche N-Alkylbenzolsulfonamide, während sekundäre Amine alkaliunlösliche N,N-Dialkylbenzolsulfonamide ergeben. Tertiäre Amine hingegen zeigen unter diesen spezifischen Bedingungen keine Reaktivität.
Es ist zu beachten, dass es bei langkettigen primären Aminen zu Einschränkungen kommen kann, da diese trotz der Anwesenheit von saurem Wasserstoff alkaliunlöslich bleiben können. Tertiäre Amine können auch mit Sulfonylchlorid quaternisiert werden, was zu veränderten Reaktionsergebnissen führt.

Sulfonamide spielten einst als Arzneimittel eine wichtige Rolle bei der Behandlung bakterieller Infektionen und retteten im Zweiten Weltkrieg unzählige Leben. Inzwischen wurden sie jedoch durch sicherere Alternativen wie Penicillin und andere Antibiotika ersetzt.
4. Reaktion von Aminen mit Carbonylverbindungen
Unter bestimmten Reaktionsbedingungen und mit geeigneten Verbindungen können Carbonylverbindungen mit Aminen reagieren, was zur Bildung von Iminen (Schiff-Basen) (2) oder Enaminen (3) führt. Diese Produkte können einer weiteren Hydrierung unterzogen werden, um höher alkylierte Amine zu ergeben. Diese Reaktion ist als Methode zur Synthese höherer Amine von großer Bedeutung.
Es ist erwähnenswert, dass die während der Reaktion gebildeten intermediären Halbaminale (1) normalerweise nicht isolierbar sind. Aldehyde reagieren im Allgemeinen schneller als Ketone. Sekundäre Amine bilden ausschließlich Enamine, während tertiäre Amine keines der beiden Produkte ergeben.

Eine Reaktion zwischen einem Amin, einem Aldehyd und einer Verbindung mit einem aktivierten Wasserstoffatom, beispielsweise einem Keton, führt zur Bildung einer Mannich-Base.
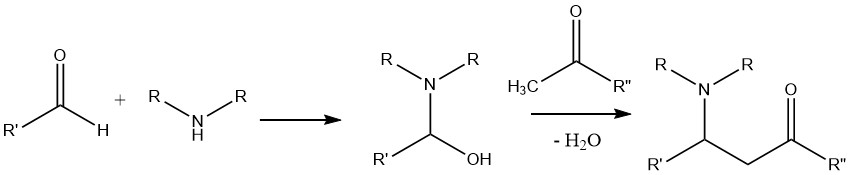
Bei dieser Reaktion wird das zwischen dem Aldehyd und dem Amin gebildete Kondensationsprodukt dem Angriff der sauren α-CH-Verbindung ausgesetzt, die aus dem Keton stammt.
5. Reaktion von Aminen mit Kohlendioxid und Schwefelkohlenstoff
Die bei dieser Reaktion entstehende Carbaminsäure oder Dithiocarbaminsäure weist eine Instabilität auf, kann jedoch in Form eines Salzes oder Esters isoliert werden.

Von verschiedenen Aminen abgeleitete Dithiocarbamate sind als Vulkanisationsbeschleuniger in der Gummiindustrie von großer Bedeutung.
6. Reaktion von Aminen mit Epoxiden
Bei der Reaktion primärer Amine mit Epoxiden entsteht ein Gemisch aus mono- und dioxyalkylierten Derivaten. Andererseits ergeben sekundäre Amine ausschließlich monooxyalkylierte Verbindungen, während tertiäre Amine quartäre Ammoniumverbindungen ergeben.
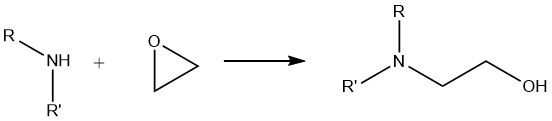
Diese Alkoxylierungsreaktion ist für die industrielle Anwendung aliphatischer Amine von großer Bedeutung. Es wird häufig bei der Synthese von Flockungsmitteln, Oberflächenbeschichtungsharzen, Arzneimittelzwischenprodukten und Produkten für Gaswäscheprozesse wie Ethanolamin und Propanolamin verwendet.
7. Alkylierung von Aminen
Die Reaktion von Aminen mit Alkylhalogeniden und Dialkylsulfaten führt letztlich zur Bildung quartärer Ammoniumverbindungen, die umfangreiche Anwendung in der präparativen pharmazeutischen Chemie sowie bei der Synthese von Korrosionsschutzmitteln und Bioziden finden.
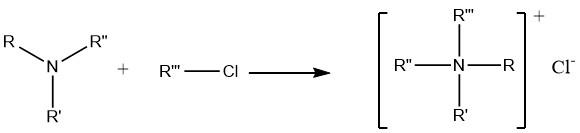
Allerdings ist die Reaktion zwischen Alkylhalogeniden und Ammoniak nicht besonders nützlich für die Herstellung primärer oder sekundärer Amine. Dies ist auf die stärkere Basizität primärer und sekundärer Amine zurückzuführen, die dazu führt, dass diese bevorzugt die Halogenide angreifen, anstatt Substitutionsreaktionen einzugehen.
Durch diese Reaktionen können jedoch immer noch tertiäre Amine hergestellt werden. In Synthesen im Labormaßstab können primäre Amine mithilfe von Hexamethylentetramin und sekundäre Amine mithilfe von Cyanamid synthetisiert werden.
8. Bildung von Isocyanaten und Harnstoffen
Die Reaktion zwischen Phosgen und primären Aminen liefert zunächst das entsprechende Carbonylchlorid. Die anschließende Spaltung von Chlorwasserstoff führt zur Bildung von Alkylisocyanat. Das überschüssige Amin reagiert dann mit dem Isocyanat, was zur Bildung von Harnstoffen führt.
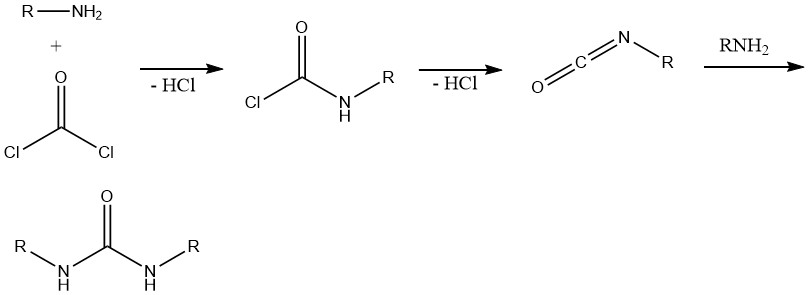
Diese Reaktion ist wichtig bei der Synthese verschiedener Herbizide mit Harnstoff-, Carbamat- oder Thiocarbamat-Strukturen und in polyfunktionellen Aminsystemen, hauptsächlich in der Polyurethanchemie.
In ähnlicher Weise reagieren sekundäre Amine mit Phosgen über ein analoges Zwischenprodukt Chlorid, was zur Bildung von N,N‘-Tetraalkylharnstoffen führt.
9. Reaktion von Aminen mit Acrylnitril
Die großtechnische Addition eines primären oder sekundären Amins an Acrylnitril, die sogenannte 1,2-Michael-Addition, wird häufig zur Synthese höherer Diamine und Polyamine eingesetzt. Diese Reaktion wird begünstigt, da die Nitrilfunktionalität leicht zum entsprechenden Amin hydriert werden kann.

10. Bildung von Isonitrilen
Unter basischen Bedingungen reagieren primäre Amine mit Trichlormethan zu Isonitrilen.
Aufgrund des starken und unangenehmen Geruchs von Isonitrilen kann diese Reaktion als Test für das Vorhandensein primärer Amine genutzt werden. Darüber hinaus kann diese Reaktion auch für niedere Amine als Synthesemethode eingesetzt werden.
Ein alternativer Ansatz beinhaltet die Verwendung von N-Alkylformamiden als Ausgangsmaterialien für die Synthese von Isonitrilen.
11. Oxidation von Aminen
Freie Amine reagieren im Gegensatz zu ihren Salzen empfindlich auf Oxidation, was je nach Oxidationsmittel und Art des beteiligten Amins zur Bildung unterschiedlicher Produkte führt.
Tertiäre Amine bilden bei Oxidation mit Wasserstoffperoxid Aminoxide. Andererseits ergeben primäre und sekundäre Amine bei der Oxidation durch Folgereaktionen mit den gebildeten Verbindungen entsprechende Hydroxylamin oder Aldoxime.

Die Verwendung von salpetriger Säure zur Oxidation dient der Unterscheidung zwischen primären, sekundären und tertiären Aminen. Primäre Amine unterliegen einer Diazotierung, gefolgt von der Eliminierung von gasförmigem Stickstoff, und bilden schließlich durch die Reaktion des intermediären Carbeniumions mit Wasser Alkohole.
Sekundäre Amine reagieren zu gelben N-Nitrosoaminen. Typischerweise zeigen tertiäre Amine unter diesen Bedingungen keine Reaktivität.
Die Bildung von Nitrosaminen kann ein erhebliches Problem darstellen, insbesondere bei sekundären Aminen, da diese stark mutagen sind. Während sie bei normalem Gebrauch normalerweise nicht entstehen, können bei Kontakt mit Nitriten oder Stickoxiden Spuren davon entstehen, was zu Problemen bei der Handhabung führt. Luftverschmutzung durch sekundäre Amine wird daher als problematisch angesehen.
12. Dealkylierung von Aminen
Nach der Umwandlung tertiärer Amine in basische quartäre Ammoniumsalze werden sie beim Erhitzen dealkyliert. In Fällen, in denen nur Methylgruppen vorhanden sind, werden diese als Methanol oder Dimethylether abgespalten. Wenn jedoch höhere Alkylgruppen vorhanden sind, ergeben sie Alkene, wie in der Reaktion veranschaulicht:

Diese Reaktion, die allgemein als Hofmann-Abbau bezeichnet wird, wird in synthetischen Anwendungen nicht häufig eingesetzt. Allerdings spielte es in der Vergangenheit eine bedeutende Rolle bei der Aufklärung der Struktureigenschaften unbekannter Amine.
Referenz
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
