Cumarina: proprietà, reazioni, produzione, usi e tossicologia

Cos’è la cumarina?
La cumarina, nota anche come 2H-1-benzopiran-2-one o 1,2-benzopirone, è un lattone aromatico naturale con formula chimica C9H6O2. È un solido cristallino incolore dall’odore agrodolce simile al fieno ed è utilizzata come fissativo nei profumi.
Vogel isolò per primo la cumarina dalla fava tonka (Dipteryx odorata) nel 1820 e nel 1868 William Perkin la sintetizzò tramite la reazione di Perkin.
La cumarina è ampiamente distribuita nel regno vegetale; si trova nel trifoglio dolce, nell’asperula, nella cassia, nel meliloto, nella lavanda, nel balsamo del Perù e in altre piante a una concentrazione che va da 87.000 ppm a 5 ppb.
In passato la cumarina veniva utilizzata come aroma alimentare, in particolare in combinazione con la vanillina; tuttavia, nel 1954, negli Stati Uniti ne è stato vietato l’uso nell’industria alimentare.
Sommario
1. Proprietà fisiche della cumarina
La cumarina si presenta a temperatura ambiente sotto forma di foglioline incolori e lucide o cristalli rombici, con un gradevole odore dolce di vaniglia e un sapore amarognolo, aromatico e bruciante. È molto solubile in cloroformio e piridina, solubile in etanolo ed etere, e leggermente solubile in acqua.
Le proprietà fisiche della cumarina sono elencate nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero CAS | [91-64-5] |
| Formula chimica | C9H6O2 |
| Peso molecolare | 146,14 g/mol |
| Punto di fusione | 68-70 °C |
| Punto di ebollizione | 301 °C a 100 kPa 170,4 °C a 2,7 kPa 138,5 °C a 0,7 kPa |
| Densità | 0,94 g/cm3 a 25 °C 1,178 g/cm3 a 100 °C |
| Pressione di vapore | 0,13 kPa a 106 °C |
| Punto di infiammabilità | 150 °C |
| Solubilità in acqua | 0,25 g/100 g di acqua a 25 °C 2 g/100 g di acqua a 100 °C |
2. Reazioni chimiche della cumarina
La cumarina subisce le reazioni tipiche del lattone di un acido aromatico α,β-insaturo.
L’anello lattonico della cumarina viene idrolizzato con alcali per produrre sali dell’acido cumarinico o dell’acido o-idrossi-cis-cinnamico. Questi sali sono inodori e si riconvertono a cumarina tramite acidificazione. La reazione della cumarina con idrossido di sodio fuso forma salicilato di sodio e acetato di sodio.
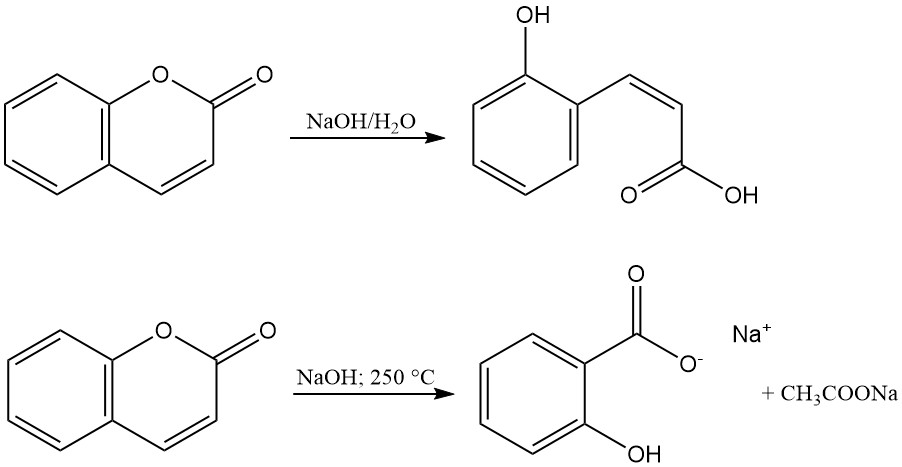
L’idrogenazione catalitica della cumarina produce vari prodotti a seconda delle condizioni di reazione. Condizioni moderate, utilizzando un catalizzatore al nichel Raney, formano 3,4-diidrocumarina (1); tuttavia, temperature e pressioni elevate portano alla formazione di ottaidrocumarina (2), esaidrocromano (3) e prodotti di polimerizzazione.
L’idrogenazione selettiva a 3,4-diidrocumarina (1) può essere ottenuta con un catalizzatore al solfuro di platino, mentre l’idrogenazione a temperature elevate utilizzando un catalizzatore al cromito di rame produce 3-(o-idrossifenil)-1-propanolo (4) con un’ottima resa.
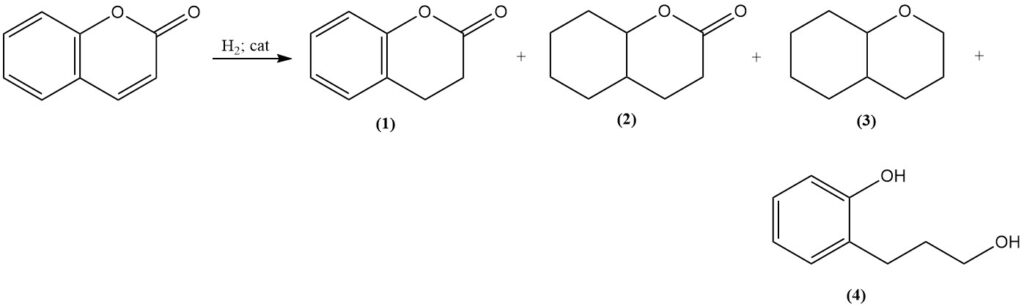
La reazione della cumarina con il bromo produce 3,4-dibromocumarina (5) in condizioni blande. Condizioni più rigorose producono 3-bromocumarina (6) e 3,6-dibromocumarina (7). La reazione con il cloro produce 3-clorocumarina (8).
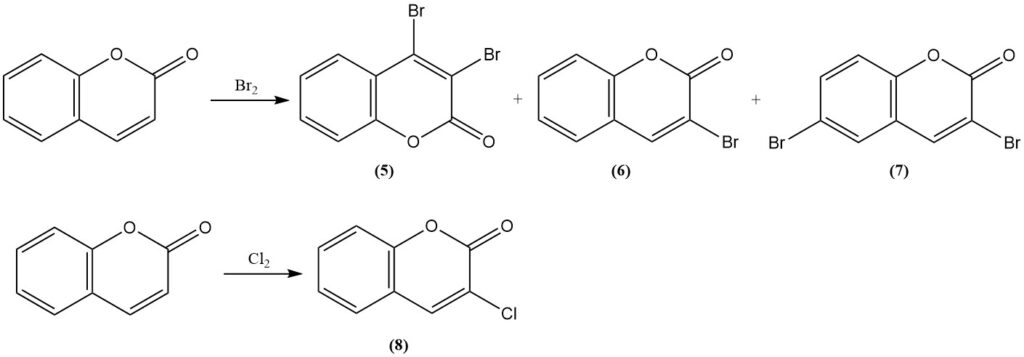
La riduzione della cumarina con idruro di litio e alluminio produce alcol o-idrossicinnamilico.
L’O-allilfenolo viene preparato per reazione della cumarina con diborano.
La cumarina forma idrosolfonati di sodio solubili con bisolfito di sodio, che possono rigenerare la cumarina una volta acidificata. Questa tecnica viene utilizzata per purificare la cumarina grezza.
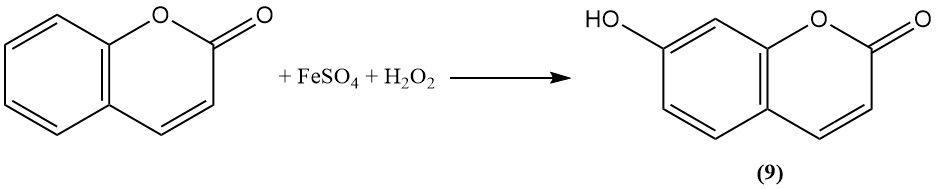
L’ossidazione con il reattivo di Fenton converte la cumarina in umbelliferone (7-idrossicumarina) (9).
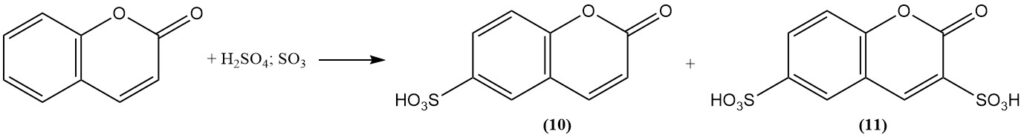
La solfonazione della cumarina mediante acido solforico fumante forma acido cumarina-6-solfonico (10) a temperatura moderata e acido cumarina-3,6-disolfonico (11) a temperatura più elevata.
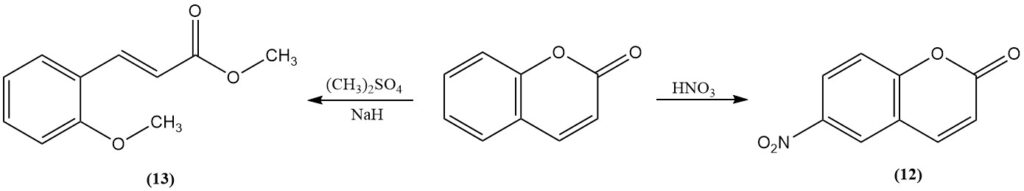
La nitrazione con acido nitrico fumante produce 6-nitrocumarina (12). La metilazione della cumarina con metilsolfato o ioduro di metile in presenza di idruro di sodio produce metil-2-metossicinnamato (13). Il trifluoruro di boro catalizza la fotodimerizzazione della cumarina.
La cumarina può subire altre sostituzioni elettrofile aromatiche come l’alogenazione, l’alchilazione e l’acilazione.
3. Produzione della cumarina
Fino alla fine degli anni ’80, la cumarina veniva ricavata esclusivamente da fonti naturali mediante estrazione da fave tonka e lingua di cervo. Oggi viene prodotta chimicamente utilizzando o-cresolo, fenolo e salicilaldeide come materie prime. Esistono diversi percorsi sintetici per la sintesi della cumarina da ciascuna di queste materie prime.
3.1. Produzione di cumarina da o-cresolo
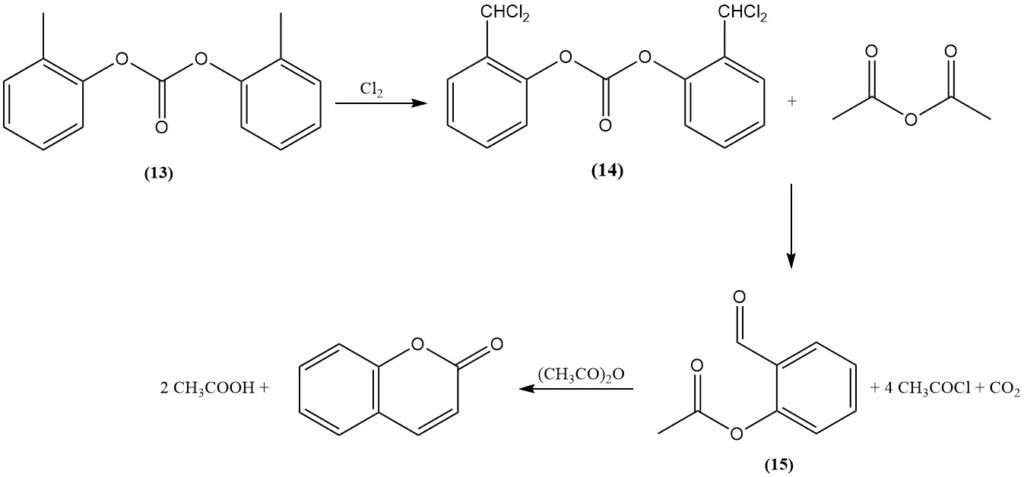
Il processo Raschig, scoperto nel 1909, è una delle principali vie di sintesi per la cumarina da o-cresolo. Inizialmente, il gruppo ossidrilico fenolico dell’o-cresolo viene protetto mediante esterificazione con fosfato o, preferibilmente, carbonato (13). Successivamente, il gruppo metilico viene trasformato in un intermedio di cloruro di benzale (14) mediante diclorurazione.
L’estere α,α-diclorocresilico risultante viene quindi fatto reagire con un acetato alcalino in un idrossido fuso o con anidride acetica catalizzata da un ossido metallico, come l’ossido di cobalto, per formare o-acetilsalicilaldeide (15), cloruro di acetile e anidride carbonica.
Infine, la ciclizzazione dell’o-acetilsalicilaldeide utilizzando anidride acetica genera cumarina e acido acetico.
3.2. Produzione di cumarina dal fenolo
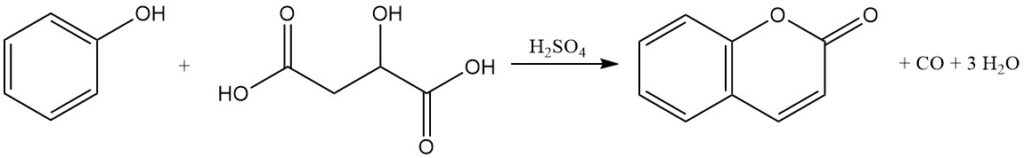
La condensazione di Pechmann, scoperta nel 1883, rappresenta un metodo primario per la produzione di cumarina dal fenolo. In questo processo, la cumarina viene prodotta dalla reazione del fenolo con acido malico, maleico o fumarico in presenza di acido solforico concentrato.
La reazione di Pechmann è ampiamente utilizzata nella sintesi di numerosi derivati della cumarina. Ad esempio, la condensazione del fenolo con acetoacetato di etile produce 4-metilcumarina. Inoltre, il fenolo può reagire con il dichetene per formare cumarina.
Il fenolo reagisce con specifici derivati dell’acido acrilico per produrre cumarina.
La cumarina viene anche prodotta dalla reazione del fenolo con il cloruro dell’acido 3-etossiacrilico per produrre feniletossiacrilato, seguita da una reazione di ciclizzazione con acido solforico. Inoltre, la cumarina viene sintetizzata dalla reazione del fenolo con metilacrilato in un mezzo acido in presenza di aria.
3.3. Produzione di cumarina da salicilaldeide
Reazione di Perkin
La reazione di Perkin, scoperta inizialmente da Perkin nel 1868, rappresenta un metodo classico per la sintesi della cumarina da salicilaldeide. Questo processo prevede la reazione della salicilaldeide con anidride acetica in presenza di acetato di sodio come catalizzatore. La reazione procede attraverso la formazione di acido cis-o-acetossicinnamico (16) come intermedio.
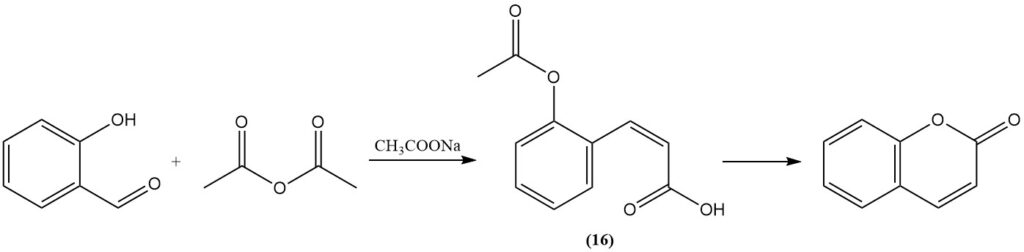
La reazione di Perkin è importante a livello industriale, motivo per cui è stata ampiamente studiata e modificata per migliorarne l’efficienza. Queste modifiche includono l’aggiunta di iodio, ossidi metallici o sali; l’aggiunta di piridina o piperidina come catalizzatori; la sostituzione dell’acetato di sodio con carbonato di potassio o acetato di cesio; e l’uso di biacetato di metallo alcalino.
Reazione di Knoevenagel
La condensazione di Knoevenagel è una reazione per sintetizzare cumarine 3-sostituite a partire dalla salicilaldeide. Prevede la condensazione della salicilaldeide con composti metilenici attivi, come l’acido acetoacetico, l’acido malonico o l’acido cianoacetico, in presenza di un catalizzatore a base organica come ammoniaca, piridina e ammine primarie e secondarie.
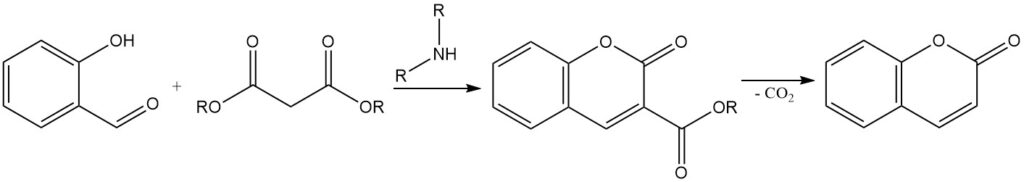
La cumarina 3-sostituita risultante può essere convertita in cumarina mediante la rimozione del gruppo sostituente. Ad esempio, l’acido 3-carbossilico della cumarina, ottenuto dalla condensazione della salicilaldeide con l’acido malonico, può essere decarbossilato riscaldando fino a 290 °C per formare cumarina.
Una reazione di decarbossilazione moderata con una resa migliore può essere ottenuta utilizzando sali di mercurio.
3.4. Altri metodi
Vie di sintesi alternative per la cumarina includono la ciclodeidrogenazione dell’ossocicloesano propionato e la deidrogenazione mediante zolfo elementare o catalisi in fase vapore con ossidi metallici della 3,4-diidrocumarina, ottenuta dall’ossidazione Baeyer-Villiger dell’1-indanone.
3.5. Purificazione della cumarina
La cumarina sintetica deve avere un elevato grado di purezza per essere utilizzata in profumeria. I metodi di purificazione convenzionali includono la distillazione frazionata a pressione ridotta e la cristallizzazione da solventi come metanolo o etanolo.
Ulteriori trattamenti prima del processo di distillazione includono i seguenti passaggi: riscaldamento della cumarina grezza con acido solforico concentrato, neutralizzazione e lavaggio con acqua; dissoluzione del prodotto lavato in acido solforico concentrato seguita da ossidazione; e riflusso con idrossido di sodio acquoso con successiva separazione delle fasi organiche e lavaggio.
La distillazione azeotropica sotto vuoto con poliidrossialcoli, come il trietilenglicole, è un metodo di purificazione alternativo. Sono state segnalate anche tecniche di fusione a zona per la purificazione della cumarina.
4. Usi della cumarina
Grazie al suo caratteristico aroma dolce e alla sua stabilità, la cumarina viene utilizzata come ingrediente in profumi, saponi, detergenti e lozioni a concentrazioni che vanno dallo 0,01 al 2,4%.
Spesso associata a fragranze erbacee, la cumarina è parte integrante della composizione di fragranze fougère e chypre. Viene utilizzata come fissativo per prolungare la durata degli oli essenziali naturali, come lavanda, agrumi, rosmarino e muschio di quercia.
Oltre all’uso in profumeria, la cumarina conferisce aromi gradevoli a prodotti per la casa e prodotti industriali, mascherando al contempo gli odori sgradevoli.
Viene utilizzata anche come mezzo di contrasto nei coloranti laser e come sensibilizzante nelle vecchie tecnologie fotovoltaiche.
La cumarina e i suoi derivati sono stati studiati per potenziali usi terapeutici, tra cui il trattamento della schizofrenia, dei disturbi del microcircolo, delle ulcere angiopatiche, degli edemi iperproteici e del cancro.
Viene utilizzato come farmaco per il trattamento del linfedema iperproteico e per migliorare la circolazione venosa, ed è stato testato in studi clinici come antineoplastico.
È stato dimostrato che la cumarina è attiva nella propigmentazione e nel rallentamento della caduta dei capelli. Un derivato della cumarina è stato impiegato nella polarizzazione di cristalli fotoelettrici.
Oggi, l’uso della cumarina come additivo alimentare diretto è vietato; tuttavia, viene utilizzata come aromatizzante del tabacco e anche nell’industria galvanica.
È importante ricordare che, sebbene i composti derivati dalla cumarina, come il warfarin, siano potenti anticoagulanti, la cumarina di per sé non è un anticoagulante.
5. Tossicologia della cumarina
La cumarina presenta rischi significativi per la salute. L’ingestione, l’inalazione e il contatto con gli occhi sono pericolosi, mentre il contatto con la pelle è meno grave. La sovraesposizione acuta può essere fatale. La cumarina mostra una moderata tossicità per fegato e reni, con una dose letale mediana di 275 mg/kg. L’epatotossicità è più pronunciata nei ratti rispetto ai topi.
I dati tossicologici (LD50) per la cumarina sono:
- 293 mg/kg (ratto)
- 196 mg/kg (topo)
- 202 mg/kg (cavia)
La corteccia di cassia, una varietà di cannella, contiene alti livelli di cumarina. Il consumo eccessivo di corteccia di cassia può essere dannoso a causa del suo elevato contenuto di cumarina.
La Food and Drug Administration statunitense ha vietato l’aggiunta diretta di cumarina ai prodotti alimentari. Tuttavia, additivi naturali contenenti cumarina, come l’asperula odorosa, sono consentiti nelle bevande alcoliche in base a normative specifiche.
5.1. Vie di esposizione
L’esposizione umana alla cumarina avviene principalmente per contatto cutaneo con profumi e prodotti contenenti fragranze cumarine. La pelle assorbe rapidamente la cumarina, rendendola un’importante via di somministrazione per applicazioni terapeutiche come il trattamento del linfedema.
Inoltre, l’esposizione umana può avvenire per ingestione orale attraverso alimenti naturali, prodotti farmaceutici e prodotti del tabacco. L’assorbimento gastrointestinale della cumarina è rapido.
5.2. Tossicocinetica
Ampie ricerche hanno descritto l’assorbimento, il metabolismo e l’escrezione della cumarina. La via di esposizione influenza significativamente i livelli ematici e la tossicità.
Dosi orali in bolo determinano concentrazioni plasmatiche nettamente superiori a quelle osservate con l’assunzione alimentare, nonostante livelli equivalenti di milligrammi per chilogrammo di peso corporeo.
L’esposizione cutanea bypassa il metabolismo epatico iniziale (effetto di primo passaggio). La cumarina nel sangue passa prima attraverso i polmoni, dove una porzione significativa può essere espirata prima del metabolismo epatico.
Gli esseri umani metabolizzano principalmente la cumarina in 7-idrossicumarina, una sostanza non tossica. La formazione epatica di acido o-idrossiacetico è minima e viene rapidamente detossificata. L’assenza di abbondanti cellule di Clara nei polmoni umani impedisce la generazione polmonare di epossido e acido o-idrossiacetico, anche a dosi elevate di cumarina.
Studi che utilizzano microsomi epatici umani correlano la bassa capacità di 7-idrossilazione con una ridotta formazione di epossido.
5.3. Tossicità acuta e a breve termine
- Studi sugli animali
I valori di LD50 riportati per la cumarina variano da 160 a 780 mg/kg di peso corporeo, con variazioni attribuibili alla specie animale, al ceppo e allo stato di digiuno. Dopo l’esposizione è stata osservata una lieve irritazione oculare e cutanea.
L’esposizione alimentare alla cumarina a livelli ≥2500 ppm per almeno quattro settimane può portare a una riduzione del consumo di cibo, a una riduzione del peso corporeo e a microscopiche alterazioni epatiche. Concentrazioni alimentari più elevate (1-2%) provocano rifiuto del cibo e mortalità.
La riproduzione può essere influenzata negativamente a dosi elevate che incidono significativamente sul consumo di cibo, ma non sono stati segnalati effetti sulla riproduzione o sullo sviluppo a dosi inferiori.
- Studi sull’uomo
L’esposizione umana alla cumarina avviene attraverso il consumo di cannella, tè verde, miele di trifoglio dolce e altri alimenti. Sono stati segnalati casi di sanguinamento associati all’assunzione di tisane contenenti fave di tonka, meliloto e asperula odorosa.
I dosaggi di cumarina farmaceutica variano da 70 a 7000 mg/die, con 200 mg una o due volte al giorno come regime terapeutico più comune.
L’epatotossicità è stata raramente segnalata a seguito dell’uso di cumarina farmaceutica. Le alterazioni degli enzimi epatici associati sono spesso reversibili alla sospensione del trattamento e talvolta anche durante la sua prosecuzione.
I tassi di incidenza segnalati variano da <0,1% a <6%, a seconda della popolazione in studio e del dosaggio. Sebbene alcuni decessi siano stati collegati all’uso di cumarina, fattori confondenti come condizioni mediche preesistenti complicano l’interpretazione causale.
Studi che hanno indagato il polimorfismo del CYP2A6 nell’uomo non hanno stabilito una correlazione con la disfunzione epatica associata alla cumarina.
La cumarina è stata sottoposta a test di sensibilizzazione in vari modelli, tra cui l’applicazione cutanea su cavie, il test di rigonfiamento auricolare su topi e il test linfonodale locale (LLNA). La cumarina pura ha prodotto costantemente risultati negativi, anche a concentrazioni fino al 50% in recenti studi LLNA.
Tuttavia, un’impurità clorurata (6-clorocumarina) e una cumarina meno pura derivata dall’o-cresolo hanno dimostrato proprietà sensibilizzanti, in linea con i casi di sensibilizzazione segnalati che coinvolgono derivati della cumarina.
Le popolazioni umane, a differenza degli animali da laboratorio, possono avere una preesistente esposizione alla cumarina o a sostanze cross-reattive, complicando la valutazione della sensibilizzazione umana.
L’attività anticoagulante della cumarina è significativamente inferiore a quella del warfarin. Case report suggeriscono che la cumarina possa potenziare gli effetti degli antagonisti della vitamina K, sebbene il meccanismo sottostante rimanga poco chiaro. La cumarina non è stata associata a teratogenicità o effetti riproduttivi avversi nell’uomo.
5.4. Tossicità cronica
- Studi sugli animali
Sono stati condotti ampi studi di tossicità e cancerogenicità a lungo termine sulla cumarina. I principali effetti avversi osservati negli animali sono una riduzione del consumo di cibo che porta a una riduzione del peso corporeo e tossicità epatica, in particolare nei ratti.
Tumori epatici, sebbene non metastatici e non letali, sono stati segnalati in ratti esposti a dosi elevate (≥150 mg/kg di peso corporeo) che hanno ridotto significativamente l’aumento di peso corporeo. Tumori polmonari sono stati identificati in topi esposti a dosi elevate in bolo (≥150 mg/kg di peso corporeo), ma non in quelli esposti tramite la dieta.
- Studi sull’uomo
L’esposizione professionale alla polvere di cumarina può causare irritazione respiratoria. Inoltre, la cumarina può agire come un debole sensibilizzante cutaneo in individui predisposti, con un grado di sensibilizzazione influenzato dalla purezza della sostanza. Non sono stati documentati altri effetti avversi a lungo termine sull’uomo.
L’Agenzia Internazionale per la Ricerca sul Cancro (IARC) ha classificato la cumarina nel Gruppo 3, indicando che non è classificabile come cancerogeno per l’uomo.
Tossicità in vitro
La cumarina non è mutagena e non si lega al DNA. Non mostra proprietà clastogeniche, il che indica un impatto trascurabile sui cromosomi.
Tossicità riproduttiva
A differenza del warfarin, la cumarina non è teratogena.
Genotossicità
Diversi studi hanno dimostrato in modo coerente che la cumarina non è genotossica. Ha mostrato proprietà protettive contro le mutazioni indotte dalla doxorubicina.
Carcinogenicità
Non ci sono prove conclusive per classificare la cumarina come cancerogena. Infatti, alcune ricerche suggeriscono potenziali effetti antiossidanti e antineoplastici.
Gestione clinica del sovradosaggio
A causa della tossicità relativamente bassa della cumarina, i protocolli specifici per la gestione del sovradosaggio sono limitati. Possono essere prese in considerazione misure generali, come la decontaminazione gastrica in caso di ingestione orale significativa. Si raccomanda il monitoraggio del rapporto internazionale normalizzato e dei test di funzionalità epatica.
Ecotossicità
La cumarina presenta una bassa tossicità ambientale. Studi di tossicità acquatica hanno mostrato valori di LC50 di 56 mg/L per i pesci e valori di EC50 di 55 mg/L per Daphnia magna. La respirazione algale è inibita a concentrazioni di laboratorio di 50 mmol/L.
Data la sua persistenza relativamente bassa, si prevede che la cumarina si degradi rapidamente nell’ambiente.
Riferimenti
- Coumarin; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0315211302150919.a01.pub2
- Coumarins. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543007983
- https://www.sciencedirect.com/science/article/abs/pii/B0123694000002696
- https://onlinelibrary.wiley.com/doi/10.1002/mnfr.200900281
- https://www.sciencedirect.com/science/article/abs/pii/B9780124095472126204
- https://pubchem.ncbi.nlm.nih.gov/compound/Coumarin
