Etilbenzene: proprietà, produzione, usi e tossicologia
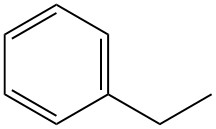
Cos’è l’etilbenzene?
L’etilbenzene, noto anche come feniletano, è un idrocarburo alchilaromatico a singolo anello con formula C8H10. È un liquido incolore, altamente infiammabile, dal caratteristico odore aromatico.
Viene utilizzato principalmente (>99%) come intermedio nella produzione di stirene monomero, uno dei prodotti chimici di largo consumo più importanti a livello globale.
La produzione su scala commerciale di etilbenzene iniziò negli anni ’30 da parte di Dow Chemical (USA) e BASF (Germania). L’industria dell’etilbenzene/stirene rimase relativamente poco importante fino alla Seconda Guerra Mondiale.
L’impennata della domanda di gomma sintetica stirene-butadiene (SBR) durante gli anni della guerra accelerò i rapidi progressi tecnologici e una significativa espansione della capacità produttiva. Questo sforzo bellico portò alla costruzione di numerose fabbriche su larga scala e la produzione di stirene si trasformò rapidamente in un’industria di primaria importanza.
Nel 1999, la capacità produttiva annua globale di etilbenzene aveva raggiunto quasi 25 milioni di tonnellate. In particolare, gli anni ’90 hanno visto la crescita di capacità più significativa nei paesi dell’Estremo Oriente (Giappone escluso), dove le principali industrie petrolchimiche hanno registrato un notevole sviluppo ed espansione.
Sommario
1. Proprietà fisiche dell’etilbenzene
In condizioni normali, l’etilbenzene è un liquido incolore dall’odore aromatico. È insolubile in acqua ma solubile in tutte le proporzioni in etanolo ed etere etilico. L’etilbenzene è irritante per la pelle e gli occhi ed è moderatamente tossico per ingestione, inalazione e adsorbimento cutaneo.
Alcune proprietà fisiche dell’etilbenzene sono elencate nella tabella seguente.
| Proprietà | Valore |
|---|---|
| Numero CAS | [100-41-4] |
| Formula chimica | C6H5CH2CH3 |
| Massa molecolare | 106,168 g/mol |
| Densità |
|
| Punto di fusione | -94,949 °C |
| Punto di ebollizione (101,3 kPa) | 136,2 °C |
| Indice di rifrazione |
|
| Densità di vapore | 3,66 |
| Pressione critica | 3609 kPa (36,09 bar) |
| Temperatura critica | 344,02 °C |
| Punto di infiammabilità (vaso chiuso) | 15 °C |
| Temperatura di autoaccensione | 460 °C |
| Limite di infiammabilità |
|
| Calore latente |
|
| Potere calorifico |
|
| Viscosità cinematica |
|
| Tensione superficiale | 28,48 mN/m |
| Calore specifico |
|
| Fattore acentrico | 0,3026 |
| Comprimibilità critica | 0,263 |
2. Reazioni chimiche dell’etilbenzene
La reazione commerciale più significativa dell’etilbenzene è la sua deidrogenazione a stirene. Questa reazione avviene ad alte temperature (600-660 °C) e in genere utilizza un catalizzatore a base di ossido di ferro promosso da potassio con vapore come diluente.
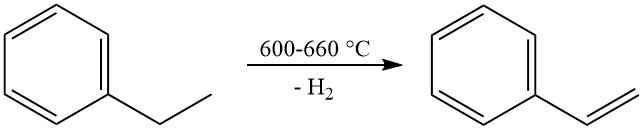
La produzione industriale raggiunge selettività per lo stirene che vanno dal 90 al 97% molare con conversioni per passaggio del 60-70%. La principale reazione secondaria è la dealchilazione dell’etilbenzene a benzene e toluene.
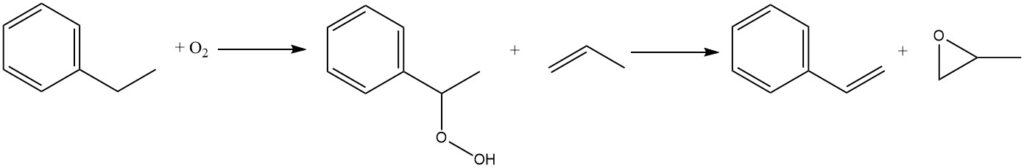
Un’altra reazione che sta acquisendo importanza commerciale è l’ossidazione in aria dell’etilbenzene a idroperossido di etilbenzene. Si tratta di un processo non catalizzato che avviene in fase liquida. Tuttavia, a causa dell’instabilità intrinseca degli idroperossidi, l’esposizione ad alte temperature deve essere ridotta al minimo per ridurre la velocità di decomposizione.
L’idroperossido viene successivamente trattato con propilene per co-produrre stirene e ossido di propilene. Nel 1999, circa il 15% della produzione globale di etilbenzene era destinato alla coproduzione di stirene monomero e ossido di propilene tramite questo processo.
Analogamente al toluene, l’etilbenzene può essere dealchilato a benzene attraverso processi catalitici o termici. Inoltre, l’etilbenzene subisce diverse altre reazioni caratteristiche dei composti alchilaromatici, come alchilazione, acilazione, nitrazione e solfonazione.
3. Produzione industriale dell’etilbenzene
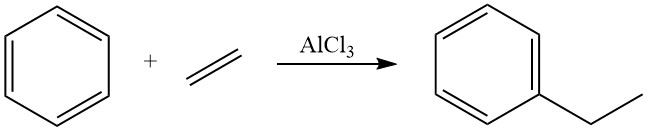
Storicamente, per diversi decenni, il metodo dominante per la produzione di etilbenzene è stata l’alchilazione di Friedel-Crafts del benzene con etilene, utilizzando acidi di Lewis disciolti, principalmente cloruro di alluminio, come catalizzatori in fase liquida. Questo metodo è tuttora utilizzato per circa il 40% della produzione globale di etilbenzene.
Sebbene il metodo del cloruro di alluminio possa essere economicamente competitivo, questo processo genera flussi di rifiuti sempre più costosi da smaltire a causa delle normative ambientali. Inoltre, il cloruro di alluminio è altamente corrosivo, con conseguenti significative esigenze di manutenzione per apparecchiature e tubazioni.
Dall’inizio degli anni ’80, i catalizzatori a zeolite eterogenea sono diventati la tecnologia preferita per i nuovi impianti di produzione di etilbenzene. La tecnologia iniziale a zeolite funzionava in fase vapore, il che garantiva una migliore efficienza di processo rispetto al cloruro di alluminio in fase liquida.
Più recentemente, sono stati sviluppati processi a zeolite in fase liquida, che offrono maggiore flessibilità. Questa tecnologia genera meno rifiuti pericolosi rispetto al processo a cloruro di alluminio.
Le crescenti preoccupazioni ambientali e i progressi nella tecnologia a zeolite hanno incentivato molti produttori che utilizzano unità a cloruro di alluminio a modernizzare i propri impianti con la tecnologia a zeolite. Tra il 1997 e il 1999, circa 106 tonnellate di capacità sono state convertite dai processi a cloruro di alluminio a quelli a zeolite.
A partire dal 2000, ulteriori conversioni erano in fase di progettazione e la costruzione di nuovi impianti che utilizzavano la tecnologia del cloruro di alluminio è praticamente cessata nell’ultimo decennio.
Alcuni impianti producono una quantità minore di etilbenzene mediante superfrazionamento di flussi aromatici C8 misti.
3.1. Produzione di etilbenzene mediante cloruro di alluminio e altre catalisi con acidi di Lewis
Per diversi decenni, i processi con cloruro di alluminio in fase liquida hanno dominato la produzione di etilbenzene. Diverse aziende, tra cui Dow, BASF, Shell e Monsanto, hanno sviluppato varianti di questa tecnologia. Oggi, circa il 40% della produzione globale di etilbenzene utilizza ancora AlCl3.
L’alchilazione del benzene con etilene è altamente esotermica, rilasciando una quantità significativa di calore (ΔH = -114 kJ/mol). L’uso del cloruro di alluminio come catalizzatore in questa reazione favorisce una reazione rapida con rese di etilbenzene quasi stechiometriche.
Possono essere impiegati anche altri acidi di Lewis come AlBr3, FeCl3, ZrCl4 e BF3. I processi che utilizzano AlCl3 spesso incorporano promotori come il cloruro di etile o l’acido cloridrico. Questi promotori riducono la quantità di AlCl3 necessaria per la reazione.
Il processo convenzionale con AlCl3 (Figura 1) utilizza tre fasi nel reattore: liquido aromatico (benzene), gas etilene e una fase complessa catalizzatrice a base di olio rosso. La reazione avviene in condizioni di equilibrio termodinamico prossimo, richiedendo un singolo reattore sia per l’alchilazione che per la transalchilazione.
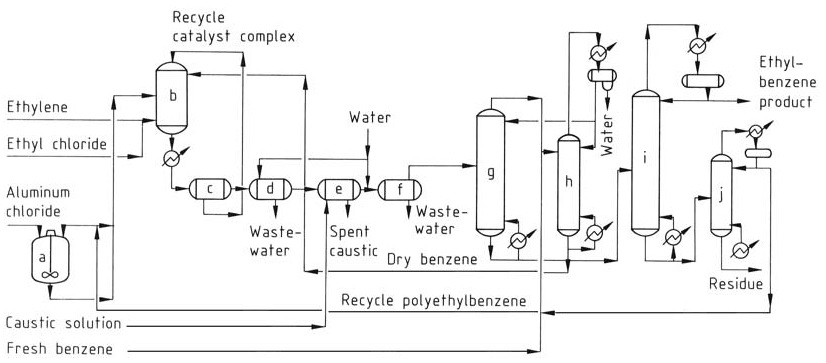
a) Serbatoio di miscelazione del catalizzatore; b) Reattore di alchilazione; c) Vasca di sedimentazione; d) Separatore di acido; e) Separatore di caustica; f) Separatore d'acqua; g) Colonna di recupero del benzene; h) Colonna deidratatrice del benzene; i) Colonna di recupero dell'etilbenzene; j) Colonna di polietilbenzene
La miscela complessa del catalizzatore, il benzene secco e i polialchilbenzeni riciclati vengono alimentati in continuo nel reattore. L’etilene e un promotore del catalizzatore (ad esempio, cloruro di etile) vengono iniettati nella miscela di reazione.
Le temperature operative sono limitate a 130 °C per impedire la disattivazione del catalizzatore e la formazione di sottoprodotti, e viene mantenuta una pressione sufficiente a mantenere i reagenti in fase liquida.
Il processo Monsanto migliorato (Figura 2) offre vantaggi rispetto ai processi convenzionali con AlCl3 ed è stato implementato in molti impianti più vecchi.
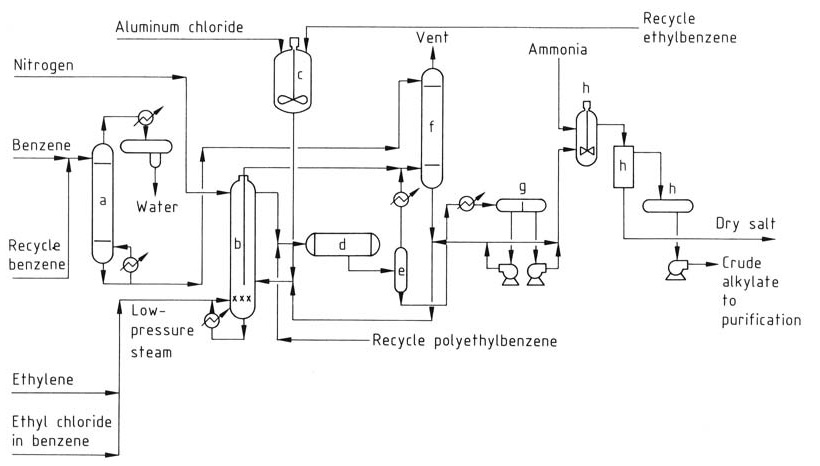
a) Colonna di essiccazione del benzene; b) Reattore di alchilazione; c) Serbatoio di preparazione del catalizzatore; d) Transalchilatore; e) Flash drum; f) Sistema di lavaggio dei gas di sfiato; g) Decantore; h) Sistema di neutralizzazione
Questo processo opera a temperature più elevate (160-180 °C) e utilizza una fase liquida omogenea. La temperatura più elevata consente il recupero del calore di scarto sotto forma di vapore. Tuttavia, a causa della minore concentrazione del catalizzatore, è necessario un reattore di transalchilazione separato.
Ottimizzando la temperatura e l’aggiunta di etilene, il processo riduce significativamente la quantità di catalizzatore AlCl3 richiesta, riducendo al minimo i problemi di smaltimento dei rifiuti e, poiché opera in un’unica fase liquida omogenea, elimina la complessa fase catalitica presente nei metodi tradizionali.
Sia i processi convenzionali che quelli Monsanto impiegano fasi di purificazione simili che coinvolgono più colonne di distillazione per separare le frazioni non convertite di benzene, etilbenzene e polialchilbenzene. Il residuo organico (olio di flusso) viene tipicamente utilizzato come combustibile.
Il processo Alkar, sviluppato da UOP, utilizzava il trifluoruro di boro come catalizzatore acido di Lewis. Pur offrendo vantaggi come l’elevata purezza dell’etilbenzene prodotto e la possibilità di utilizzare etilene diluito come materia prima, il processo non è favorevole a causa degli elevati costi di manutenzione e della sensibilità del catalizzatore anche a piccole quantità d’acqua.
3.2. Produzione di etilbenzene mediante alchilazione in fase vapore su zeoliti
La tecnologia Mobil-Badger in fase vapore, che sfrutta il catalizzatore a zeolite sintetica ZSM-5 di Mobil, è nata negli anni ’70. Questa tecnologia è stata offerta in diverse configurazioni.
Il progetto di prima generazione, commercializzato nel 1980, eseguiva l’alchilazione e la transalchilazione in un unico reattore, in modo simile ai processi con cloruro di alluminio. La più recente tecnologia di terza generazione separa questi processi, offrendo vantaggi in termini di resa, purezza e costi di capitale.
Il processo a zeolite in fase vapore è particolarmente adatto per flussi di etilene diluito, come quelli derivati dalle unità di cracking catalitico a letto fluido nelle raffinerie.
Fino all’introduzione delle tecnologie a zeolite in fase liquida negli anni ’90, questo processo ha dominato le nuove installazioni grazie alla sua capacità di evitare i flussi di scarto acquosi generati dalla tecnologia al cloruro di alluminio.
Mobil-Badger ha concesso in licenza 31 unità dal 1980 e la tecnologia rimane rilevante per le materie prime di etilene diluito.
Il catalizzatore ZSM-5 a letto fisso promuove la stessa reazione di alchilazione di altri processi. Tuttavia, l’adsorbimento dell’etilene sui siti acidi di Brønsted della zeolite attiva la molecola di etilene, facilitandone il legame con il benzene. Questo meccanismo porta a un sottoprodotto diverso rispetto ai processi Friedel-Crafts.
L’acciaio al carbonio è il materiale di costruzione principale grazie all’assenza di componenti altamente corrosivi. Il design di terza generazione è illustrato nella Figura 3.
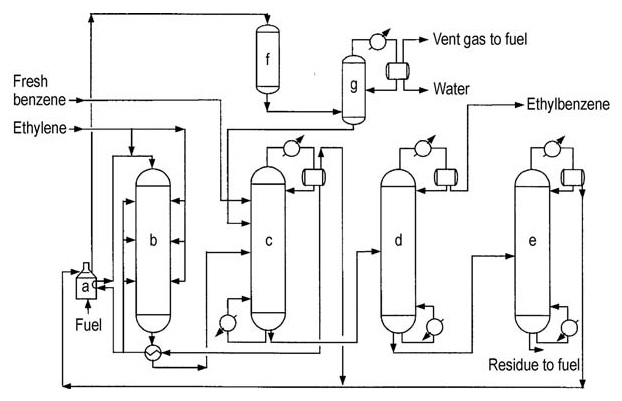
a) Riscaldatore di alimentazione del reattore; b) Reattore di alchilazione; c) Colonna di recupero del benzene; d) Colonna di recupero dell'etilbenzene; e) Colonna di recupero del polietilenebenzene; f) Reattore secondario; g) Stabilizzatore
Il reattore di alchilazione opera a 350-450 °C e 1-3 MPa, consentendo il recupero della maggior parte del calore di processo sotto forma di vapore. Il reattore utilizza una configurazione multi-letto con un riscaldatore a combustione e un sistema di recupero del calore.
Il benzene in eccesso viene mantenuto rispetto all’etilene. Il catalizzatore si disattiva gradualmente a causa della formazione di coke, richiedendo una rigenerazione periodica in situ (circa ogni 18-24 mesi), che richiede circa 36 ore.
Rispetto alle zeoliti in fase liquida e ai catalizzatori ad acido di Lewis, questa tecnologia mostra una maggiore tolleranza ad acqua, zolfo e altri potenziali veleni.
L’effluente vaporizzato del reattore viene sottoposto a purificazione. Il benzene viene recuperato tramite distillazione nella prima colonna e riciclato. La seconda colonna separa l’etilbenzene dal flusso di fondo, che viene quindi indirizzato a una colonna finale per la separazione delle frazioni riciclabili di alchilbenzene e polialchilbenzene dal residuo pesante non riciclabile.
Questo residuo a bassa viscosità, composto principalmente da difenilmetano e difeniletano, viene utilizzato come combustibile. Gli alchilbenzeni superiori e i polialchilbenzeni riciclabili separati vengono alimentati al transalchilatore in fase vapore, dove reagiscono con il benzene in eccesso su un catalizzatore a zeolite.
Il transalchilatore opera a pressione inferiore ma a temperatura superiore rispetto all’alchilatore, promuovendo la dealchilazione degli alchilbenzeni superiori e transalchilando il dietilbenzene a etilbenzene. Questa capacità di dealchilazione riduce al minimo la produzione complessiva di residui.
I precedenti processi di prima e seconda generazione differivano principalmente per la posizione del flusso di polietilbenzene di riciclo, il che comportava prestazioni inferiori rispetto al progetto di terza generazione.
3.3. Produzione di etilbenzene mediante alchilazione in fase liquida su zeoliti
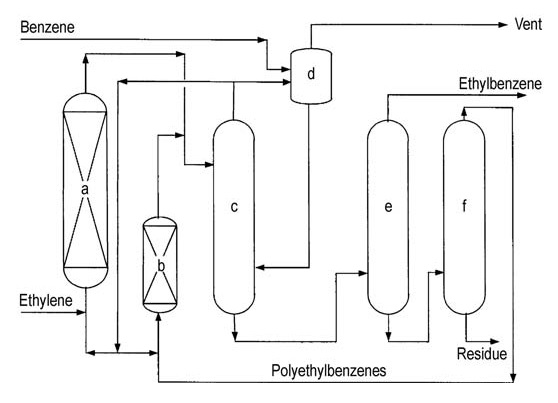
La tecnologia delle zeoliti in fase liquida per la produzione di etilbenzene è emersa all’inizio degli anni ’90. Il primo impianto commerciale, operativo a Oita, in Giappone, utilizzava catalizzatori ultrastabili a zeolite Y o zeolite beta, concessi in licenza da ABB Lummus Global e Unocal (successivamente acquisita da ABB).
Un altro processo, EBMax di Mobil-Badger, impiegava il catalizzatore Mobil MCM-22. Nel 1999, dodici impianti erano operativi in tutto il mondo.
Rispetto alle precedenti tecnologie che utilizzavano etilene di grado polimerico, i processi a zeolite in fase liquida richiedono investimenti inferiori e forniscono un prodotto a base di etilbenzene di qualità superiore.
La tecnologia in fase vapore è ora concessa in licenza principalmente da Mobil-Badger per applicazioni che prevedono l’utilizzo di etilene diluito.
I processi in fase liquida richiedono zeoliti a pori più ampi, rispetto alla ZSM-5 utilizzata nei processi in fase vapore, per superare i limiti di diffusione. La rigenerazione del catalizzatore fuori sede è generalmente raccomandata a causa dei tempi di ciclo prolungati, riducendo la necessità di apparecchiature in loco e i costi di investimento.
Entrambi i principali licenziatari (ABB Lummus e Mobil-Badger) offrono diagrammi di flusso dei processi simili (Figure 4 e 5).
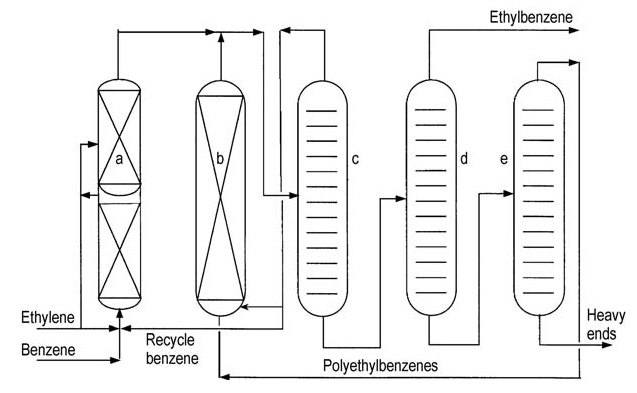
a) Reattore di alchilazione; b) Reattore di transalchilazione; c) Colonna di benzene; d) Colonna di etilbenzene; e) Colonna di polietilbenzene
a) Reattore di alchilazione; b) Reattore di transalchilazione; c) Colonna di benzene; d) Colonna di sfiato gas; e) Colonna di etilbenzene; f) Colonna di polietilbenzene
L’etilene viene introdotto in un reattore a letto fisso multistadio contenente benzene in eccesso. Le temperature del reattore vengono mantenute al di sotto della temperatura critica del benzene (289 °C). Sono necessarie pressioni elevate, intorno ai 4 MPa, per mantenere in soluzione i gas leggeri.
Il benzene in eccesso viene separato dall’effluente del reattore e riciclato allo stadio di alchilazione.
Una serie di colonne di distillazione purifica l’etilbenzene grezzo. La distillazione del benzene rimuove il benzene in eccesso per il riciclo. La distillazione dell’etilbenzene separa il prodotto desiderato, mentre la distillazione del polietilbenzene recupera alchilbenzeni superiori e polietilbenzeni dal residuo.
Gli alchilbenzeni superiori e i polietilbenzeni recuperati vengono immessi in un reattore di transalchilazione per un’ulteriore conversione. Le principali impurità nell’etilbenzene finale possono includere composti non aromatici, toluene e alchilbenzeni superiori, provenienti dai processi di alimentazione o di produzione.
3.4. Produzione di etilbenzene mediante processo a base di zeolite in fase mista
CDTech, una collaborazione tra ABB Lummus Global e Chemical Research and Licensing, ha offerto un processo di produzione di etilbenzene a base di zeolite in fase mista. Il primo impianto commerciale è entrato in funzione nel 1994 e, nel 1999, ne erano operativi tre.
La caratteristica innovativa di questo processo è il reattore di alchilazione, che incorpora un catalizzatore a zeolite in una colonna di distillazione reattiva.
Sia l’etilene (gas) che il benzene (liquido) vengono alimentati alla colonna di distillazione reattiva. Questa capacità consente al processo di utilizzare flussi di etilene diluito prodotti durante la distillazione mediante steam cracker. Questo processo può essere adattato anche per materie prime di etilene di grado polimerico.
Il flusso di processo è illustrato nella Figura 6.
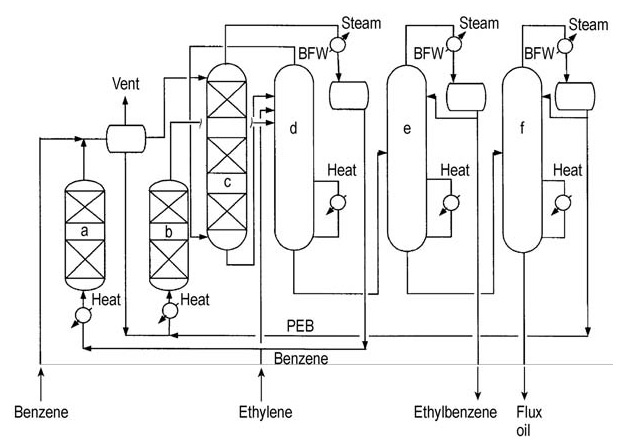
a) Reattore di finitura; b) Transalchilatore; c) Alchilatore; d) Stripper benzene; e) Colonna etilbenzene; f) Colonna polietilbenzene. BFW = acqua di alimentazione caldaia, PEB = polietilbenzene
L’alchilazione e lo strippaggio del benzene avvengono simultaneamente nella stessa colonna di distillazione reattiva. L’etilene non convertito e il benzene in eccesso vengono estratti come prodotti di testa e inviati a un reattore di finitura per ulteriori processi.
L’etilbenzene prodotto viene separato dal flusso di fondo nella colonna di testa. Il residuo rimanente viene ulteriormente processato per recuperare polietilbenzeni transalchilabili.
I polietilbenzeni isolati vengono quindi inviati a un reattore di transalchilazione in fase liquida separato insieme al benzene in eccesso. Il prodotto di questa fase di transalchilazione viene reintrodotto nel treno di frazionamento per ulteriore purificazione.
3.5. Separazione dell’etilbenzene da flussi misti di C8
Meno dell’1% della produzione globale di etilbenzene deriva dalla separazione di flussi misti di C8 aromatici, che in genere avviene contestualmente alla produzione di xilene dal reforming. Sebbene esistano processi di adsorbimento come l’EBEX di UOP, la distillazione rimane il metodo principale per il recupero dell’etilbenzene da questa fonte.
La difficoltà di separare l’etilbenzene da questi flussi richiede un processo noto come superfrazionamento. Introdotto dalla Cosden Oil & Chemical Company nel 1957, prevede una serie di tre colonne di distillazione, ciascuna con oltre 100 stadi.
Diverse unità di superfrazionamento furono costruite negli anni ’60 negli Stati Uniti, in Europa e in Giappone. Tuttavia, l’aumento dei costi energetici e gli elevati costi di costruzione hanno reso questo metodo economicamente non competitivo. Di conseguenza, il superfrazionamento è stato ampiamente abbandonato a favore di metodi più efficienti.
4. Usi dell’etilbenzene
Quasi tutto l’etilbenzene prodotto commercialmente viene utilizzato internamente in raffinerie o impianti chimici per la produzione di stirene monomero, un elemento fondamentale per la produzione di polistirene. In alcuni casi, l’etilbenzene viene coprodotto con ossido di propilene.
Meno dell’1% di etilbenzene viene impiegato come solvente per vernici o come intermedio per la sintesi di dietilbenzene, acetofenone ed etilantrachinone.
5. Tossicologia dell’etilbenzene
L’etilbenzene viene prontamente assorbito in seguito a inalazione, esposizione orale e cutanea. Subisce un metabolismo primario attraverso l’ossidazione della catena laterale, con metaboliti minori derivanti dall’idrossilazione dell’anello aromatico. Meno del 5% viene escreto immodificato nelle urine come 2- e 4-etilfenolo.
I principali metaboliti identificati sono:
- 1-feniletanolo (principale metabolita urinario nei ratti)
- Acido mandelico (principale metabolita urinario nell’uomo)
- Acido fenilgliossilico (principale metabolita urinario nell’uomo)
- Acido benzoico
- Acido fenilacetico (metabolita minore)
Studi sperimentali indicano una bassa tossicità acuta negli animali. I valori di LD50 orale nei ratti variano da 3,5 a 4,7 g/kg di peso corporeo. È stato riportato un valore di LD50 dermico di circa 15 g/kg di peso corporeo.
L’esposizione per inalazione nei ratti ha causato irritazione delle vie respiratorie a partire da 1000 ppm. Concentrazioni più elevate hanno causato instabilità, andatura barcollante e, infine, perdita di coscienza e morte a 5000 ppm. Volontari umani esposti a 25 ppm per 7,5 ore hanno riportato una lieve irritazione delle mucose, che è diventata più pronunciata a 100 ppm.
Il contatto cutaneo ripetuto con etilbenzene non diluito può causare eritema, edema e necrosi superficiale. Effetti simili sono attesi nell’uomo a causa della perdita di grasso cutaneo dovuta a esposizioni ripetute.
Studi che hanno esaminato l’esposizione a dosi ripetute hanno rivelato che effetti avversi significativi negli animali si sono verificati solo a dosi relativamente elevate di etilbenzene.
Non sono stati osservati effetti nei ratti a 100 ppm e nei topi a 500 ppm in uno studio di inalazione della durata di tre mesi; tuttavia, è stato osservato un aumento del peso di polmoni, reni e fegato a partire da 250 ppm nei ratti e 750 ppm nei topi. Non sono state osservate alterazioni istopatologiche.
Studi di inalazione a due anni non hanno mostrato effetti in ratti e topi a 75 ppm. Lievi alterazioni sono state osservate a 250 ppm, con un aumento di tumori epatici e polmonari nei topi e di tumori renali nei ratti maschi a 750 ppm (considerato specifico per i ratti e non rilevante per l’uomo).
Per quanto riguarda la tossicità riproduttiva dell’etilbenzene, sono stati riportati risultati contrastanti in diversi studi. Alcuni studi suggeriscono una potenziale fetotossicità ad alti livelli di esposizione in topi e ratti gravidi, ma non sono stati osservati effetti evidenti nei conigli a 1000 ppm con un’esposizione giornaliera di 7 ore.
Il risultato complessivo dei diversi studi suggerisce che l’etilbenzene non rappresenta un rischio mutageno. I limitati dati in vitro disponibili per la maggior parte dei metaboliti suggeriscono inoltre l’assenza di un chiaro potenziale genotossico.
Uno studio di inalazione a due anni ha mostrato un aumento dell’incidenza di tumori nei ratti maschi (rene), nei topi maschi (polmone) e nelle femmine (fegato) al livello di esposizione più elevato (750 ppm). Non sono stati osservati tumori correlati all’esposizione in uno studio orale condotto su ratti e topi esposti a miscele di xilene contenenti il 17% di etilbenzene.
L’etilbenzene non è genotossico in vivo, il che suggerisce un meccanismo d’azione non genotossico per i tumori osservati nello studio di inalazione ad alto dosaggio. L’aumento della formazione di tumori può essere collegato alla proliferazione cellulare indotta dall’etilbenzene nei reni (ratti) e nei polmoni/fegato (topi).
Sono necessarie ulteriori indagini per determinarne la rilevanza per l’uomo e stabilire un limite di esposizione professionale sicuro.
L’IARC classifica l’etilbenzene come “possibilmente cancerogeno per l’uomo” (Gruppo 2B) a causa di prove sufficienti negli animali e inadeguate nell’uomo.
La Commissione MAK tedesca classifica l’etilbenzene come cancerogeno di categoria 3A sulla base dei dati di cancerogenicità. Sono in attesa di ulteriori dati meccanicistici prima di stabilire un limite di esposizione professionale.
L’ACGIH classifica l’etilbenzene come cancerogeno A3 (“cancerogeno confermato per gli animali con rilevanza sconosciuta per l’uomo”) e raccomanda un TLV-TWA di 100 ppm e un TLV-STEL di 125 ppm. Definisce inoltre un indice di esposizione biologica (BEI) per l’acido mandelico nelle urine di 1,5 g/g di creatinina.
Nell’UE, l’etilbenzene è classificato come “altamente infiammabile” (F) e “nocivo per inalazione” (Xn).
Riferimento
- Ethylbenzene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a10_035.pub2
