Malononitrile: proprietà, reazioni, produzione e usi
Cos’è il malononitrile?
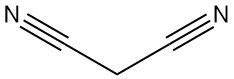
Il malononitrile, noto anche come propandinitrile, dinitrile dell’acido malonico o dicianometano, è un composto organico con formula chimica C3H2N2. È un solido incolore o bianco, un prezioso elemento costitutivo ampiamente utilizzato nella sintesi organica.
Sommario
1. Proprietà fisiche del malononitrile
Il malononitrile forma cristalli incolori solubili in solventi polari come acqua, alcoli inferiori, acetonitrile ed etere dietilico, ma è insolubile in solventi apolari come tetraclorometano, etere di petrolio e xilene.
La conservazione prolungata può indurre un cambiamento di colore, trasformando i cristalli da incolori a gialli o persino marrone scuro senza comprometterne la qualità.
Il malononitrile è tossico se ingerito e può causare gravi irritazioni cutanee e oculari.
Le proprietà fisiche del malononitrile sono elencate nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero di registro CAS | [109-77-3] |
| Formula molecolare | C3H2N2 |
| Massa molecolare | 66,06 g/mol |
| Punto di fusione | 31,6 °C |
| Punto di ebollizione | 218 – 219 °C |
| Densità (20 °C) | 1,19 g/mL |
| Indice di rifrazione (34 °C) | 1,4146 |
| Momento di dipolo (25 °C) | 3,57 D |
| pKa | 11,2 |
| Densità di vapore | 2,3 |
| Pressione di vapore | 0,2 mmHg |
| Punto di infiammabilità | > 86 °C |
| Solubilità (20 °C) in acqua | 133 g/L |
| Solubilità (20 °C) in etere dietilico | 200 g/L |
| Solubilità (20 °C) in etanolo | 400 g/L |
2. Reazioni chimiche del malononitrile
Il malononitrile mostra una reattività versatile grazie alla nucleofilicità dell’anione malononitrile, che può essere ottenuta per deprotonazione con una base debole, e alla natura elettrofila dei suoi gruppi ciano.
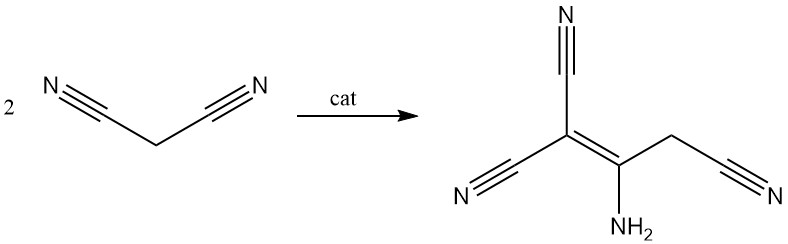
Il malononitrile viene dimerizzato in presenza di una base per produrre 2-ammino-1,1,3-triciano-2-propene.
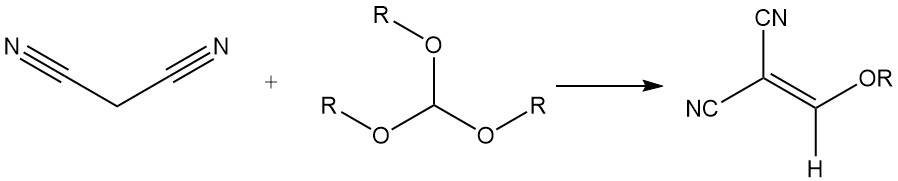
Reagisce con gli ortoformiati di trialchile per produrre alcossimetilenmalomeri, utilizzati per la sintesi dei coloranti stirilici.
È possibile la dialchilazione del malononitrile con alogenuri alchilici e l’acilazione con cloruri/anidridi acide.
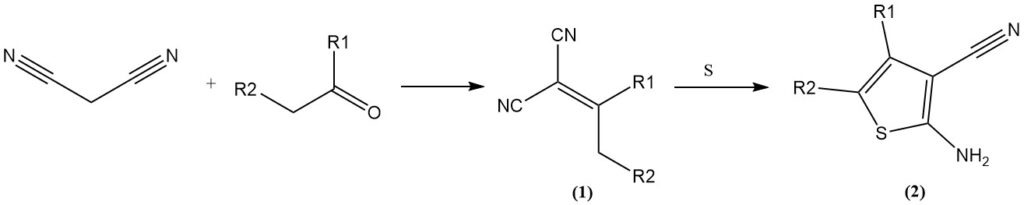
La condensazione di Knoevenagel con aldeidi/chetoni produce ilidene malonitrili (1), che possono subire ulteriori reazioni. Esempi includono la reazione con zolfo elementare (reazione di Gewald) per formare 3-ciano-2-ammino-tiofeni (2) o la cicloaddizione con azidi per produrre tetrazoli.
Il malononitrile reagisce con il bromo per produrre derivati mono- o dibromurati. La decomposizione termica del complesso dibromuro produce tetracianoetilene.
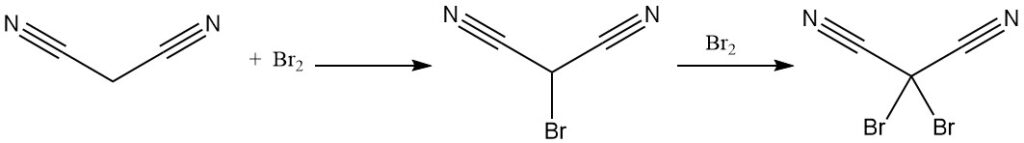
La reazione del dibromomalononitrile con cianuro di potassio produce il sale di potassio del tricianometano, prodotto anche da malononitrile e cloruro di cianogeno. Il tricianometano è utilizzato nella sintesi di liquidi ionici.
La reazione del malononitrile con disolfuro di carbonio in presenza di una base produce sali di (dimercaptometilene)malonitrile, un precursore degli antimicrobici. La dimetilazione produce un altro importante elemento costitutivo degli eterocicli.
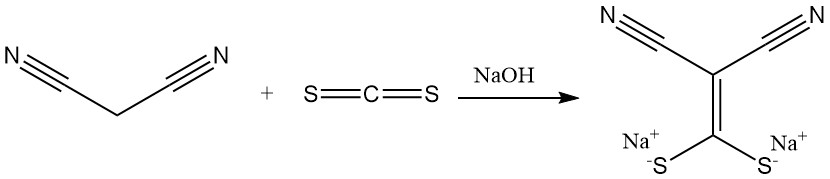
La cianotioacetamide viene preparata per reazione con acido solfidrico.
Le reazioni acido-catalizzate del malononitrile con alcoli generano imidati (3), che sono materiali di partenza per eterocicli azotati come le 4,6-dimetossipirimidine (4) o le bis(ossazoline) (5).
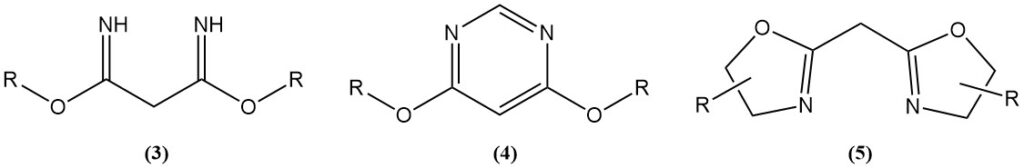
Le bis(ossazoline) sono prodotte mediante reazioni di tipo Ritter o utilizzando un catalizzatore. Le bis(ossazoline) sintetizzate da malononitrile o suoi derivati e gli amminoalcoli chirali sono utilizzati come ligandi in reazioni asimmetriche catalizzate da metalli di transizione.
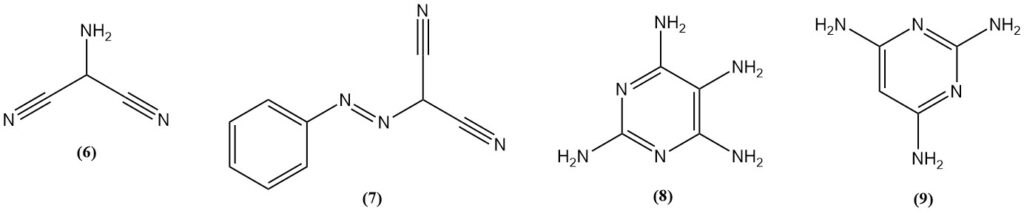
Il 2-amminomalononitrile (6) si ottiene per nitrosazione del malononitrile, seguita da idrogenazione o riduzione del (fenilazo)malononitrile (7). L’amminomalononitrile reagisce con la guanidina per produrre 2,4,5,6-tetraamminopirimidina (8).
La 2,4,6-triaminopirimidina (9) può essere preparata dalla reazione di malononitrile e guanidina, mentre la 2,4,6-triaminopirimidina è prodotta dalla formamidina.
3. Produzione del malononitrile
Fino agli anni ’70, il malononitrile veniva prodotto tramite un processo discontinuo mediante disidratazione della cianoacetamide utilizzando pentacloruro di fosforo o ossicloruro di fosforo. Questo metodo, sebbene documentato da brevetti anche di recente, non è più utilizzato commercialmente, se non in alcuni impianti cinesi di piccole dimensioni.
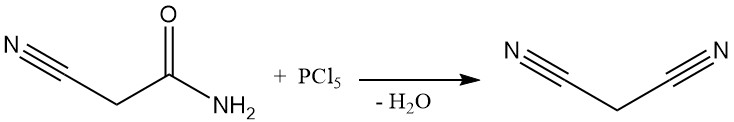
Il metodo industriale dominante oggi per la sintesi del malononitrile è una reazione continua ad alta temperatura tra acetonitrile e cloruro di cianogeno. Questo processo utilizza un reattore tubolare che opera a temperature superiori a 700 °C e raggiunge una conversione quasi completa in un singolo passaggio, producendo malononitrile.
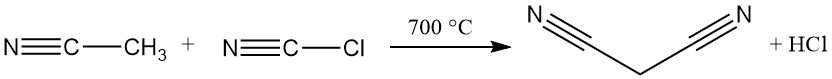
Acetonitrile in eccesso, acido cloridrico e tracce di acido maleico, succinico e fumarico sono presenti insieme al prodotto desiderato come impurità.
Il prodotto in uscita dal reattore viene rapidamente raffreddato per interrompere la reazione e separare l’acido cloridrico gassoso, che viene poi recuperato tramite lavaggio. L’acetonitrile in eccesso viene rimosso tramite una combinazione di distillazione sotto vuoto ed evaporazione a film sottile, consentendone il riciclo con una contaminazione minima.
La separazione degli acidi maleico e fumarico dal malononitrile grezzo è impraticabile a causa dei loro punti di ebollizione simili. Pertanto, queste impurità vengono convertite in composti a punto di ebollizione più alto attraverso una reazione di Diels-Alder in un reattore separato. Infine, due distillazioni sotto vuoto rimuovono questi sottoprodotti, ottenendo una resa del 66% di malononitrile rispetto a entrambi i materiali di partenza.
Il primo impianto industriale che utilizza questo processo fu realizzato nel 1973 da Lonza a Visp, in Svizzera.
Sebbene siano stati proposti metodi alternativi per la produzione di malononitrile, come quelli che utilizzano cianoacetati, malonati o reazioni con ammoniaca e vari catalizzatori, nessuno di questi metodi è attualmente impiegato su scala industriale.
4. Usi del malononitrile
Il malononitrile è ampiamente utilizzato come materia prima nella produzione di vitamine, prodotti agrochimici, prodotti farmaceutici e coloranti.
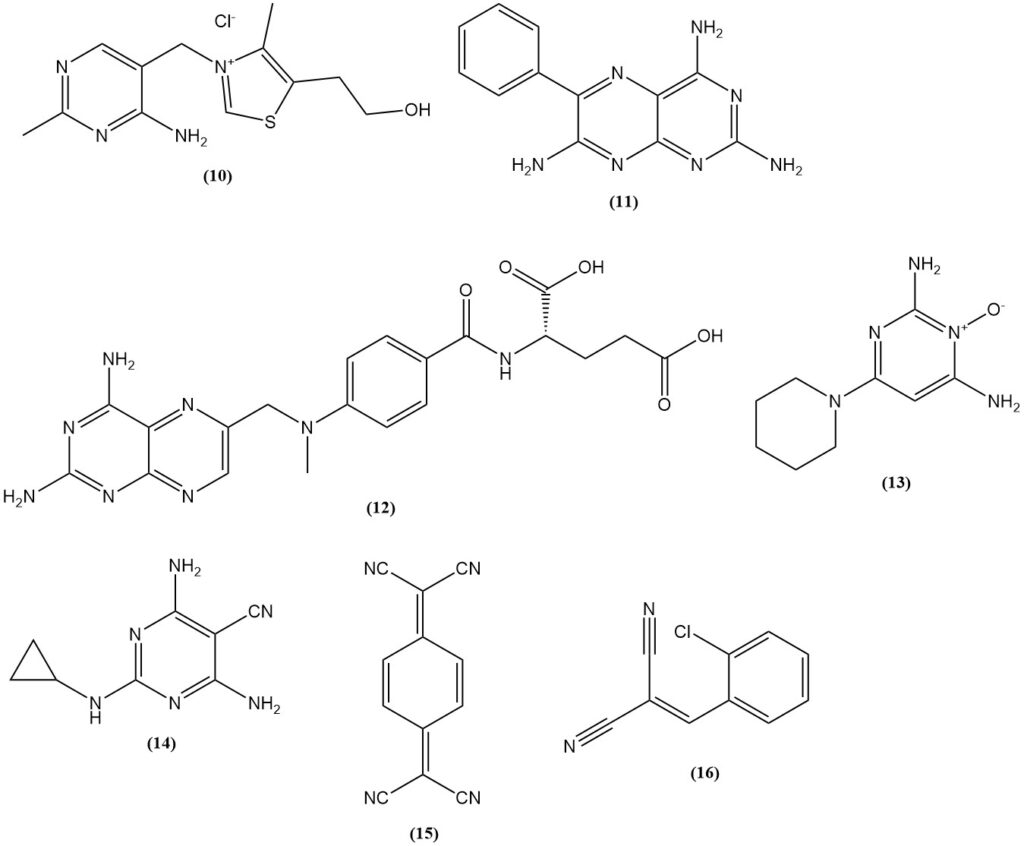
Il malononitrile è utilizzato nella sintesi di tiamina (10) (vitamina B1), erbicidi solfonilurei a base di 2-ammino-4,6-dimetossipirimidina, come benzsulfuron-metile e halosulfuron-metile, e prodotti farmaceutici (il diuretico triamterene (11), l’antagonista dell’acido folico metotrexato (12), l’antipertensivo minoxidil (13) e il pesticida diciclanile (14)).
Esempi di coloranti e pigmenti prodotti a partire dal malononitrile includono coloranti gialli metinici con un gruppo N,N-dialchilaminoarilico (amminoarilneutrocianine) come il C.I. Disperse Yellow 90; coloranti blu amminoarilneutrocianine come il C.I. Disperse Blue 354; e acido 1,4,5,8-naftalenetetracarbossilico, precursore dei pigmenti perinonici.
Viene utilizzato anche nella produzione di conduttori elettrici come i sali a trasferimento di carica del 7,7,8,8-tetracianochinodimetano (15) (TCNQ) e il gas lacrimogeno (o-clorobenzilidene)malonitrile (16), che può essere prodotto dalla condensazione di o-clorobenzaldeide con malononitrile.
5. Tossicologia del malononitrile
Il malononitrile può causare grave irritazione oculare nei conigli in caso di esposizione a 5 mg per 24 ore.
Il malononitrile è altamente tossico per varie vie, con valori di LD50 orale che vanno da 14 mg/kg a 69,8 mg/kg nei ratti. Gli effetti comuni includono convulsioni, debolezza muscolare, depressione respiratoria e alterazioni comportamentali.
Anche il contatto cutaneo con il malononitrile può essere letale nei ratti a dosi di 350 mg/kg. I dati disponibili suggeriscono potenziali effetti su vari organi, tra cui polmoni, sangue e sistema nervoso.
L’esposizione orale ripetuta nei ratti a dosi inferiori (285 mg/kg/19 settimane) può causare alterazioni epatiche e ponderali.
Esistono limiti di esposizione professionale per regolamentare le concentrazioni di malononitrile nell’aria del luogo di lavoro (ad esempio, livello di esposizione raccomandato dal NIOSH: 3 ppm).
Riferimenti
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Malononitrile
- https://www.cdc.gov/niosh-rtecs/OO3010B0.html
