Acido Propionico: Proprietà, Reazioni, Produzione e Usi
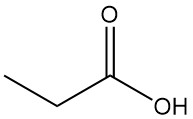
Cos’è l’acido propionico?
L’acido propionico, noto anche come acido propanoico, è un acido carbossilico a catena corta naturale con formula CH3CH2COOH. È un liquido incolore dall’odore pungente, spesso descritto come simile al sudore o al formaggio.
L’acido propionico è stato descritto per la prima volta da J. Gottlieb nel 1844 e classificato come acido grasso da J.J. Dumas nel 1848. Il suo nome deriva dalle parole greche “protos” (primo) e “pion” (grasso), a riflettere la sua posizione come primo acido grasso isolabile da una soluzione acquosa mediante salatura.
L’acido propionico esiste in natura, principalmente come esteri negli oli essenziali. Può anche formarsi come acido libero attraverso vari processi enzimatici e di fermentazione. È un prodotto della fermentazione anaerobica dei carboidrati nello stomaco dei ruminanti. I derivati dell’acido propionico sono usati come intermedi in diversi cicli fisiologici.
L’acido propionico è usato nella produzione di esteri di cellulosa, dispersioni di plastica ed erbicidi, e trova un uso limitato in prodotti farmaceutici, aromi e fragranze.
È anche usato come conservante alimentare per le sue proprietà fungicide e battericide, e viene sempre più usato per prevenire muffe e deterioramento batterico nei cereali foraggeri, nei mangimi per animali, nei prodotti da forno e nei formaggi.
Sommario
1. Proprietà fisiche dell’acido propionico
L’acido propionico è un liquido incolore dall’odore pungente. L’acido propionico solido cristallizza nel sistema monoclino e si espande del 12,2% in volume quando fuso. Similmente ai suoi omologhi inferiori, acido acetico e acido formico, una porzione significativa delle molecole di acido propionico dimerizza sia nella fase liquida che in quella gassosa.
L’acido propionico è miscibile con acqua e la maggior parte dei solventi organici in tutte le proporzioni. Forma miscele azeotropiche con vari liquidi, tra cui acqua (82,3% in peso di acqua, punto di ebollizione 99,98 °C a 101,3 kPa).
Le tabelle 1, 2 e 3 forniscono dati dipendenti dalla temperatura per l’acido propionico, tra cui rispettivamente pressione di vapore, densità e viscosità dinamica.
| Temperatura (°C) | Pressione (kPa) |
|---|---|
| 0,7 | 0,1 |
| 13,5 | 0,25 |
| 24,0 | 0,5 |
| 35,0 | 1,0 |
| 50,8 | 2,5 |
| 64,5 | 5,0 |
| 79,3 | 10,0 |
| 100,9 | 25 |
| 120,1 | 50 |
| 140,9 | 100 |
| 159,5 | 200 |
| 185,7 | 500 |
| 203,0 | 1000 |
| 219,7 | 2000 |
| Temperatura (°C) | Densità (g/cm³) |
|---|---|
| -20 | 1,038 |
| -10 | 1,027 |
| 0 | 1,016 |
| 10 | 1,005 |
| 20 | 0,9935 |
| 30 | 0,9827 |
| 40 | 0,9719 |
| 50 | 0,9611 |
| 60 | 0,9503 |
| 70 | 0,9395 |
| 80 | 0,9286 |
| 90 | 0,9176 |
| 100 | 0,9066 |
| 110 | 0,8954 |
| 120 | 0,8841 | 130 | 0,8726 |
| 140 | 0,8609 |
| 150 | 0,849 |
| 160 | 0,8367 |
| 170 | 0,8241 |
| Temperatura (°C) | Viscosità (mPa·s) |
|---|---|
| 0 | 154,1 |
| 20 | 109,4 |
| 50 | 73,8 |
| 100 | 45,0 |
| 150 | 31,0 |
Altre proprietà fisiche dell’acido propionico sono elencate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| CAS | [79-09-4] |
| Formula | CH3CH2COOH |
| Peso molecolare | 74,08 g/mol |
| Punto di fusione | -20,8 °C |
| Punto di ebollizione | 141,3 °C |
| Indice di rifrazione | 1,3865 |
| Tensione superficiale verso l'aria a 20 °C | 26,7 × 10-3 N/m |
| Tensione superficiale verso l'aria a 90 °C | 19,7 × 10-3 N/m |
| Conduttività termica a 0 °C | 153 W m-1 K-1 |
| Conduttività termica a 20 °C | 150 W m-1 K-1 |
| Conduttività termica a 50 °C | 144 W m-1 K-1 |
| Conduttività termica a 100 °C | 136 W m-1 K-1 |
| Conduttività elettrica a 2 °C | 10-4 μS/cm |
| Costante dielettrica dinamica a 10 °C | 3,30 |
| Costante dielettrica dinamica a 40 °C | 3,44 |
| Momento di dipolo elettrico, μ | 1,75 D ± 5% |
| Costante di dissociazione in H2O a 0 °C | 1,274 × 10-5 mol/L |
| Costante di dissociazione in H2O a 20 °C | 1,338 × 10-5 mol/L |
| Costante di dissociazione in H2O a 40 °C | 1,284 × 10-5 mol/L |
| Costante di dissociazione in H2O a 60 °C | 1,160 × 10-5 mol/L |
| Potenziale di ionizzazione | 10,24 ± 0,03 eV |
| Calore di fusione | 101,65 kJ/kg |
| Calore di vaporizzazione | 418,7 kJ/kg |
| Calore di formazione | -164,5 kJ/mol |
| Calore di combustione | -1528,3 kJ/mol |
| Calore specifico (liquido), a 0 °C | 2,077 kJ kg-1 K-1 |
| Calore specifico Calore (Liquido), a 50 °C | 2,299 kJ kg-1 K-1 |
| Calore specifico (Liquido), a 100 °C | 2,516 kJ kg-1 K-1 |
| Calore specifico (Vapore), a 100 °C | 2,823 kJ kg-1 K-1 |
| Calore specifico (Vapore), a 200 °C | 3,245 kJ kg-1 K-1 |
| Calore specifico (vapore), a 300 °C | 3,647 kJ kg-1 K-1 |
| Compressibilità isentropica a 20 °C | 0,750 GPa |
| Temperatura critica | 338,9 °C |
| Pressione critica | 5,37 MPa |
| Volume critico | 0,322 kg/L |
| Punto di infiammabilità | 50 °C |
| Temperatura di accensione | 485 °C |
| Limiti di esplosione in aria a 20 °C | 2,1–12,0 vol% |
2. Reazioni dell’acido propionico
L’acido propionico è il terzo membro della serie degli acidi monocarbossilici alifatici, che ha la reattività caratteristica di questi acidi. Forma facilmente sali, ammidi, alogenuri acidi e anidridi.
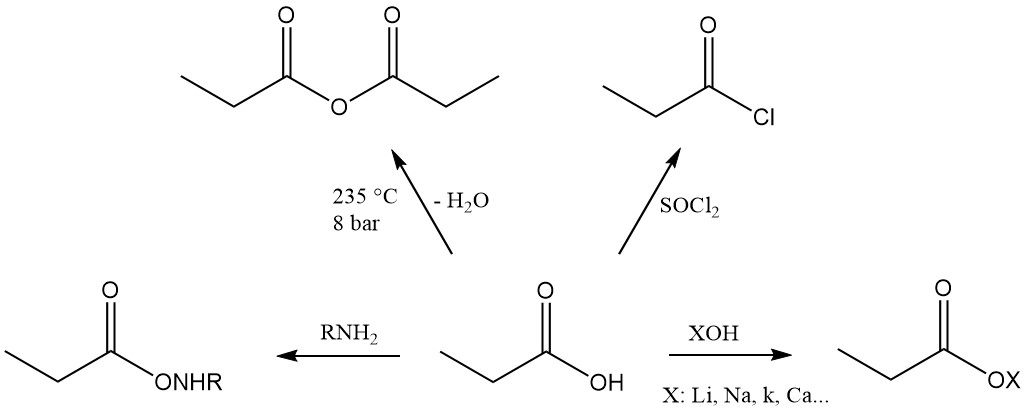
Gli esteri dell’acido propionico si formano per reazione con alcoli e olefine, mentre la reazione con acetileni produce i corrispondenti esteri vinilici.
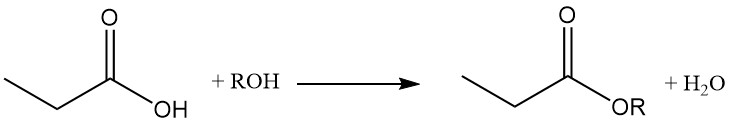
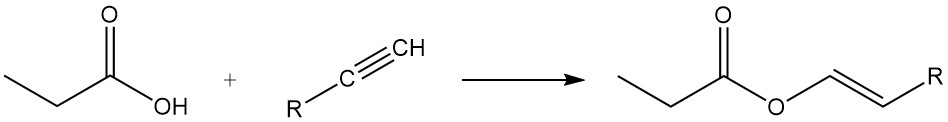
La reattività dell’acido propionico è diversa da quella dell’acido acetico a causa dell’effetto induttivo del gruppo metilenico. Ciò rende l’acido propionico più suscettibile all’attacco da parte di soluzioni di permanganato alcalino rispetto all’acido acetico. Il processo di degradazione non è selettivo, con conseguente miscela di anidride carbonica, acido ossalico e acido lattico.
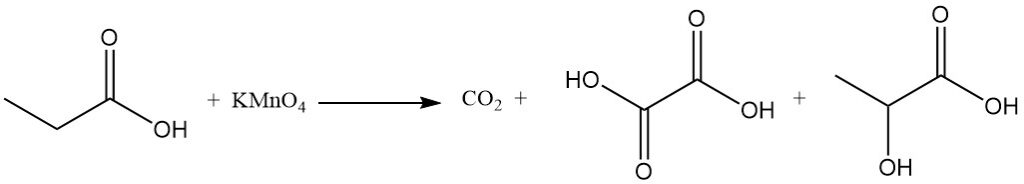
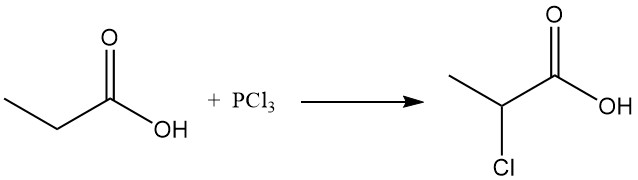
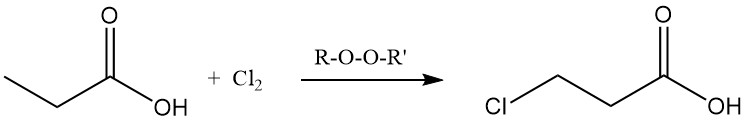
Anche le reazioni di sostituzione ionica mostrano una preferenza per il gruppo metilenico. La clorurazione mediante reagenti di trasferimento di alogeni, come PCl3, porta alla formazione di acido α-cloropropionico, mentre la clorurazione radicalica indotta da perossidi o radiazioni UV produce acido β-cloropropionico. Entrambi i prodotti sono utilizzati come intermedi nella produzione di erbicidi e prodotti farmaceutici.
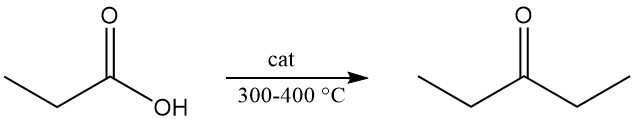
La decomposizione termica del propionato di calcio o del vapore dell’acido propionico fatto passare sugli ossidi metallici a 300–400 °C produce dietilchetone, un solvente industriale ampiamente utilizzato.
3. Produzione industriale di acido propionico
L’acido propionico è prodotto industrialmente dalla carbonilazione dell’etilene o dall’ossidazione del propanale.
Può anche essere prodotto come sottoprodotto dalla sintesi del sale di idrossilammina da 1-nitropropano, dalla distillazione del legno, dall’ossidazione con acido nitrico di 1-propanolo, dalla fusione alcalina di miscele di n-propanolo e isopropanolo e dalla carbonilazione di etanolo e acido acetico. Tuttavia, tutti questi metodi sono obsoleti.
Altre fonti potenziali, ma economicamente non praticabili, di acido propionico includono:
- Formazione di sottoprodotti: l’acido propionico può essere formato come sottoprodotto durante processi come la carbonilazione del metanolo e l’ossidazione del n-butene, ma la resa è relativamente bassa.
- Reazione diretta dell’etilene: la reazione diretta di etilene, monossido di carbonio e acqua su catalizzatori specifici ha potenziale ma non è ancora competitiva.
- Processi C1: sono state descritte reazioni in due fasi che utilizzano gas di sintesi e catalizzatori al rodio per la produzione di acido propionico, ma l’attuale disponibilità di risorse le rende meno interessanti.
Per applicazioni che richiedono acido propionico “naturale”, in particolare in aromi e fragranze, sono stati sviluppati processi microbiologici ed enzimatici basati sulla fermentazione di amido o zuccheri. Tuttavia, l’elevato costo di produzione ne limita l’uso ad applicazioni specializzate.
3.1. Produzione di acido propionico mediante carbonilazione di etilene (processo BASF)
Il processo BASF per la produzione di acido propionico utilizza la sintesi di Reppe. Questa reazione comporta la reazione di etilene con monossido di carbonio e acqua ad alta pressione, utilizzando Ni(CO)4 come catalizzatore.
C2H4 + CO + H2O → CH3CH2COOH
Questo processo offre diversi vantaggi, come bassi costi delle materie prime, elevata conversione e resa di acido propionico e una semplice procedura di lavorazione.
Una semplice descrizione del processo industriale è mostrata nella Figura 1.
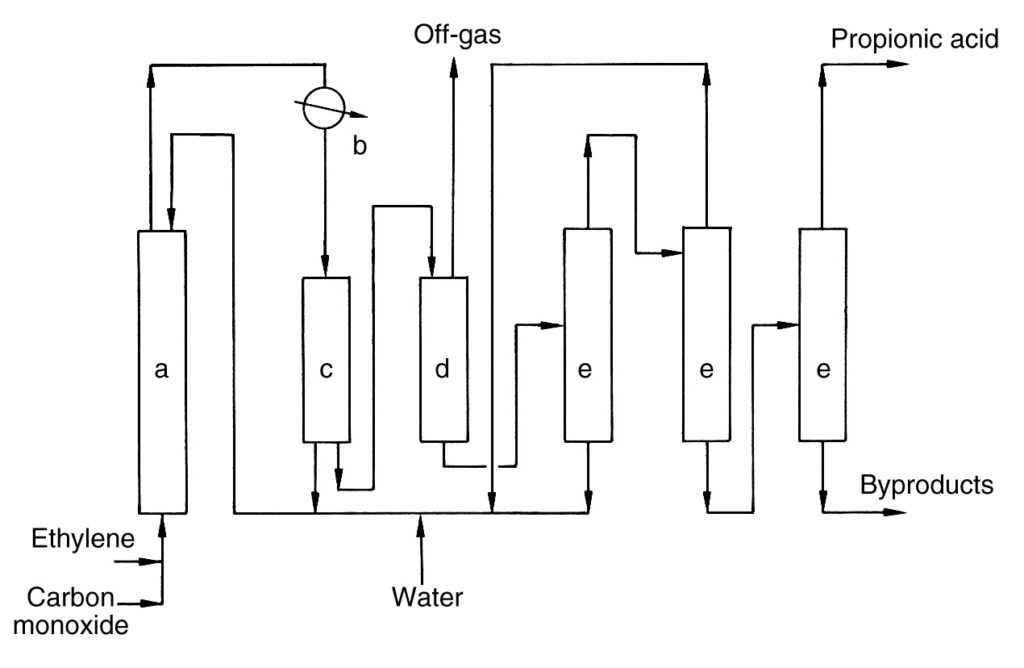
a) Reattore ad alta pressione; b) Scambiatore di calore; c) Separatore; d) Vaso di espansione; e) Colonna di distillazione
L’etilene e il monossido di carbonio vengono compressi e immessi in continuo insieme a un flusso di riciclo nel reattore ad alta pressione (a). La reazione procede a 100-300 bar e 250-320 °C. L’acido propionico grezzo viene formato ed estratto dalla testa del reattore.
Il prodotto grezzo viene raffreddato in uno scambiatore di calore (b), generando vapore. Una parte del prodotto raffreddato viene riciclata nel reattore (c) per il controllo della temperatura, mentre il flusso principale viene depressurizzato (d).
Il flusso depressurizzato si separa in un flusso di gas di scarico e un flusso di acido grezzo. Il catalizzatore al nichel viene recuperato dal gas di scarico e riciclato nuovamente nel reattore. Il gas di scarico viene incenerito con recupero di calore.
L’acido grezzo viene disidratato e ulteriormente purificato tramite più colonne di distillazione (e). I sali di nichel formati durante il processo vengono riciclati. La distillazione finale produce acido propionico puro e il residuo del prodotto viene rimosso dal processo.
Si dice che l’acido borico migliori la velocità di reazione e impedisca la precipitazione del sale catalizzatore.
3.2. Produzione di acido propionico mediante ossidazione del propanale
L’acido propionico viene prodotto commercialmente mediante ossidazione del propanale. Questo processo prevede due fasi: produzione del propanale e carbonilazione catalizzata.
Il propanale si forma come intermedio durante la produzione di n-propanolo mediante idroformilazione dell’etilene. A differenza delle aldeidi superiori, non si formano miscele di isomeri n/iso. Viene prodotto industrialmente mediante carbonilazione catalizzata da cobalto ad alta pressione o mediante carbonilazione catalizzata da rodio/iridio a bassa pressione.
Il propanale prontamente ottenuto viene quindi ossidato selettivamente ad acido propionico in condizioni miti (40–50 °C).
Questo metodo in due fasi garantisce l’uso di impianti esistenti sia per la produzione del propanale che per la successiva ossidazione. Aziende come Dow (ex Union Carbide) ed Eastman negli Stati Uniti utilizzano questo metodo per la produzione di acido propionico.
3.3. Produzione di acido propionico mediante ossidazione diretta di idrocarburi
Storicamente, una parte significativa di acido propionico veniva prodotta mediante ossidazione diretta di idrocarburi, principalmente nafta. Questo processo, utilizzato principalmente per la produzione di acido acetico, generava anche acido formico, acido propionico, una miscela di isomeri di acido butirrico e metil etil chetone come sottoprodotti.
Sebbene questo metodo offrisse vantaggi in termini di costo delle materie prime, il processo presentava sfide significative:
- Miscela di prodotti complessa: il processo di ossidazione produceva una miscela complessa di vari acidi organici, che richiedeva un processo di separazione sofisticato e costoso.
- Controllo limitato del prodotto: le condizioni di reazione offrivano un controllo minimo sui rapporti specifici dei prodotti formati, rendendo difficile adattarsi alle mutevoli richieste del mercato.
- Elevato consumo di energia: il processo di separazione associato a questa tecnologia comporta un elevato consumo di energia.
Questi inconvenienti hanno portato infine al completo abbandono di questa tecnologia. Entro il 2009, tutti gli impianti operativi che utilizzavano questo processo erano stati chiusi, l’ultimo dei quali era l’impianto Celanese a Pampa, Texas.
Una descrizione del processo BP Chemicals (Figura 2), un esempio storico di ossidazione diretta degli idrocarburi, è fornita a scopo di riferimento.
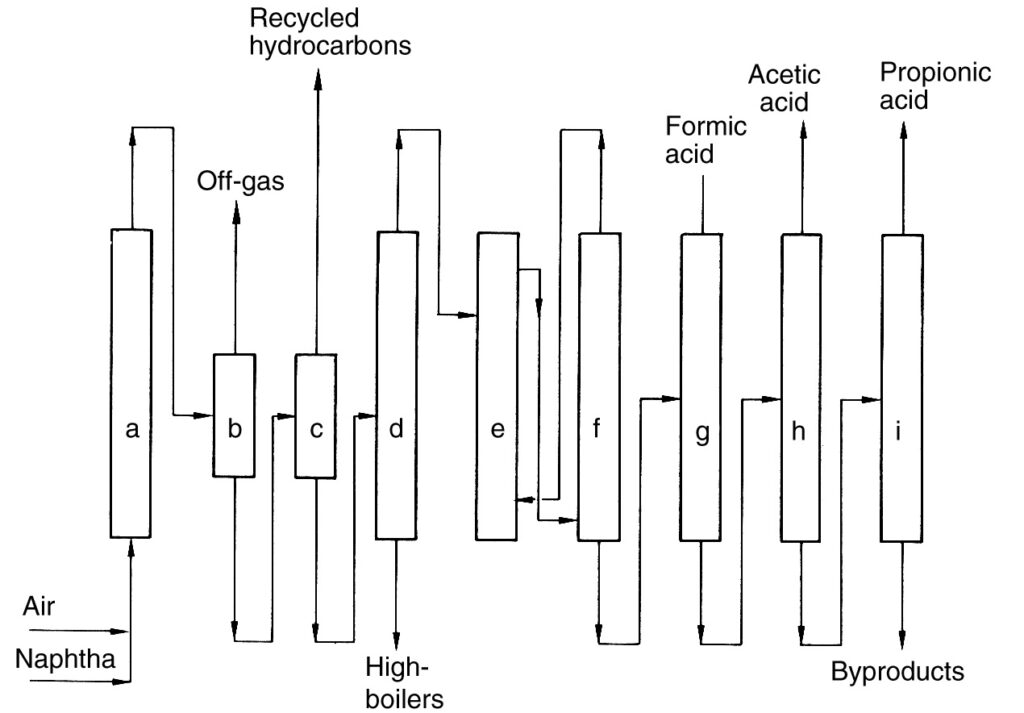
a) Reattore; b) Separatore gas-liquido; c) Separatore liquido-liquido; d) Colonna di distillazione; e) Estrazione; f) Separazione dell'agente di estrazione; g) Distillazione dell'acido formico; h) Distillazione dell'acido acetico; i) Distillazione dell'acido propionico
In questo processo, la nafta è stata preriscaldata e poi ossidata con aria a pressione elevata (40-45 bar) all’interno di una serie di reattori (a). La reazione ha generato calore, che è stato utilizzato per la produzione di vapore.
L’effluente raffreddato del reattore è stato separato dal gas di scarico della reazione in un separatore (b). Il liquido recuperato è stato riciclato nei reattori, mentre il gas di scarico è stato incenerito. Il prodotto liquido rimanente è stato quindi separato in una fase organica (idrocarburi non reagiti) e una fase acquosa contenente la miscela di prodotti (c). Gli idrocarburi non reagiti sono stati riciclati.
La fase acquosa è stata sottoposta a separazione dei componenti basso e altobollenti, seguita da disidratazione per estrazione (e) per ottenere l’acido grezzo. Infine, sono stati utilizzati i passaggi di distillazione frazionata (g)–(i) per isolare gli acidi carbossilici da C1 a C4.
3.4. Produzione di acido propionico mediante fermentazione
Mentre i processi petrolchimici dominano la produzione industriale di acido propionico, la fermentazione mediante specie di Propionibacterium offre un’alternativa di origine biologica. Questi batteri gram-positivi, non mobili e a forma di bastoncino sono generalmente riconosciuti come sicuri (GRAS), rendendo l’acido propionico risultante adatto ad applicazioni come alimenti, mangimi, prodotti farmaceutici e cosmetici.
I propionibatteri utilizzano il percorso dell’acido dicarbossilico per convertire il glucosio (o altre fonti di carbonio) in acido propionico. Questo percorso coinvolge il piruvato come intermedio chiave. Il piruvato può essere carbossilato ad ossalacetato, portando alla biosintesi dell’acido propionico, o decarbossilato ad acetil-CoA, portando alla biosintesi dell’acido acetico.
La coproduzione di acido propionico e acetico mantiene l’equilibrio redox.
Teoricamente, 1,5 moli di glucosio possono produrre 2 moli di propionato, 1 mole di acetato e 1 mole di CO2 attraverso il percorso Embden-Meyerhof-Parnas (EMP). Ciò si traduce in una resa massima di acido propionico di 0,548 g/g di glucosio e un rapporto acido propionico-acido acetico di 2.
Il percorso del pentoso fosfato (HMP) può portare a rese di acido propionico più elevate (fino a 0,68 g/g) con meno acido acetico prodotto. L’acido succinico è un sottoprodotto comune in questo processo.
La resa effettiva di acido propionico dipende fortemente dal substrato scelto e dalle condizioni di fermentazione.
La fermentazione dell’acido propionico avviene in genere in condizioni anaerobiche (spurgato con azoto gassoso) a 30-32 °C e pH 6,0-7,0. Il mezzo di fermentazione richiede un tampone (ad esempio, CaCO3) o l’aggiunta di una base (ad esempio, idrossido di ammonio) per neutralizzare gli acidi prodotti, poiché la crescita dei propionibatteri cessa al di sotto del pH 4,5.
Il mezzo in genere include una fonte di carbonio (ad esempio, glucosio), una fonte di azoto (ad esempio, ammoniaca), minerali e vitamine. I propionibatteri possono utilizzare varie fonti di carbonio, tra cui zuccheri, lattato, glicerolo e sorbitolo.
I processi industriali spesso impiegano materie prime a basso costo come permeato di siero di latte, melassa o glicerolo di scarto del biodiesel, integrati con fonti di azoto come l’estratto di lievito.
L’acido propionico stesso agisce come inibitore della fermentazione, riducendo i tassi di crescita e produzione a concentrazioni superiori a 10 g/L. I processi di fermentazione convenzionali solitamente impiegano 3 giorni per raggiungere circa 20 g/L di acido propionico con una resa di 0,4 g/g di glucosio o inferiore.
Ricerche approfondite si sono concentrate sul miglioramento della resa, della concentrazione e del tasso di produzione attraverso lo sviluppo di ceppi e l’ottimizzazione dei processi.
4. Usi dell’acido propionico
4.1. Usi dell’acido propionico come conservante per alimenti e mangimi
L’acido propionico e i suoi sali (propionati) sono ampiamente utilizzati come conservanti grazie alla loro capacità di inibire batteri, funghi, insetti, virus e acari.
L’esatto meccanismo d’azione è ancora in fase di studio, ma si ritiene che la forma non dissociata dell’acido propionico (dominante a pH acido) sia responsabile dell’effetto conservante. Questa forma penetra nelle cellule come un nutriente e interrompe gli enzimi essenziali del metabolismo dei carboidrati.
I propionati richiedono l’idrolisi per rilasciare la forma acida attiva, rendendoli più lenti e meno efficaci dell’acido propionico stesso.
L’acido propionico mostra un ampio spettro di attività contro vari microrganismi, con una concentrazione minima inibitoria (MIC) dello 0,05-0,50% in peso contro i funghi, dello 0,25-0,50% in peso contro i batteri e dello 0,10-1,0% in peso contro i lieviti.
È efficace contro le muffe deterioranti negli alimenti e nei mangimi e più efficace contro i batteri Gram-negativi (ad esempio, E. coli, Salmonella). Inoltre, inattiva virus come il virus Vaccinia a concentrazioni superiori all’1,0% in peso e uccide acari e coleotteri del mais nei cereali.
L’acido propionico ha un odore forte, che ne limita l’uso nella conservazione degli alimenti. I propionati (sali di calcio, sodio e ammonio) sono preferiti negli alimenti per il loro sapore e odore quasi neutri.
Entrambe le forme sono utilizzate nella conservazione dei mangimi, con gli animali che spesso preferiscono il sapore acido dei mangimi conservati con acido propionico.
L’acido propionico e i suoi sali sono generalmente riconosciuti come sicuri (GRAS) per varie applicazioni alimentari negli Stati Uniti e in Europa. La FAO/OMS non ha limitazioni specifiche per la loro assunzione giornaliera.
4.2. Altri usi
L’acido propionico è utilizzato in altri settori quali gomma, polimeri, solventi, aromi, fragranze, prodotti farmaceutici ed erbicidi.
Propionati di zinco, cadmio, piombo e mercurio possono essere utilizzati come regolatori di vulcanizzazione, influenzando il processo di rafforzamento della gomma durante la produzione.
L’acido propionico è utilizzato come intermedio, spesso nella sua forma di anidride, per la produzione di esteri preziosi come il propionato di acetato di cellulosa e il propionato di vinile.
I propionati di metile, etile, propile e butile sono utilizzati come solventi per resine e vernici e vari esteri propionati possiedono aromi fruttati caratteristici, rendendoli ingredienti preziosi nelle formulazioni di aromi e fragranze.
Piccole quantità di acido propionico vengono convertite in cloruro di propionile, una molecola reattiva utilizzata per introdurre il “gruppo propionile” durante la sintesi di alcuni prodotti farmaceutici.
Fino alla fine degli anni ’80, una parte significativa di acido propionico veniva utilizzata per produrre erbicidi clorurati. Tuttavia, lo sviluppo di erbicidi più potenti e versatili ha portato a un declino in questa applicazione.
5. Tossicologia dell’acido propionico
L’acido propionico mostra una bassa tossicità acuta e viene rapidamente metabolizzato nel corpo. Tuttavia, ha effetti irritanti/corrosivi sulla pelle e sugli occhi. L’esposizione cronica ad alte concentrazioni può causare cambiamenti locali nell’epitelio del prestomaco di alcune specie animali.
L’acido propionico, o la sua forma attivata, il propionil-CoA, è un intermedio naturale nel metabolismo umano. Viene prontamente assorbito e metabolizzato dal fegato.
L’acido propionico ha una bassa tossicità orale e per inalazione. I propionati di sodio e calcio sono ancora meno tossici. Il contatto con la pelle può causare irritazione o corrosione.
L’esposizione a lungo termine ad alte concentrazioni (>0,4%) nei ratti può causare cambiamenti nel rivestimento del prestomaco. Tuttavia, i cani beagle, che non hanno un prestomaco, non hanno mostrato questi effetti.
Gli studi non hanno mostrato alcuna prova che l’acido propionico o i propionati causino mutazioni genetiche. Gli studi su animali in gravidanza non hanno rivelato alcuna anomalia dello sviluppo causata dall’esposizione all’acido propionico.
Studi limitati sull’uomo suggeriscono che l’acido propionico è ben tollerato per via orale a basse dosi. Le soluzioni di propionato di sodio sono state utilizzate in modo sicuro per il trattamento degli occhi.
Riferimento
- Propionic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a22_223.pub4
