Trimethylamin: Eigenschaften, Reaktionen, Herstellung und Verwendung
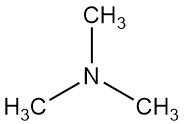
Trimethylamin ist eine organische Verbindung mit der Formel N(CH3)3. Es ist ein farbloses Gas oder eine komprimierte Flüssigkeit mit einem starken Fischgeruch in geringen Konzentrationen. Bei höheren Konzentrationen wird der Geruch ammoniakartiger.
Trimethylamin ist eine natürlich vorkommende Verbindung, die in geringen Mengen in vielen Pflanzen und Tieren vorkommt. Es entsteht auch durch den Abbau organischer Stoffe wie Fisch und andere Meeresfrüchte. Im menschlichen Körper wird es von den Darmbakterien beim Abbau bestimmter Nahrungsmittel produziert.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Trimethylamin
Trimethylamin hat einen stärkeren Fischgeruch als die anderen Methylamine (Methylamin und Dimethylamin). Die menschliche Nase kann Trimethylamin in einer geringen Konzentration von <10 ppb erkennen, das bei der Zersetzung von Pflanzen und Tieren entsteht.
Kristallines Hydrat (CH3)3N·10 H2O entsteht durch Abkühlen gesättigter wässriger Lösungen von Trimethylamin. Bei Atmosphärendruck bildet es mit Ammoniak und anderen Methylaminen niedrigsiedende Azeotrope.
Triethylamin ist in verschiedenen organischen Lösungsmitteln löslich, darunter Methanol und Ethanol , Dimethylformamid und Ethylenglykol sowie deren wässrige Lösungen können viele anorganische und organische Verbindungen lösen.
Einige physikalische Eigenschaften von Trimethylamin sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht, g/mol | 59.11 |
| Siedepunkt (101,33 kPa), °C | 2,8 |
| Schmelzpunkt, °C | -117.1 |
| Dichte (bei 25 °C, flüssig), g/cm3 | 0,6331 |
| pKa (bei 25 °C) | 9,80 |
| Brechungsindex bei 0 °C | 1,3631 |
| Oberflächenspannung (25 °C), 10-3 N/m | 13.47 |
| Verdampfungswärme bei 25 °C, kJ/mol | 22.864 |
| Verdampfungswärme am Siedepunkt, kJ/mol | 27.708 |
| Schmelzwärme, kJ/mol | 6.548 |
| Standardbildungswärme bei 25 °C (Flüssigkeit), kJ/mol | -45,80 |
| Standardbildungswärme bei 25 °C (Gas), kJ/mol | -23,86 |
| Verbrennungswärme, Standardzustand bei 25 °C, Flüssigkeit, kJ/mol | -2422,60 |
| Wärmekapazität, ideales Gas (25 °C), J K-1 mol-1 | 91,8 |
| Kritische Temperatur, °C | 160,1 |
| Kritischer Druck, MPa | 4.07 |
| Dielektrizitätskonstante (25 °C), Flüssigkeit | 2,44 |
| Dipolmoment in Benzol (25 °C), D | 0,87 |
| Flammpunkt (geschlossener Tiegel), °C | -71 |
| Zündtemperatur in Luft, °C | 190 |
| Untere Explosionsgrenze in Luft, Vol. % | 2 |
| Obere Explosionsgrenze in Luft, Vol. % | 11.6 |
2. Chemische Reaktionen von Trimethylamin
Trimethylamin ist eine schwache Base, die mit Salzsäure Salze wie Trimethylammoniumchlorid bildet. An dieser Reaktion ist das freie Elektronenpaar am Stickstoffatom beteiligt.
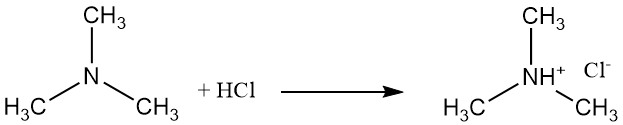
In der Gasphase nimmt die Basizität der Methylamine aufgrund der Methylgruppensubstitution wie folgt zu:
(CH3)3N > (CH3)2NH > CH3NH2 > NH3
In wässriger Lösung ist die Basizität von Trimethylamin jedoch geringer als die von Dimethylamin und Methylamin. Dies wird auf die schlechtere Solvatisierung des Trimethylammoniumions (CH3)3NH+ zurückgeführt, das nur einen Wasserstoff für die Wasserstoffbrückenbindung mit Wassermolekülen zur Verfügung hat.
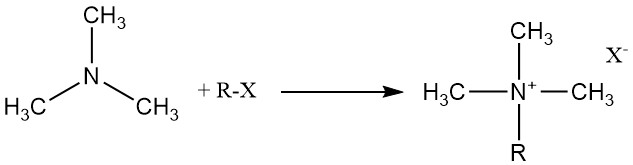
Trimethylamin reagiert mit organischen und anorganischen Säuren, Alkylhalogeniden und Epoxiden unter Bildung quartärer Ammoniumsalze.
Bei der Reaktion von Trimethylamin mit Ethylenoxid entsteht Cholin bzw. Cholinchlorid, wenn Trimethylammoniumchlorid verwendet wird.

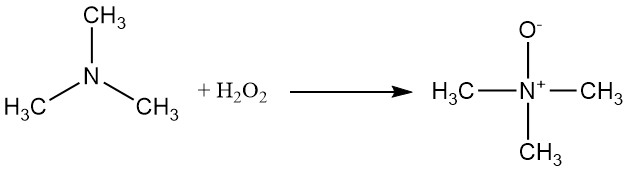
Trimethylamin kann mit Wasserstoffperoxid oder einer Persäure oxidiert werden, um Trimethylaminoxid zu ergeben.
3. Industrielle Produktion von Trimethylamin
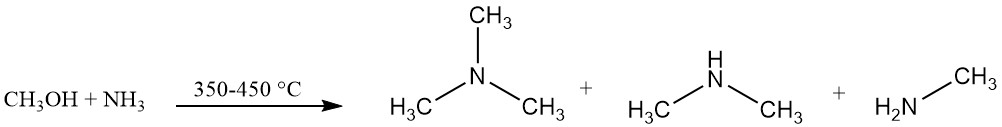
Trimethylamin wird industriell durch die Reaktion von Ammoniak und Methanol in Gegenwart eines Katalysators, typischerweise eines Katalysators auf Aluminiumoxidbasis, bei 350–450 °C hergestellt. Bei dieser Reaktion entsteht Trimethylamin sowie Dimethylamin und Methylamin.
Das Reaktionsgleichgewicht begünstigt die Bildung von Trimethylamin, die Marktnachfrage ist jedoch nach Monoethylamin und insbesondere nach Dimethylamin höher.
Die Verwendung von amorphen festen Säurekatalysatoren, einschließlich Aluminiumoxiden, Siliciumdioxiden und Phosphaten, begünstigt die Bildung von Trimethylamin im Gegensatz zu formselektiven Zeolithen, die selektiv für die Dimethylaminproduktion sind.
Die resultierende Mischung enthält nicht umgesetzte Materialien (Ammoniak, Methanol) sowie die gewünschten Produkte (Monoethylamin, Dimethylamin und Trimethylamin), während der Reaktion erzeugtes Wasser und andere Nebenprodukte.
Eine Reihe von vier bis fünf Destillationskolonnen trennt und reinigt die einzelnen Komponenten. Reines wasserfreies Trimethylamin wird aus der Mischung durch extraktive Destillation mit Wasser gewonnen, um die mit den anderen Methylaminen gebildete azeotrope Mischung aufzubrechen.
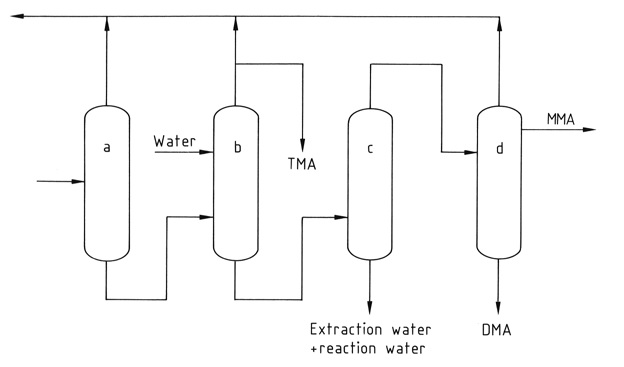
a) Ammoniaksäule; b) Extraktive Destillationskolonne; c) Kolonne zur Wasserentfernung; d) MMA- und DMA-Produktspalte
*MMA: Methylamin; DMA: Dimethylamin; TMA; Trimethylamin
4. Verwendung von Trimethylamin
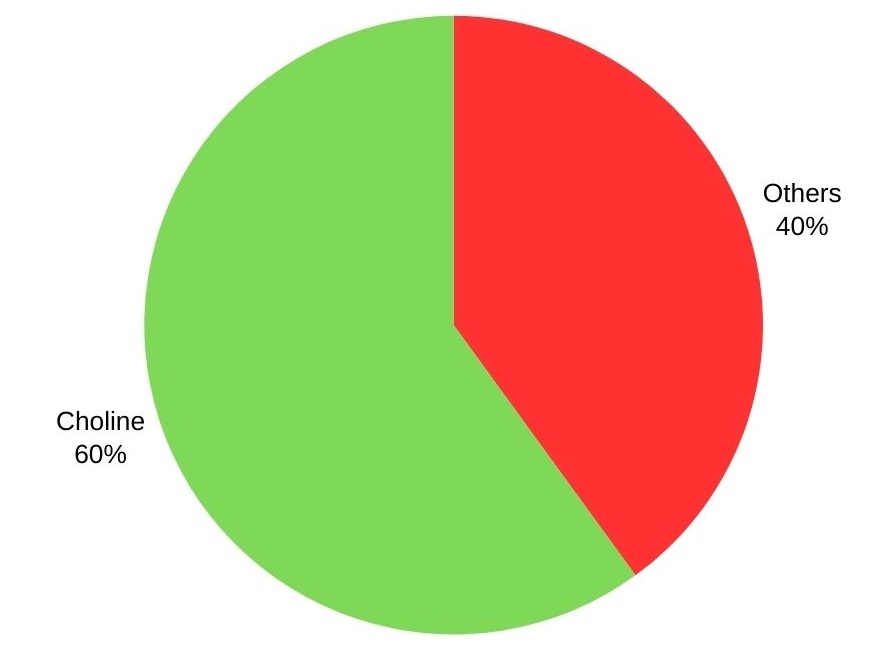
Trimethylamin wird mit über 60 % hauptsächlich zur Herstellung von Cholin und seinen Salzen verwendet. Weitere Anwendungen umfassen die Herstellung von kationischen Stärken, Desinfektionsmitteln, Flotationsmitteln, intensiven Süßungsmitteln und Ionenaustauschharzen.
Trimethylamin wird als Katalysator bei der Herstellung quartärer Ammoniumhydroxide und -salze verwendet.
Es kann auch zum Anlocken von Insekten verwendet werden und wird als Sicherheitsmaßnahme zum Aufspüren von Lecks dem geruchlosen Erdgas zugesetzt.
5. Toxikologie von Trimethylamin
Trimethylamin ist eine leicht entzündliche Flüssigkeit oder ein Gas, das Haut, Augen und Atemwege reizt und Lungenödeme (Flüssigkeitsansammlung in der Lunge) verursacht.
Belastungsgrenzen
- National Institute for Occupational Safety and Health (NIOSH): 10 ppm (Durchschnitt) und 15 ppm (kurzfristig)
- American Conference of Governmental Industrial Hygienists (ACGIH): 5 ppm (Durchschnitt) und 15 ppm (kurzfristig)
Gesundheitliche Auswirkungen
- Akut (kurzfristig): Haut- und Augenreizung, Reizung der Atemwege, Husten, Atemnot. Bei starker Belastung kann es zu einem Lungenödem kommen.
- Chronisch (langfristig): Es gibt keine schlüssigen Beweise für Karzinogenität oder Auswirkungen auf die Fortpflanzung. Andere langfristige gesundheitliche Auswirkungen sind noch nicht vollständig geklärt.
Handhabung und Lagerung
- Entfernt von Oxidationsmitteln, Quecksilber, Ethylenoxid, starken Säuren, Metallen und starken Basen lagern.
- Achten Sie auf einen kühlen, gut belüfteten Lagerbereich.
- Zündquellen wie Rauchen und offene Flammen beseitigen.
- Metallbehälter während des Transports erden und verbinden.
- Verwenden Sie funkenfreie Werkzeuge und Geräte.
Referenzen
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/1927.pdf
