Metilamina: Producción, Reacciones y Usos
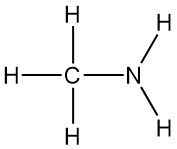
La metilamina es la amina primaria más simple, con la fórmula CH3NH2. Es un gas incoloro derivado del amoníaco, con un átomo de hidrógeno reemplazado por un grupo metilo. Fue sintetizado por primera vez en 1849 por Wurtz junto con la dimetilamina y la trimetilamina.
La síntesis industrial de metilaminas a partir de metanol y amoníaco se informó en 1884 y se comercializó en la década de 1920 para el curtido de cuero.
Tabla de contenido
1. Propiedades físicas de la metilamina
La metilamina es un gas que tiene un olor característico a pescado en bajas concentraciones pero, en concentraciones más altas, exhibe un olor parecido al amoníaco. Sus soluciones acuosas forman hidratos cristalinos al enfriar con la fórmula CH3NH2·3 H2O.
La metilamina es soluble en varios disolventes orgánicos, como metanol, etanol, dimetilformamida y etilenglicol.
La Tabla 1 presenta las propiedades físicas detalladas de la metilamina.
| Propiedad | Valor |
|---|---|
| Peso molecular (g/mol) | 31.06 |
| Punto de ebullición (101,33 kPa), °C | -6.3 |
| Punto de fusión, °C | -93,0 |
| Densidad (gas), g/cm3 a 101,33 kPa | 0,0014 |
| Densidad (líquido), g/cm3 a 25 °C | 0,6624 |
| pKa (a 25 °C) | 10.62 |
| Tensión superficial (25 °C), 10-3 N/m | 19.19 |
| Calor de vaporización (25 °C), kJ/mol | 24.249 |
| Calor de vaporización (punto de ebullición), kJ/mol | 26.0 |
| Calor de fusión, kJ/mol | 6.054 |
| Calor de formación estándar (líquido, 25 °C), kJ/mol | -47,31 |
| Calor de formación estándar (gas, 25 °C), kJ/mol | -22,98 |
| Calor de combustión (líquido, estado estándar, 25 °C), kJ/mol | -1061,35 |
| Capacidad calorífica (gas ideal, 25 °C), J K-1 mol-1 | 50,1 |
| Temperatura crítica, °C | 156,9 |
| Presión crítica, MPa | 7,46 |
| Constante dieléctrica (líquido, 25 °C) | 9.4 |
| Momento dipolar en benceno (25 °C), D | 1,47 |
| Punto de inflamación (copa cerrada), °C | -62 |
| Temperatura de ignición en el aire, °C | 430 |
| Límite inferior de explosión en el aire (% en volumen) | 4.9 |
| Límite superior de explosión en el aire (% vol.) | 20.7 |
2. Reacciones químicas de la metilamina
La metilamina es una base débil que forma fácilmente sales con ácidos (p. ej., haluros de metilamonio, también conocidos como hidrohaluros de metilamina, con los correspondientes ácidos hidrohálicos).
La reacción de la metilamina con haluros de alquilo conduce a una alquilación adicional, hasta la formación de sales de amonio cuaternario. Un ejemplo es la reacción con haluro de etilo para formar metiletilamina, metildietilamina y haluro de metiltrietilamonio.
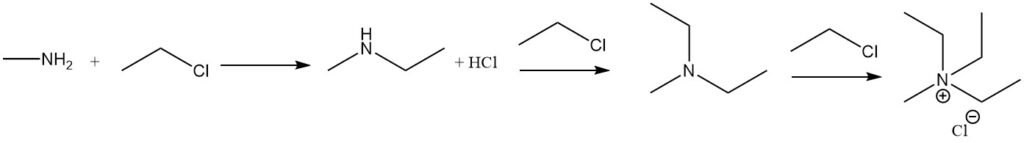
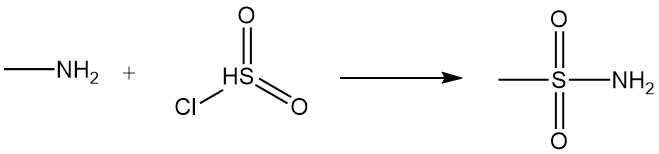
La reacción de la metilamina con ácidos carboxílicos y sus derivados da como resultado N-metilamidas, y la reacción con cloruro de sulfonilo produce metilsulfonamida sustituida.
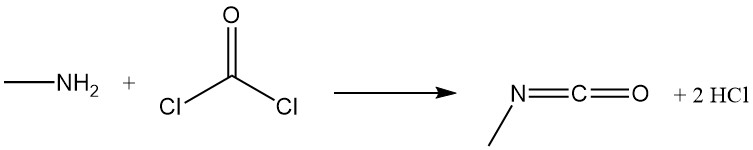
La metilamina reacciona con fosgeno para formar isocianato de metilo, un intermediario en la producción de insecticidas de carbamato, y con disulfuro de carbono en presencia de hidróxido de sodio para producir metilditiocarbamato de sodio.
La urea reacciona con metilamina mediante cianato de amonio intermedio para producir N-metilurea.
Hipocloritos alcalinos Conducen a una mezcla de mono y dicloroaminas de metilo.
La metilamina se descompone en metanol y nitrógeno mediante tratamiento con ácido nitroso y en cloruro de metilo y nitrógeno mediante la acción del cloruro de nitrosilo.
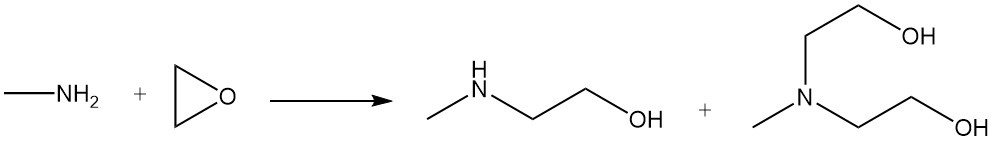
La metiletanolamina y la metildietanolamina se producen mediante la reacción de metilamina con óxido de etileno.
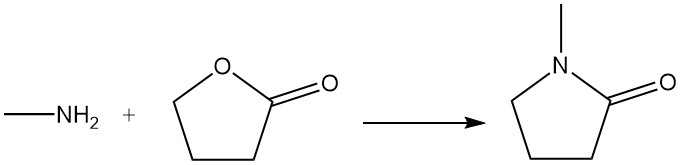
La γ-butirolactona reacciona con la metilamina para producir N-metilpirrolidona, que se utiliza como disolvente.
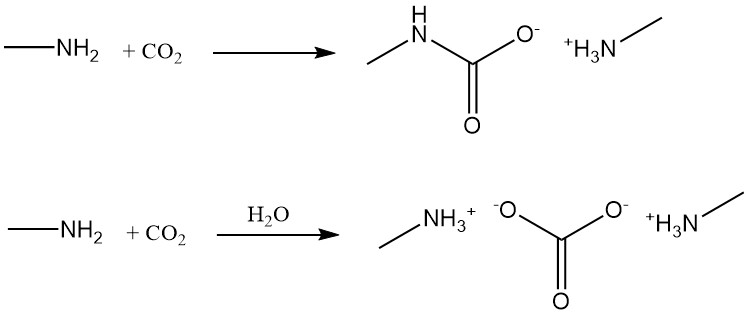
La metilamina reacciona con dióxido de carbono para formar carbamato de metilamina en condiciones anhidras y carbonato de metilamina en presencia de agua.
La metilamina es corrosiva para el aluminio, el cobre, las aleaciones de cobre, el metal galvanizado, el magnesio, el zinc y sus aleaciones. Sin embargo, el acero demuestra un buen rendimiento como material de construcción para manipular tanto metilamina anhidra como sus soluciones acuosas.
3. Producción de metilamina
La metilamina se produce mediante la reacción exotérmica entre metanol y amoníaco sobre un catalizador amorfo de sílice-alúmina a 350-450 °C. Esta reacción genera una mezcla de las tres variantes de metilamina (mono, di y trimetilamina).
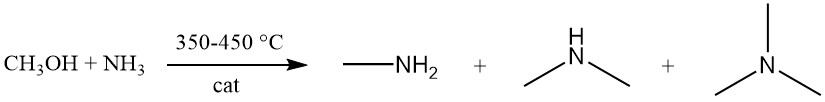
Mientras que el equilibrio favorece la formación de trimetilamina, la demanda del mercado prioriza la mono y especialmente la dimetilamina. El proceso de síntesis de aminas se puede modelar mediante nueve reacciones de equilibrio bimoleculares, tres de las cuales involucran específicamente la formación de aminas:
- NH3 + CH3OH → CH3NH2 + H2O
- CH3NH2 + CH3OH → (CH3)2NH + H2O
- (CH3)2NH + CH3OH → (CH3)3N + H2O
Actualmente se utilizan dos sistemas catalíticos principales para la reacción metanol-amoníaco en fase de vapor: catalizadores ácidos sólidos amorfos y catalizadores basados en zeolita de forma selectiva.
La mezcla de reacción cruda que contiene metilaminas, exceso de amoníaco, agua y metanol sin convertir se purifica usando una serie de columnas de destilación (típicamente 4-5). La trimetilamina se separa de la mezcla mediante destilación extractiva.
Este proceso de purificación logra altos rendimientos (>98%) de mono, di y trimetilamina pura y anhidra. El metanol recuperado mejora la eficiencia del proceso y la vida útil del catalizador.
4. Usos de la metilamina
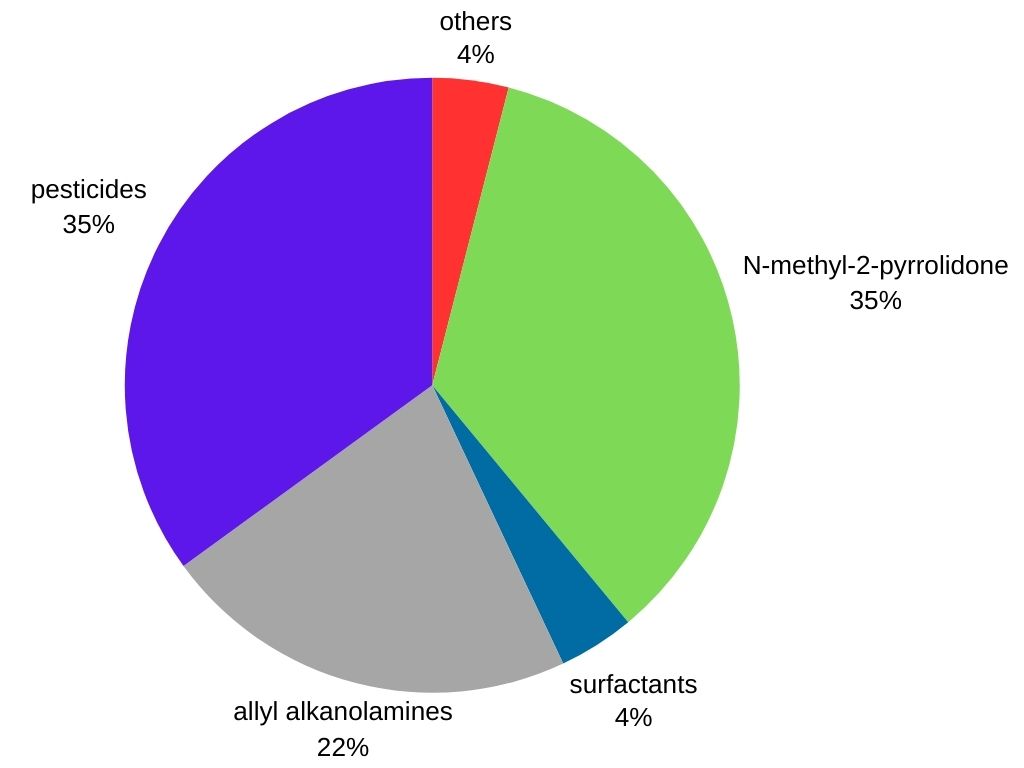
La metilamina se utiliza principalmente como intermediario en la producción de varios productos comerciales:
- Agroquímicos: la metilamina es un intermediario importante en la producción de numerosos herbicidas, pesticidas e insecticidas, lo que contribuye a la protección de los cultivos.
- Productos farmacéuticos: se utiliza en la síntesis de ciertos medicamentos, incluidos descongestionantes y antihistamínicos.
- Productos químicos para el procesamiento del caucho: la metilamina encuentra aplicación en la fabricación de diversos productos de caucho, como neumáticos y mangueras.
- Surfactantes: Se emplea en la producción de agentes limpiadores y humectantes presentes en detergentes, champús y emulsionantes.
- Otras aplicaciones: La metilamina también es un precursor de Tovex (explosivo en gel de agua), el disolvente N-metil-2-pirrolidona, la metildietanolamina (un disolvente utilizado en el procesamiento de hidrocarburos) y el desinfectante de suelos «Metam sodio».
5. Toxicología de la metilamina
Tanto la metilamina como sus soluciones son extremadamente inflamables y requieren una manipulación adecuada para evitar incendios y explosiones.
La metilamina y sus soluciones acuosas son corrosivas y pueden provocar quemaduras e irritación en los ojos, la piel y el sistema respiratorio. Cuando se inhala, afecta el tracto respiratorio superior en concentraciones bajas (75 ppm) y concentraciones más altas pueden dañar el hígado.
La exposición a la metilamina puede provocar efectos similares a los del amoníaco, como bronquitis, conjuntivitis, dermatitis y, en casos graves, irritación, quemaduras, daño pulmonar y cicatrización retardada de órganos.
La exposición repetida a la metilamina en animales se ha relacionado con toxicidad hepática, anomalías químicas sanguíneas y problemas pulmonares.
Los estudios sobre toxicidad genética no son concluyentes.
Los estudios existentes sugieren que el feto no es particularmente susceptible a la exposición, aunque se necesita más investigación.
La Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH) ha establecido un valor límite umbral (TLV) de 5 ppm (partes por millón) como promedio ponderado en el tiempo (TWA) y 15 ppm como límite de exposición a corto plazo (STEL) para metilamina.
Referencias
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamine; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005182
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
