El pirogalol, también conocido como ácido pirogálico, fue descubierto inicialmente por SCHEELE en 1786 mediante la destilación en seco del ácido gálico (ácido 3,4,5-trihidroxibenzoico). Los derivados del pirogalol se encuentran naturalmente en varios compuestos, incluidos taninos, antocianinas y alcaloides.
El pirogalol existe en forma de agujas u hojuelas incoloras, que cambian gradualmente de color a gris oscuro al exponerse al aire o a la luz.
Tabla de contenido
1. Producción de pirogalol
Pyrogallolis se produce comercialmente mediante descarboxilación de ácido gálico, que se prepara mediante hidrólisis de tanino.
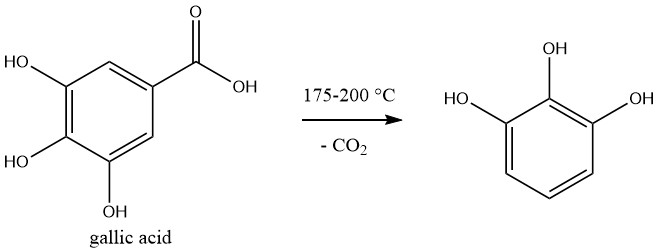
La reacción se lleva a cabo por lotes. Se calienta una solución acuosa al 50% de ácido gálico a 175-200°C en un autoclave y la presión aumenta a 1,2 MPa durante la reacción.
Una vez completada la evolución del dióxido de carbono, la solución se enfría. La reacción transcurre cuantitativamente.
Después de la decoloración de la mezcla de reacción con carbón vegetal se obtiene un producto bruto que se purifica mediante sublimación o destilación al vacío.
El costo de obtener pirogalol es relativamente alto, ya que el ácido gálico como material de partida se deriva de un producto natural que tiene una disponibilidad limitada. En consecuencia, se han buscado métodos alternativos para producir ácido gálico.
La condensación catalizada por bases de propano-1,2,3-tricarboxilato de trimetilo con el cetal dimetilo del ácido mesoxálico, seguida de hidrólisis y descarboxilación, produce ácido gálico con un rendimiento del 74%. La reacción del éster cetal y glutárico produce pirogalol sin generar ácido gálico.
También se han desarrollado otros métodos para producir pirogalol, como la oxidación de resorcinol con peróxido de hidrógeno, la hidrólisis de 2,6-diamino-4-butilfenol, la desmetilación de 2,6-dimetoxifenoles 4-sustituidos, la oxidación de 2,6- dimetilfenol, hidrólisis de 2,2,6,6-tetraclorociclohexanona, desoximación de 1,2,3-ciclohexanetrion-1,3-dioxima y deshidrogenación de 1,2,3-trihidroxiciclohexano.
2. Reacciones químicas del pirogalol
El pirogalol, un polihidroxibenceno, se considera el agente reductor más potente. Su solución acuosa absorbe rápidamente oxígeno gaseoso y precipita una sustancia de color marrón oscuro.
El pirogalol se ha utilizado ampliamente para la determinación cuantitativa de oxígeno debido a esta propiedad.
El comportamiento químico del pirogalol es comparable al de los fenoles. Los productos mono, di y trisustituidos se pueden sintetizar mediante métodos tradicionales como la esterificación y eterificación de los grupos hidroxi.
Al calentar con bicarbonato de potasio acuoso, el pirogalol produce predominantemente ácido pirogalol-4-carboxílico (ácido 2,3,4-trihidroxibenzoico), con ácido gálico como subproducto.
El pirogalol puede sufrir formilación, acilación y reacción de Mannich para formar ciclohexenonas 4-sustituidas como producto primario.
La bromación con bromo finalmente da como resultado 1,2,6,6-tetrabromociclohexeno-3,4,5-triona. La reacción con fosgeno produce carbonato de pirogalol y con bromuro de tionilo produce 4,5,6-tribromopirogalol.
El análisis cuantitativo de iones de metales pesados se realiza mediante reacciones cromáticas altamente sensibles de una solución acuosa de pirogalol con ellos. Los iones de metales preciosos (p. ej., Ag+, Au2+, Hg2+) se reducen a metales elementales.
Un catalizador para la polimerización alterna de dióxido de carbono y óxido de propileno se crea mediante un complejo formado a partir de dietilzinc y pirogalol.
3. Usos del pirogalol
El pirogalol es un compuesto versátil que resulta útil en fotografía, litografía y tintes para el cabello, y se emplea como antioxidante y estabilizador en diversas aplicaciones.
El uso de pirogalol en el ámbito de la cosmética y los medicamentos ha disminuido en los últimos tiempos, atribuido a su importante toxicidad.
Referencia
- Phenol Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_313