Trimethylamine: eigenschappen, reacties, productie en toepassingen
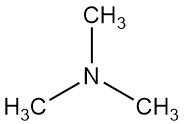
Wat is trimethylamine?
Trimethylamine is een organische verbinding met de formule N(CH3)3. Het is een kleurloos gas of samengeperste vloeistof met een sterke visgeur bij lage concentraties. Bij hogere concentraties wordt de geur meer ammoniakachtig.
Trimethylamine is een natuurlijk voorkomende verbinding die in kleine hoeveelheden in veel planten en dieren voorkomt. Het wordt ook geproduceerd door de afbraak van organisch materiaal, zoals vis en andere zeevruchten. In het menselijk lichaam wordt het geproduceerd door de darmbacteriën wanneer zij bepaalde voedingsmiddelen afbreken.
Inhoudsopgave
1. Fysieke eigenschappen van trimethylamine
Trimethylamine heeft een sterkere visachtige geur dan de andere methylamines (methylamine en dimethylamine). De menselijke neus kan trimethylamine detecteren bij een lage concentratie van <10 ppb geproduceerd door de ontbinding van planten en dieren.
Kristallijn hydraat (CH3)3N·10 H2O wordt gevormd door het afkoelen van verzadigde waterige oplossingen van trimethylamine. Bij atmosferische druk vormt het minimaal kokende azeotropen met ammoniak en andere methylamines.
Triethylamine is oplosbaar in verschillende organische oplosmiddelen, waaronder methanol, ethanol, dimethylformamide en ethyleenglycol, en de waterige oplossingen ervan kunnen veel anorganische en organische verbindingen oplossen.
Enkele fysieke eigenschappen van trimethylamine staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht, g/mol | 59,11 |
| Kookpunt (101,33 kPa), °C | 2,8 |
| Smeltpunt, °C | -117,1 |
| Dichtheid (bij 25 °C, vloeibaar), g/cm3 | 0,6331 |
| pKa (bij 25 °C) | 9,80 |
| Breukindex bij 0 °C | 1,3631 |
| Oppervlaktespanning (25 °C), 10-3 N/m | 13,47 |
| Verdampingswarmte bij 25 °C, kJ/mol | 22,864 |
| Verdampingswarmte bij kookpunt, kJ/mol | 27,708 |
| Smeltwarmte, kJ/mol | 6,548 |
| Standaardvormingswarmte bij 25 °C (vloeistof), kJ/mol | -45,80 |
| Standaardvormingswarmte bij 25 °C (gas), kJ/mol | -23,86 |
| Verbrandingswarmte, standaardtoestand bij 25 °C, vloeistof, kJ/mol | -2422,60 |
| Warmtecapaciteit, ideaal gas (25 °C), J K-1 mol-1 | 91,8 |
| Kritische temperatuur, °C | 160,1 |
| Kritische druk, MPa | 4,07 |
| Diëlektrische constante (25 °C), vloeistof | 2,44 |
| Dipoolmoment in benzeen (25 °C), D | 0,87 |
| Vlampunt (gesloten beker), °C | -71 |
| Ontstekingstemperatuur in lucht, °C | 190 |
| Onderste explosiegrens in lucht, vol % | 2 |
| Bovenste explosiegrens in lucht, vol % | 11,6 |
2. Chemische reacties van trimethylamine
Trimethylamine is een zwakke base die zouten vormt zoals trimethylammoniumchloride met zoutzuur. Deze reactie omvat het vrije elektronenpaar op het stikstofatoom.
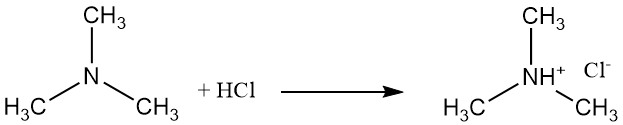
In de gasfase neemt de basiciteit van de methylamines toe op basis van methylgroepsubstitutie, als volgt:
(CH3)3N > (CH3)2NH > CH3NH2 > NH3
In waterige oplossing is de basiciteit van trimethylamine echter lager dan die van dimethylamine en methylamine. Dit wordt toegeschreven aan slechtere solvatatie van het trimethylammoniumion, (CH3)3NH+, dat slechts één waterstof beschikbaar heeft voor waterstofbinding met watermoleculen.
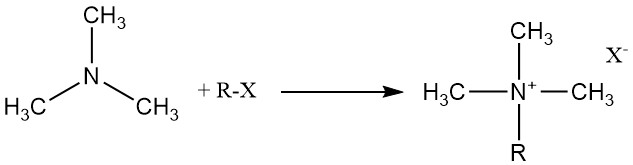
Trimethylamine reageert met organische en anorganische zuren, alkylhalogeniden en epoxiden om quaternaire ammoniumzouten te vormen.
De reactie van trimethylamine met ethyleenoxide produceert cholinebase of cholinechloride wanneer trimethylammoniumchloride wordt gebruikt.

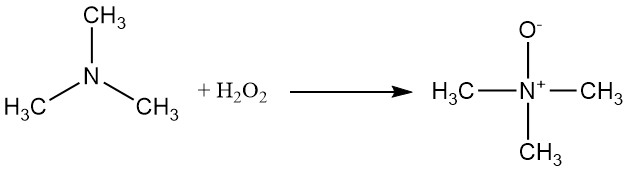
Trimethylamine kan worden geoxideerd met waterstofperoxide of een perzuur, waardoor trimethylamineoxide ontstaat.
3. Industriële productie van trimethylamine
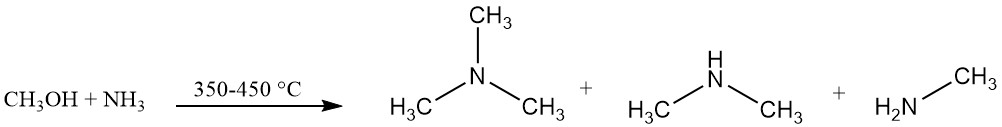
Trimethylamine wordt industrieel geproduceerd door de reactie van ammoniak en methanol in aanwezigheid van een katalysator, doorgaans een op alumina gebaseerde katalysator, bij 350–450 °C. Deze reactie produceert trimethylamine samen met dimethylamine en methylamine.
Het reactie-evenwicht is gunstig voor de vorming van trimethylamine, maar de marktvraag is hoger voor monoethylamine en met name dimethylamine.
Het gebruik van amorfe vaste zure katalysatoren, waaronder alumina’s, silica’s en fosfaten, is gunstig voor de vorming van trimethylamine in tegenstelling tot vormselectieve zeolieten die selectief zijn voor de productie van dimethylamine.
Het resulterende mengsel bevat niet-gereageerde materialen (ammoniak, methanol) samen met de gewenste producten (monoethylamine, dimethylamine en trimethylamine), water dat tijdens de reactie wordt gegenereerd en andere bijproducten.
Een reeks van vier tot vijf destillatiekolommen scheidt en zuivert de afzonderlijke componenten. Zuivere watervrije trimethylamine wordt uit het mengsel gewonnen door extractieve destillatie met water om het azeotrope mengsel dat met de andere methylamines is gevormd, te breken.
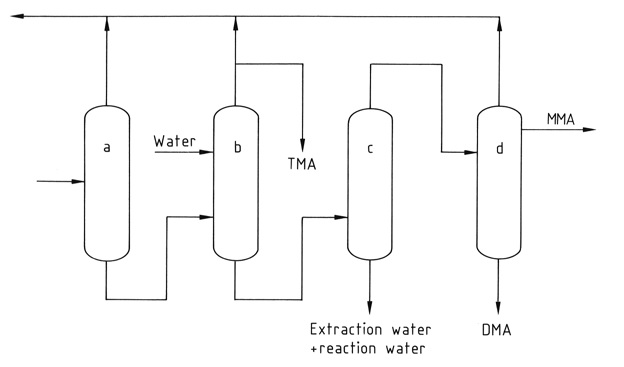
a) Ammoniakkolom; b) Extractieve destillatiekolom; c) Kolom voor waterverwijdering; d) MMA- en DMA-productkolom
*MMA: methylamine; DMA: dimethylamine; TMA; trimethylamine
4. Toepassingen van Trimethylamine
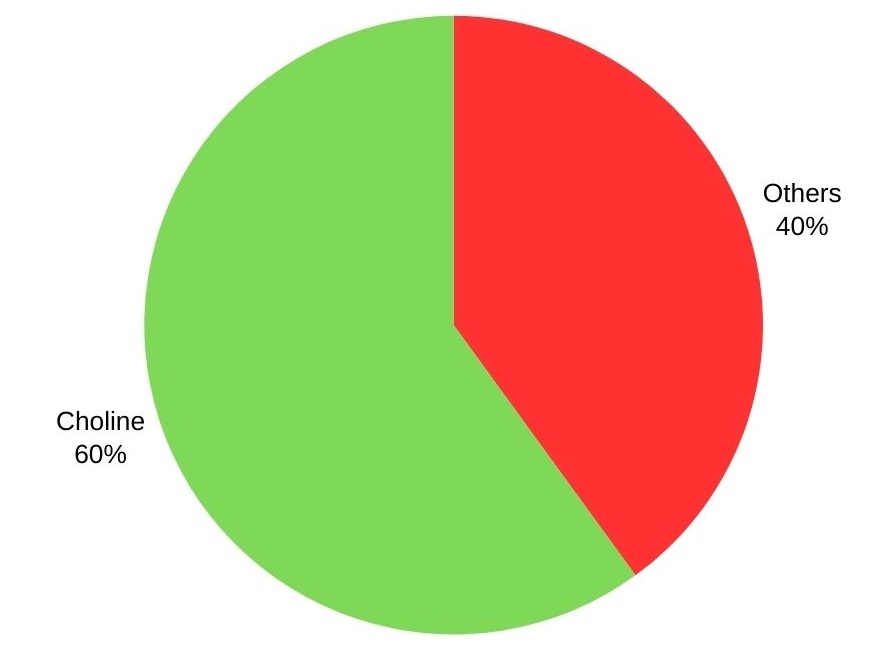
Trimethylamine wordt voornamelijk gebruikt om choline en zijn zouten te produceren, met meer dan 60%. Andere toepassingen zijn de productie van kationische zetmelen, ontsmettingsmiddelen, flotatiemiddelen, intense zoetstoffen en ionenuitwisselingsharsen.
Trimethylamine wordt gebruikt als katalysator bij de productie van quaternaire ammoniumhydroxiden en -zouten.
Het kan ook worden gebruikt om insecten aan te trekken en het wordt toegevoegd aan geurloos aardgas als veiligheidsmaatregel om lekken te detecteren.
5. Toxicologie van trimethylamine
Trimethylamine is een zeer ontvlambare vloeistof of gas dat irriterend is voor de huid, ogen en luchtwegen en longoedeem (vochtophoping in de longen) veroorzaakt.
Blootstellingslimieten
- National Institute for Occupational Safety and Health (NIOSH): 10 ppm (gemiddeld) en 15 ppm (korte termijn)
- American Conference of Governmental Industrial Hygienists (ACGIH): 5 ppm (gemiddeld) en 15 ppm (korte termijn)
Gezondheidseffecten
- Acuut (korte termijn): huid- en oogirritatie, irritatie van de luchtwegen, hoesten, kortademigheid. Ernstige blootstelling kan leiden tot longoedeem.
- Chronisch (lange termijn): Er is geen sluitend bewijs voor carcinogeniciteit of reproductieve effecten. Andere langetermijneffecten op de gezondheid zijn nog niet volledig in kaart gebracht.
Behandeling en opslag
- Bewaar uit de buurt van oxidatiemiddelen, kwik, ethyleenoxide, sterke zuren, metalen en sterke basen.
- Zorg voor een koele, goed geventileerde opslagruimte.
- Verwijder ontstekingsbronnen zoals roken en open vuur.
- Maal en verbind metalen containers tijdens het overbrengen.
- Gebruik vonkvrije gereedschappen en apparatuur.
Referenties
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/1927.pdf
