Propaandinitril: Eigenschappen, Reacties, Productie en Toepassingen
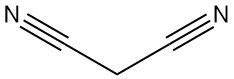
Wat is propaandinitril?
Malonnitril, ook bekend als propaandinitril, malonzuurdinitril of dicyaanmethaan, is een organische verbinding met de chemische formule C3H2N2. Het is een kleurloze of witte vaste stof die een waardevolle bouwsteen is die veel wordt gebruikt in organische synthese.
Inhoudsopgave
1. Fysieke eigenschappen van propaandinitril
Malonnitril vormt kleurloze kristallen die oplosbaar zijn in polaire oplosmiddelen zoals water, lagere alcoholen, acetonitril en di-ethylether, maar het is onoplosbaar in niet-polaire oplosmiddelen zoals tetrachloormethaan, petroleumether en xyleen.
Langdurige opslag kan kleurverandering veroorzaken, waardoor de kristallen van kleurloos naar geel of zelfs donkerbruin veranderen zonder dat dit ten koste gaat van de kwaliteit.
Malonnitril is giftig bij inname en kan ernstige huid- en oogirritatie veroorzaken.
De fysieke eigenschappen van propaandinitril staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-registratienummer | [109-77-3] |
| Moleculaire formule | C3H2N2 |
| Moleculaire massa | 66,06 g/mol |
| Smeltpunt | 31,6 °C |
| Kookpunt | 218 – 219 °C |
| Dichtheid (20 °C) | 1,19 g/ml |
| Breukindex (34 °C) | 1,4146 |
| Dipoolmoment (25 °C) | 3,57 D |
| pKa | 11,2 |
| Dampdichtheid | 2,3 |
| Dampdruk | 0,2 mmHg |
| Vlampunt | > 86 °C |
| Oplosbaarheid (20 °C) | |
| water | 133 g/L |
| di-ethylether | 200 g/L |
| ethanol | 400 g/L |
2. Chemische reacties van propaandinitril
Propaandinitril vertoont veelzijdige reactiviteit vanwege de nucleofiliciteit van het malonnitril-anion, dat kan worden verkregen door deprotonering met een zwakke base, en de elektrofiele aard van zijn cyanogroepen.
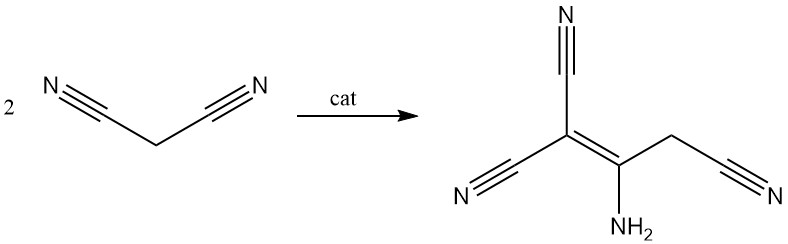
Propaandinitril wordt gedimeriseerd in aanwezigheid van een base om 2-amino-1,1,3-tricyano-2-propeen te verkrijgen.
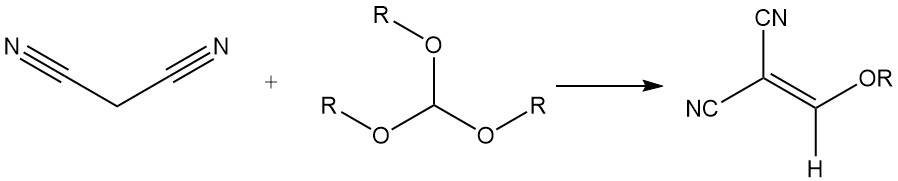
Het reageert met trialkylorthoformiaten om alkoxymethyleenmalonitrilen te produceren, die worden gebruikt voor de synthese van styrylkleurstoffen.
Dialkylering van malonnitril met alkylhaliden en acylering met zuurchloriden/anhydriden is mogelijk.
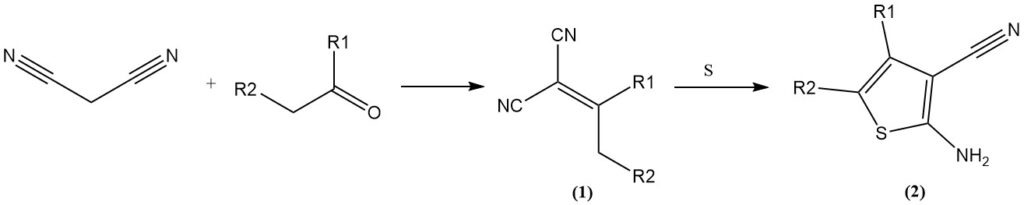
Knoevenagel-condensatie met aldehyden/ketonen levert ylideenmalonitrilen op (1), die verdere reacties kunnen ondergaan. Voorbeelden zijn de reactie met elementair zwavel (Gewald-reactie) om 3-cyaan-2-amino-thiofenen te vormen (2) of de cycloadditie met aziden om tetrazolen te verkrijgen.
Propaandinitril reageert met broom om mono- of dibromineerde derivaten te produceren. Thermische ontleding van het dibromidecomplex levert tetracyanoethyleen op.
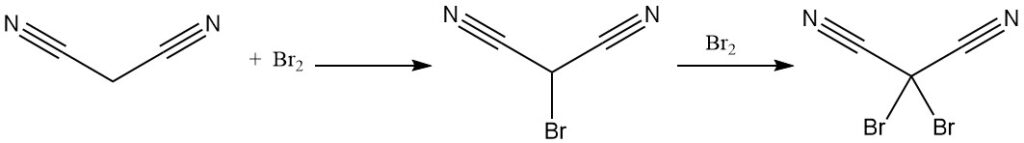
Reactie van dibromomalonnitril met kaliumcyanide levert het kaliumzout van tricyaanmethaan op, ook geproduceerd uit propaandinitril en cyanogeenchloride. Tricyaanmethaan wordt gebruikt in ionische vloeistofsynthese.
De reactie van malonnitril met koolstofdisulfide in aanwezigheid van een base produceert zouten van (dimercaptomethyleen)malonitril, een voorloper voor antimicrobiële middelen. Dimethylering levert een andere belangrijke bouwsteen voor heterocyclische verbindingen op.
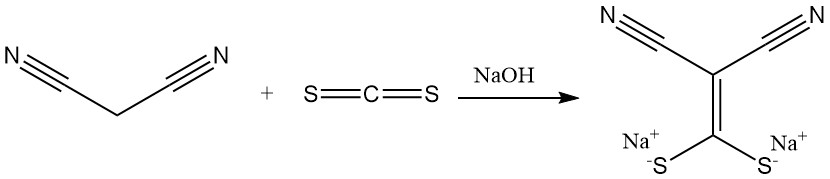
Cyanothioacetamide wordt bereid door reactie met waterstofsulfide.
Zuurgekatalyseerde reacties van propaandinitril met alcoholen genereren imidaten (3), die startmaterialen zijn voor stikstofheterocyclische verbindingen zoals 4,6-dimethoxypyrimidines (4) of bis(oxazolines) (5).
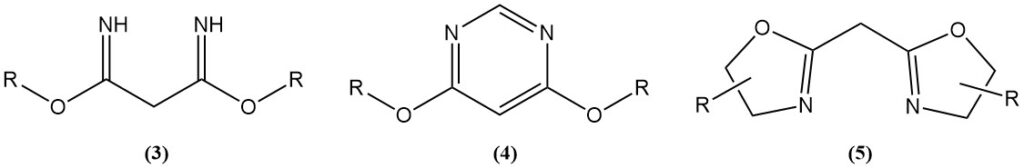
Bis(oxazolines) worden geproduceerd door reacties van het Ritter-type of door gebruik te maken van een katalysator. Bis(oxazolines) gesynthetiseerd uit propaandinitril of zijn derivaten en chirale aminoalcoholen worden gebruikt als liganden in asymmetrische overgangsmetaal-gekatalyseerde reacties.
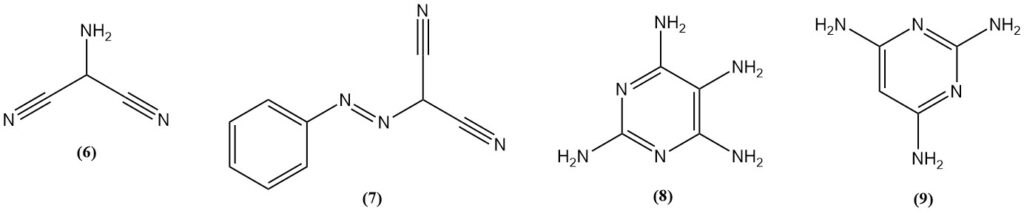
2-Aminomalonnitril (6) wordt verkregen door nitrosering van malonnitril, gevolgd door hydrogenering of door reductie van (fenylazo)malonnitril (7). Aminomalonnitril reageert met guanidine om 2,4,5,6-tetraaminopyrimidine (8) te verkrijgen.
2,4,6-triaminopyrimidine (9) kan worden bereid door de reactie van propaandinitril en guanidine, terwijl 2,4,6-triaminopyrimidine wordt geproduceerd uit formamidine.
3. Productie van propaandinitril
Tot in de jaren 70 werd malonnitril geproduceerd via een batchproces door dehydratie van cyanoacetamide met behulp van fosforpentachloride of fosforoxychloride. Deze methode, hoewel gedocumenteerd door patenten zelfs recent, wordt niet langer commercieel gebruikt, behalve in enkele kleinschalige Chinese fabrieken.
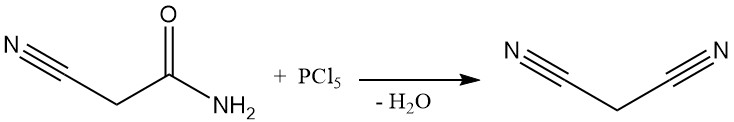
De dominante industriële methode voor malonnitrilsynthese is tegenwoordig een continue, hoge-temperatuurreactie tussen acetonitril en cyanogeenchloride. Dit proces maakt gebruik van een buisreactor die boven de 700 °C werkt en bereikt een bijna volledige omzetting in één doorgang, wat propaandinitril oplevert.
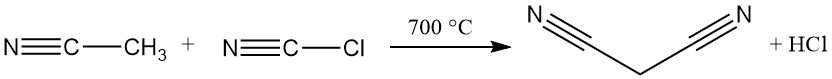
Overtollig acetonitril, zoutzuur en sporen maleïnezuur, barnsteenzuur en fumaarzuur zijn aanwezig met het gewenste product als onzuiverheden.
Het product dat de reactor verlaat, wordt snel afgekoeld om de reactie te blussen en gasvormig waterstofchloride af te scheiden, dat vervolgens wordt teruggewonnen door middel van scrubben. Overtollig acetonitril wordt verwijderd via een combinatie van vacuümdestillatie en dunnefilmverdamping, waardoor het kan worden gerecycled met minimale verontreiniging.
Scheiding van maleïnezuur en fumaarzuur uit het ruwe propaandinitril is onpraktisch vanwege hun vergelijkbare kookpunten. Daarom worden deze onzuiverheden omgezet in hoger kokende verbindingen via een Diels-Alder-reactie in een aparte reactor. Tot slot verwijderen twee vacuümdestillaties deze bijproducten, wat resulteert in een opbrengst van 66% malonnitril op basis van beide uitgangsmaterialen.
De eerste industriële fabriek die dit proces gebruikte, werd in 1973 geëxploiteerd door Lonza in Visp, Zwitserland.
Hoewel er alternatieve methoden voor malonnitrilproductie zijn voorgesteld, zoals die met behulp van cyanoacetaten, malonaten of reacties met ammoniak en verschillende katalysatoren, wordt geen van deze methoden momenteel op industriële schaal toegepast.
4. Toepassingen van propaandinitril
Propaandinitril wordt uitgebreid gebruikt als grondstof bij de productie van vitaminen, agrochemicaliën, farmaceutica en kleurstoffen.
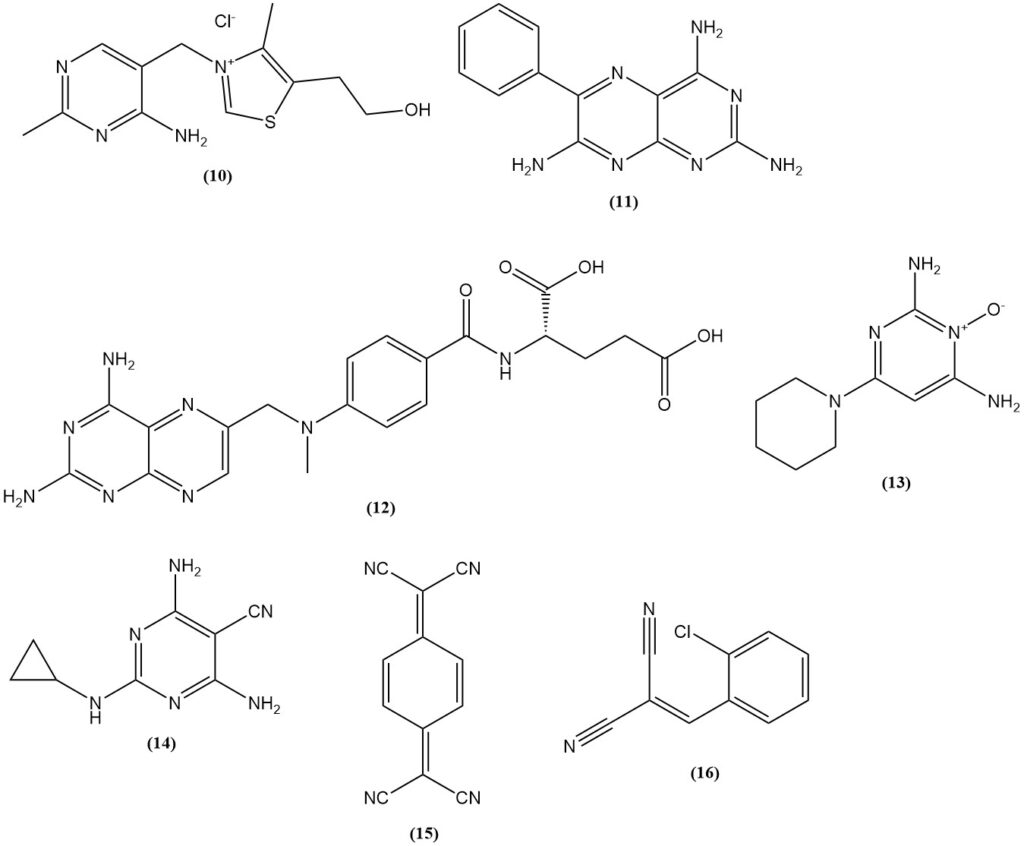
Malonnitril wordt gebruikt bij de synthese van thiamine (10) (vitamine B1), sulfonylureumherbiciden op basis van 2-amino-4,6-dimethoxypyrimidine, zoals benzsulfuron-methyl en halosulfuron-methyl en farmaceutica (het diureticum triamtereen (11), de foliumzuurantagonist methotrexaat (12), het antihypertensieve minoxidil (13) en het pesticide dicyclanil (14)).
Voorbeelden van kleurstoffen en pigmenten die uit propaandinitril worden geproduceerd, zijn gele methinekleurstoffen met een N,N-dialkylaminoarylgroep (aminoarylneutrocyaninen) zoals C.I. Disperse Yellow 90; blauwe aminoarylneutrocyaninekleurstoffen zoals C.I. Disperse Blue 354; en 1,4,5,8-naftaleentetracarbonzuur, dat een voorloper is van perinonpigmenten.
Het wordt ook gebruikt bij de productie van elektrische geleiders zoals ladingsoverdrachtzouten van 7,7,8,8-tetracyanoquinodimethaan (15) (TCNQ) en het traangas (o-chloorbenzylideen)malonitril (16), dat kan worden geproduceerd door condensatie van o-chloorbenzaldehyde met malonnitril.
5. Toxicologie van malonnitril
Malonnitril kan ernstige oogirritatie veroorzaken bij konijnen bij blootstelling aan 5 mg gedurende 24 uur.
propaandinitril is zeer giftig via verschillende routes, met orale LD50-waarden variërend van 14 mg/kg tot 69,8 mg/kg bij ratten. Veelvoorkomende effecten zijn onder meer convulsies, spierzwakte, ademhalingsdepressie en gedragsveranderingen.
Huidcontact met propaandinitril kan ook dodelijk zijn bij ratten bij doses van 350 mg/kg. De beschikbare gegevens suggereren mogelijke effecten op verschillende organen, waaronder de longen, het bloed en het zenuwstelsel.
Herhaalde orale blootstelling bij ratten bij lagere doses (285 mg/kg/19 weken) kan lever- en gewichtsveranderingen veroorzaken.
Er bestaan beroepsmatige blootstellingslimieten om de concentraties propaandinitril in de lucht op de werkplek te reguleren (bijv. NIOSH Recommended Exposure Level: 3 ppm).
Referenties
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Malononitrile
- https://www.cdc.gov/niosh-rtecs/OO3010B0.html
