Oxaalzuur: productie, reacties en toepassingen
Wat is oxaalzuur?
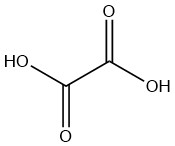
Oxaalzuur is het eenvoudigste verzadigde dicarbonzuur met de formule C2H2O4. Het is een witte vaste stof die van nature voorkomt in de vorm van een dihydraat. Een watervrije verbinding moet worden geproduceerd uit het dihydraat, zelfs wanneer het industrieel wordt geproduceerd.
Oxaalzuur komt van nature voor in veel planten, waaronder bladgroenten, groenten, fruit, cacao, noten en zaden. Het wordt ook aangetroffen in rabarberbladeren en bepaalde soorten bonen.
Het is al lang bekend en werd voor het eerst geïdentificeerd door WIEGLEB in 1769 in het kaliumzout van zuring.
Inhoudsopgave
1. Productie van oxaalzuur
Er zijn talloze industriële processen die worden gebruikt bij de productie van oxaalzuur, die door verschillende bedrijven zijn geïmplementeerd en nog steeds worden gebruikt.
Over het algemeen worden er slechts drie soorten verbindingen gebruikt als grondstoffen bij de productie van oxaalzuur. Deze omvatten koolhydraten (zoals melasse en ethyleenglycol), olefinen en koolmonoxide.
Bij alle industriële processen wordt oxaalzuur verkregen als kristallijn dihydraat. De volgende secties beschrijven vier methoden die momenteel industrieel worden gebruikt. Drie van deze methoden zijn gebaseerd op oxidatie van salpeterzuur en één is een synthese die koolmonoxide gebruikt.
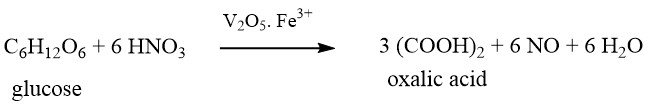
1.1. Productie van oxaalzuur door oxidatie van koolhydraten
Deze methode, die de oudste van de chemische producties is, werd voor het eerst ontdekt door SCHEELE meer dan 200 jaar geleden in 1776. Hij oxideerde suiker met geconcentreerd salpeterzuur om oxaalzuur te produceren.
Het duurde echter tot ongeveer 1940 voordat dit proces industrieel belang kreeg, toen de stikstofoxiden die bij de reactie ontstonden, konden worden teruggewonnen en gerecycled.
In Duitsland produceerde I.G. Farben tot 1944 2000 ton oxaalzuur per jaar met deze methode. Dit proces wordt momenteel gebruikt in Brazilië, China en in verschillende Oost-Europese landen.
De grondstoffen die in dit proces worden gebruikt, zijn onder andere suiker, glucose, fructose, maïszetmeel, tarwezetmeel, teruggewonnen zetmeel, aardappelzetmeel, maïskolven, tapioca en melasse.
De selectie van uitgangsmaterialen voor de productie van oxaalzuur hangt af van de beschikbaarheid, kosten en de optimalisatie van het reactieproces.
Verschillende grondstoffen kunnen resulteren in verschillende opbrengsten en de vorming van schuim, vetten en slijm, die op de juiste manier beheerd moeten worden.
Melasse en ander landbouwafval zijn steeds populairder geworden als grondstoffen vanwege hun lage kosten en de milieuvoordelen van hun gebruik.
Melasse, een bijproduct van suikerraffinage, bevat stikstofhoudende verbindingen die grotendeels worden geëlimineerd tijdens de oxidatie van salpeterzuur, ondanks dat ze overmatige schuimvorming veroorzaken tijdens de reactie.
In het geval van het gebruik van zetmeelgebaseerde materialen als grondstoffen, moeten ze eerst worden gehydrolyseerd tot glucose in een aparte batchgewijze stap voorafgaand aan de oxidatie.
De gehydrolyseerde glucoseoplossing wordt gemengd met zwavelzuur, vanadiumpentoxide (0,001-0,05 gew.%) en ijzer(III)sulfaat (0,39-0,8 gew.%) in een reactor.
Salpeterzuur (65%) wordt vervolgens langzaam toegevoegd onder krachtig roeren binnen een nauwkeurig gecontroleerd temperatuurbereik van ongeveer 70 °C, variërend op basis van de grondstof.
De reactie is sterk exotherm en moet goed worden gekoeld.
Er wordt tegelijkertijd lucht aan de reactor toegevoerd om de reactie te ondersteunen en NO en andere stikstofoxiden met een laag oxidatiegetal te verwijderen. De uitgestoten stikstofoxiden worden verzameld in een adsorptiesysteem en na oxidatie gerecycled.
Het ruwe oxaalzuur wordt verkregen door koeling en centrifugatie van het reactiemengsel, gevolgd door oplossen in heet water, vetafscheiding, herkristallisatie, een tweede centrifugatie en drogen om oxaalzuurdihydraat te verkrijgen met een zuiverheid van meer dan 99%.
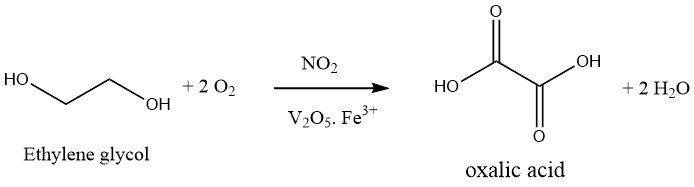
1.2. Productie van oxaalzuur door oxidatie van ethyleenglycol
De oxidatie van ethyleenglycol met salpeterzuur is een eenstapsproces. Een oxiderend mengsel van 30-40% zwavelzuur en 20-25% salpeterzuur wordt gebruikt en de reactie wordt uitgevoerd bij 50-70 °C en atmosferische druk in aanwezigheid van vanadiumpentoxide en ijzer(III)zouten. Het bijproduct dat tijdens deze reactie wordt gevormd, is alleen CO2.
Het proces van oxaalzuurproductie is aanzienlijk verbeterd door Mitsubishi Gas Company, wat heeft geresulteerd in Japans primaire afhankelijkheid van deze methode.
De verbeterde techniek omvat het gebruik van een drukreactor die werkt op ongeveer 10 bar. Salpeterzuur (ongeveer 60%), evenals zwavelzuur (waar van toepassing), worden onderworpen aan zuurstof onder druk, terwijl een temperatuur van 80 °C wordt gehandhaafd.
Vervolgens wordt ethyleenglycol continu toegevoegd en worden de temperatuur en druk van de reactie gehandhaafd door zuurstof toe te voegen. Effectieve koeling is vereist om te voorkomen dat de exotherme reactie boven 50-70 °C uitkomt.
De outputopbrengst van oxaalzuur, gebaseerd op ethyleenglycol, varieert tussen 90-94% van het theoretische maximum. Opvallend is dat het grootste deel van het gebruikte salpeterzuur kan worden teruggewonnen. Dit suggereert dat stikstofoxiden en salpeterzuur slechts als katalysatoren in het oxidatieproces fungeren, waarbij zuurstof als primair oxidatiemiddel fungeert.
Alternatieve uitgangsmaterialen, zoals propyleenglycol, acetaldehyde of glycolzuur, kunnen ook worden gebruikt. Om de efficiëntie te verbeteren, worden vanadiumverbindingen (0,001 – 0,1 gew.%) aanbevolen als promotors. Initiatoren zoals natriumnitriet, mierenzuur of formaldehyde kunnen ook worden gebruikt.
1.3. Productie van oxaalzuur door oxidatie van propeen
De productie van oxaalzuur door middel van propeen- en salpeterzuurreactie is het op één na belangrijkste industriële proces na koolhydraatoxidatie.
In 1978 was deze methode goed voor 65.000 t/a van de wereldwijde productie van oxaalzuur. Bijproducten van petrochemische raffinaderijen, namelijk zuiver propeen of propeenrijke fracties, dienen als haalbare grondstoffen voor deze reactie.
Rhone-Poulenc, een in Frankrijk gevestigd bedrijf, verbeterde het proces aanzienlijk door technische engineering en constructieve vooruitgang te introduceren, terwijl strikte naleving van de reactieomstandigheden werd gehandhaafd.
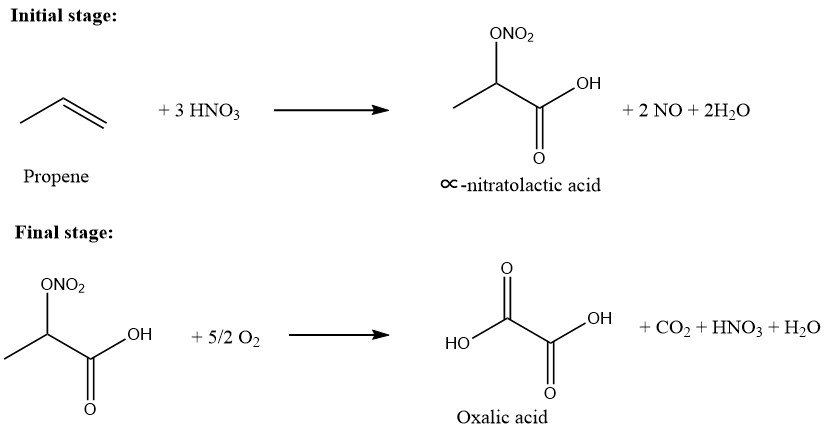
Het proces van propeenoxidatie tot oxaalzuur omvat twee primaire fasen.
In de eerste stap wordt propeen in een salpeterzuuroplossing (50-75 gew.%) gebracht bij een temperatuurbereik van 10-40 °C. De molaire verhouding van propeen tot salpeterzuur wordt gehandhaafd tussen 0,01/1,0 en 0,5/1,0. Deze stap levert in water oplosbaar ∝-nitratomelkzuur en melkzuurtussenproducten op.
In de tweede fase wordt zuurstof in de oplossing met de gedeeltelijk geoxideerde producten gebracht in aanwezigheid van een katalysator, bij een temperatuurbereik van 45-100 °C.
Het resulterende oxaalzuur wordt vervolgens gekristalliseerd, gefilterd en teruggewonnen. De totale opbrengst, gebaseerd op propeen, is ongeveer 90% en de omzetting van propeen is bijna 100%.
Stikstofoxiden die in de tweede reactor worden gegenereerd, worden geëlimineerd en teruggewonnen. Het verbruik van salpeterzuur in dit proces is 1,2 kg per kg geproduceerd oxaalzuurdihydraat.
Katalysatoren die zouten of verbindingen van Fe, Al, Cr, Sn, Bi of I bevatten, worden toegevoegd om de opbrengst te verbeteren. In dit proces worden chroom(III)nitraat, ijzer(III)nitraat of tin(II)chloride gebruikt in hoeveelheden van 0,4-0,5 gew.% (op basis van het metaal) en opgelost in 65% salpeterzuur om de efficiëntie te verbeteren.
1.4. Productie van oxaalzuur uit koolmonoxide
Ube Industries heeft het meest recente proces ontwikkeld voor de industriële productie van oxaalzuur, dat twee stappen omvat. In de eerste fase reageren CO en een lagere alcohol onder druk en in aanwezigheid van een katalysator om de overeenkomstige diester van oxaalzuur te vormen.
In de tweede stap resulteert hydrolyse van deze diester in de vorming van oxaalzuur en de oorspronkelijke alcohol, die wordt gerecycled. De reactie wordt gekatalyseerd door palladium op houtskool en alkylnitrieten en uitgevoerd bij een druk van 10-11 MPa. De voorkeursalcohol en oplosmiddel is n-butanol.
Hoewel dit proces profiteert van het gebruik van goedkope uitgangsmaterialen, heeft het aanzienlijke nadelen vanwege de veel hogere kapitaalinvestering (vanwege de hoge drukvereisten) en nutsvoorzieningskosten.
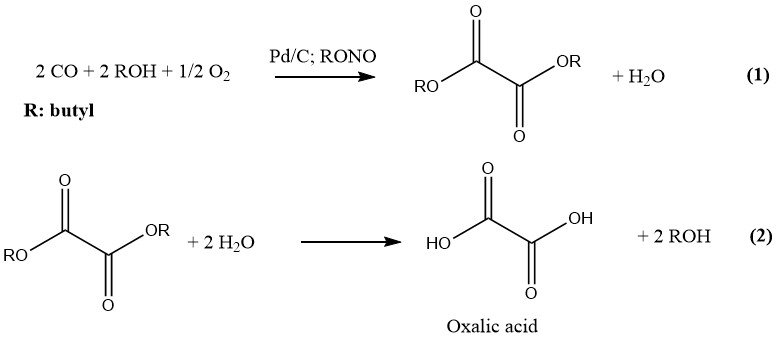
Butylnitriet en methylnitriet zijn de voorkeursalkylnitrieten voor industriële doeleinden vanwege hun geschiktheid voor de productie van oxaalzuur. Een fabriek die in 1978 werd gebouwd, gebruikte butylnitriet bij de productie van oxaalzuur met een snelheid van 6000 t/a.
Butylnitriet biedt verschillende voordelen in dit proces, waaronder de functie ervan als zowel een reactiecomponent als een dehydraterend middel. Het hogere kookpunt van butylnitriet in vergelijking met water en butylnitriet maakt het mogelijk om water te verwijderen dat is gevormd als een azeotropisch mengsel, waardoor het grootste deel van het butylnitriet in het systeem achterblijft.
Het teruggewonnen butylnitriet kan na scheiding worden hergebruikt. Butylnitriet wordt uiteindelijk gehydrolyseerd tot butanol, dat eenvoudig kan worden gescheiden van de oxaalzuuroplossing door fasescheiding.
De reactie voor de productie van oxaalzuur met behulp van butylnitriet en een palladiumkatalysator vindt plaats in een reactietoren. Een circulatievloeistof die butylnitriet, butanol en de palladiumkatalysator bevat, evenals een circulatiegas dat koolmonoxide en zuurstof bevat, worden onder druk gezet en naar de toren gevoerd.
De exotherme reactie tussen butylnitriet en koolmonoxide resulteert in de vorming van dibutyloxalaat en de gelijktijdige regeneratie van butylnitriet. De reactie wordt uitgevoerd bij een temperatuur van 90 – 100 °C en een druk van 10 -11 MPa om de selectiviteit voor dibutyloxalaat te optimaliseren.
De zuurstofconcentratie in de reactietoren wordt onder de explosiegrens gehouden door gascirculatie, wat ook het koolmonoxidegebruik en de gas-vloeistofcontactsnelheid verbetert.
De oplossing die uit de toren vrijkomt, wordt geflitst om het gevormde kooldioxidegas als bijproduct te verdampen. Het tijdens de reactie gevormde water wordt verwijderd door azeotropische destillatie met butylnitriet en het grootste deel van de oplossing wordt gerecycled naar de reactietoren.
Een deel van de oplossing wordt verder verwerkt om zuiver dibutyloxalaat te verkrijgen, dat wordt verkregen na de scheiding van katalysatoren, butylnitriet en butanol.
De palladiumkatalysator, butylnitriet en butanol worden teruggewonnen en teruggevoerd naar de circulatievloeistof, die ook wordt voorzien van make-upbutanol en salpeterzuur. De circulatievloeistof wordt vervolgens onder druk gezet en teruggevoerd naar de reactietoren.
Het geraffineerde dibutyloxalaat wordt gemengd met de moederloog van de oxaalzuurkristallisatie en bij ongeveer 80 °C gehydrolyseerd tot oxaalzuur en butanol.
De oxaalzuuroplossing en butanol worden gescheiden door fasescheiding. Oxaalzuurdihydraat wordt vervolgens gekristalliseerd uit de oxaalzuuroplossing en butanol wordt na raffinage gerecycled naar het proces.
2. Chemische reacties van oxaalzuur
Het gedrag van oxaalzuur is uniek vanwege de interactie tussen aangrenzende carboxylaatgroepen, wat resulteert in een verhoogde dissociatieconstante en gemak van decarboxylering.
Bij snelle verhitting tot 100 °C ontleedt oxaalzuur in koolmonoxide, kooldioxide en water, met mierenzuur als isoleerbaar tussenproduct.
Ontleding van oxaalzuur in waterige oplossingen kan worden geïnduceerd door licht en, in grotere mate, door γ- of röntgenstraling, wat resulteert in koolmonoxide, kooldioxide, mierenzuur en af en toe waterstof. Zware metaalzouten, zoals uranylzouten, katalyseren deze ontleding.
Oxaalzuur kan geen intramoleculair anhydride vormen, maar kan worden ontleed in koolmonoxide, kooldioxide en water bij verhitting tot meer dan 190 °C of opwarming in geconcentreerd zwavelzuur of fosforzuur. Deze ontleding is niet exotherm.
De reducerende eigenschappen van oxaalzuur vormen de basis voor de praktische toepassingen ervan, omdat het gemakkelijk kan worden geoxideerd tot de onschadelijke eindproducten koolstofdioxide en water door verschillende oxidatiemiddelen, waaronder lucht en de zouten van zware metalen.
Oxaalzuur wordt gemakkelijk veresterd, waarbij zure monoesters of neutrale diesters worden geproduceerd als tussenproducten in chemische syntheses. Deze esters reageren gemakkelijk met water, ammoniak of aminen om de overeenkomstige acylderivaten te produceren.
De metaalzouten van oxaalzuur vertonen ook belangrijke chemische kenmerken, die bestaan als zure of neutrale zouten. Alkalimetaal- en ijzer(III)zouten zijn gemakkelijk oplosbaar in water, terwijl alle andere zouten matig oplosbaar zijn.
De bijna volledige onoplosbaarheid van aardalkalizouten, met name calciumoxalaat, vindt toepassingen in kwantitatieve analyse. Bij verhitting verliezen deze metaalzouten koolmonoxide en sommige gemakkelijker afbreekbare zouten verliezen ook kooldioxide. Alkali- en aardalkalizouten vormen onder deze omstandigheden carbonaten.
Metaalzouten van mangaan, zink en tin vormen oxiden, terwijl ijzer-, cadmium-, kwik- en koperzouten mengsels van oxiden en metalen vormen. Nikkel-, kobalt- en zilverzouten leveren zuivere metalen op. Watervrije fusie van oxalaten met alkali levert carbonaten en waterstof op.
3. Toepassingen van oxaalzuur
Met betrekking tot de toepassingen als synthetisch tussenproduct, zijn oxaalzuur of de zouten ervan ook voornamelijk gebruikt als reductiemiddelen, die onschadelijke eindproducten van koolstofdioxide en water produceren, evenals precipitatiemiddelen voor calciumionen, of als complexerende middelen voor de zouten van zware metalen.
3.1 Metaalbehandeling
Zware metalen, met name ijzer, vormen oplosbare dubbelzouten met natrium-, kalium- of ammoniumoxalaten.
IJzer(III)oxalaat is het enige gemakkelijk oplosbare zware metaalzout. Oxaalzuurzouten worden daarom gebruikt voor het verwijderen van roest uit koelsystemen (zoals autoradiatoren), boilers of stalen platen voorafgaand aan fosfateren.
Ze kunnen ook worden gebruikt om ijzeraders uit marmer te verwijderen, als bestanddeel van metaalreinigers met roestbescherming, met name voor koper, zilver of aluminium, bij het anodiseren van aluminium en bij het creëren van zeer harde, slijt- en corrosiebeschermende coatings, waarbij het gebruik van additieven verschillende oppervlaktekleuren aan aluminium geeft.
Oxaalzuur wordt ook gebruikt in reinigingsmiddelen voor elektronische apparaten en als coatings voor het beschermen van roestvrij staal, nikkellegeringen, chroom, gelegeerd staal en titanium.
3.2 Textielbehandeling
Oxaalzuur wordt gebruikt als beitsmiddel bij het bedrukken en verven van wol en katoen. Het wordt gebruikt als ontvettingsmiddel voor wolkleuren om speciale patrooneffecten te bereiken, als hulpmiddel bij indigo-caustische ontladingsdruk en bij kuipverven als reductiemiddel voor kaliumdichromaat.
In wasserijen wordt oxaalzuur gebruikt om roestvlekken te verwijderen en de alkaliteit te neutraliseren. Het heeft ook antibacteriële eigenschappen.
Oxaalzuur kan worden gebruikt als katalysator voor het vernetten van textielafwerkingsmiddelen bij het permanent persen van celluloseweefsels en voor vlamvertraging.
3.3 Bleekmiddelen
Oxaalzuur wordt gebruikt bij het looien en bleken van leer, en bij het bleken van kurk, hout (vooral gefineerd hout), stro, riet, veren en natuurlijke en synthetische wassen.
Het grootste deel van het oxaalzuur wordt gebruikt voor het bleken van pulphout.
Bij de leerverwerking wordt oxaalzuur gebruikt voor het bleken in plaats van natriumdithioniet.
Referentie
- Oxalic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a18_247.pub2
