Nitrobenzeen: productie, reactie en toepassingen
Nitrobenzeen is een organische chemische verbinding met de moleculaire formule C6H5NO2. Het is een lichtgele vloeistof met een kenmerkende geur die lijkt op bittere amandelen.
Inhoudsopgave
1. Fysieke eigenschappen van nitrobenzeen
Nitrobenzeen staat bekend als mirbaneolie. Het heeft de chemische formule C6H5NO2 en een molaire massa van 123,1 g/mol. Deze lichtgele vloeistof verspreidt een aroma dat doet denken aan bittere amandelen en vertoont een hoge oplosbaarheid in verschillende organische oplosmiddelen.
Het vertoont volledige mengbaarheid met benzeen in alle verhoudingen. Nitrobenzeen dient als een effectief oplosmiddel voor aluminiumchloride, waardoor het een waardevol bestanddeel is bij Friedel-Crafts-acylering en –alkylering.
De verbinding vertoont een lichte oplosbaarheid in water, namelijk ongeveer 0,19% bij 20 °C en 0,8% bij 80 °C. Bovendien is het gemakkelijk vluchtig met stoom.
Verschillende andere fysieke eigenschappen van nitrobenzeen zijn als volgt:
| Eigenschap | Waarde |
|---|---|
| smeltpunt | 5,85 °C |
| kookpunt bij 101 kPa | 210,9 °C |
| kookpunt bij 13 kPa | 139,9 °C |
| kookpunt bij 4 kPa | 108,2 °C |
| kookpunt bij 0,13 kPa | 53,1 °C |
| dichtheid (vast) | 1,344 |
| dichtheid (vloeistof) 25 °C | 1,199 |
| Viscositeit (15 °C) | 2,17 × 102 mPa · s |
| Oppervlaktespanning (20 °C) | 43,35 mN/m |
| Diëlektrische constante bij 20 °C | 35,97 |
| Diëlektrische constante bij 170 °C | 18,15 |
| Soortelijke warmte (30 °C) | 1,418 J/g |
| Latente smeltwarmte | 94,1 J/g |
| Latente verdampingswarmte | 331 J/g |
| Vlampunt (gesloten beker) | 88 °C |
| Zelfontbrandingstemperatuur | 482 °C |
| Explosiegrens in lucht (93 °C) | 1,8 vol% |
| Dampdichtheid | 4,1 |
| Breukindex (15 °C) | 1,55457 |
2. Chemische reacties van nitrobenzeen
Nitrobenzeen ondergaat verschillende chemische reacties vanwege de aanwezigheid van de nitrogroep (-NO2) die aan de benzeenring is bevestigd. De nitrogroep is een elektronenonttrekkende groep, die de reactiviteit van de benzeenring beïnvloedt.
Het onttrekt elektronendichtheid aan de ring, waardoor deze wordt gedeactiveerd voor elektrofiele aromatische substitutiereacties. Dit betekent dat de ring minder reactief is ten opzichte van de substitutie van een elektrofiel in plaats van een andere elektrofiel, zoals waterstof.
Chemische reacties met nitrobenzeen omvatten elektrofiele metasubstitutie van de aromatische ring via processen zoals nitratie, sulfonering of halogenering.
Nitrobenzeen kan fungeren als een mild oxidatiemiddel bij de synthese van verbindingen zoals chinoline en fuchsine.
Omgekeerd leidt reductie van de nitrogroep tot een divers scala aan producten, zoals weergegeven in de volgende tabel:
| Reductiemiddel | Product |
|---|---|
| Fe, Zn of Sn/HCl, H2–katalysator | aniline |
| Zn – H2O | N-fenylhydroxylamine (herschikt met zuur tot 4-aminofenol) |
| Na3AsO3 | azoxybenzeen |
| Zn – NaOH | azobenzeen, hydrazobenzeen (herschikt met zuur tot benzidine) |
| LiAlH4 | azobenzeen |
| Na2S2O3– Na3PO4 | natriumfenylsulfamaat (C6H5NHSO3Na) |
| Elektrolytische reductie | 4-aminofenol |
De primaire reductieproducten zijn nitrosobenzeen, N-fenylhydroxylamine en aniline, terwijl andere producten ontstaan door latere interacties en herrangschikkingen.
Het is essentieel om zeer specifieke reductieomstandigheden te gebruiken om zuivere producten te verkrijgen, en tussenliggende fasen, zoals nitrosobenzeen, zijn doorgaans lastig te isoleren.
3. Productie van nitrobenzeen
De traditionele batchgewijze nitratieprocedure omvat het toevoegen van gemengd zuur (salpeterzuur/zwavelzuur/water) (bestaande uit 27 – 32/56 – 60/8 – 17 gew.%) aan een lichte overmaat benzeen (om de aanwezigheid van salpeterzuur in het verbruikte zuur te voorkomen). De reactie wordt gecontroleerd op een temperatuur van 50 – 55 °C en vervolgens voltooid door verhitting tot 80 – 90 °C.
Continue processen hebben deze aanpak echter vervangen, waarbij onder vergelijkbare omstandigheden wordt gewerkt. Deze continue processen bieden een verbeterde economie en veiligheid dankzij verbeterde menging en hogere reactiesnelheden die haalbaar zijn in kleinere reactoren.
Opmerkelijk genoeg kan een continue reactor van 120 liter dezelfde hoeveelheid nitrobenzeen opleveren als een batchreactor van 6000 liter. De reactorconfiguraties variëren, maar een typisch voorbeeld is een geroerde cilindrische reactor die werkt bij 50 – 100 °C.
Het hergebruik van verbruikt zuur is belangrijk, bereikt door continue concentratie en de toevoeging van vers zuur. Dit staat in contrast met het batchgewijze hergebruikconcept, maar beide benaderingen resulteren in hetzelfde nadeel van het genereren van een equivalente hoeveelheid verbruikt zuur voor verwijdering.
Veel van de huidige productiefaciliteiten zijn pakketunits die zijn gebaseerd op jarenlange ontwerpervaring. Meissner-units, met capaciteiten tot 12 ton nitroaromaten per uur, zijn bijvoorbeeld uitgerust met stikstofafdekking voor extra veiligheid.
Purging-stappen worden toegepast op elke uitvoerstroom; dus wordt verbruikt zuur samen met binnenkomend benzeen geëxtraheerd om restnitrobenzeen en salpeterzuur te verwijderen. Ook worden restafvalgassen gewassen door een gemengde zuurlus om te voldoen aan de milieuvoorschriften.
Een andere innovatieve ontwikkeling is het pompnitratiecircuit dat door Nobel Chematur is geïntroduceerd. Dit proces maakt het mogelijk dat nitratie in de pomp zelf plaatsvindt, wat leidt tot reactietijden van minder dan een seconde vanwege intensieve menging en talloze bijbehorende voordelen.
Het concept van een adiabatisch proces dat de reactiewarmte gebruikt voor de concentratie van verbruikt zuur bestaat al sinds 1941. Het adiabatische proces van American Cyanamid, ontwikkeld in samenwerking met CLR, vormt de basis voor een van ’s werelds grootste nitrobenzeenfabrieken, met een capaciteit van 159.000 t/a.
Dit proces omvat gelijkstroomstromen van benzeen (1,1 mol per mol HNO3) en gemengd zuur (6 – 8/62 – 68/24 – 32 gew.%) die door een krachtig geroerde buisreactor gaan, met een inlaat bij 60 – 80 °C (onder het kookpunt van benzeen) en een uitlaat bij ongeveer 120 °C, wat zorgt voor een verblijftijd van ongeveer 4 minuten.
De vereiste voor veel zwakker zwavelzuur maakt zuurrecycling veel kosteneffectiever, vooral omdat de proceswarmte bijna voldoende is voor verdamping, met name onder vacuüm.
Een andere optie om de noodzaak van afzonderlijke herconcentratie van zwavelzuur te vermijden, is om de nitrering uit te voeren bij hogere temperaturen (120 – 160 °C) met overtollig water dat uit de nitrator wordt gedestilleerd als een azeotroop met benzeen.
In een duplexproces wordt de benzeenazeotroop die ontstaat uit de eerste gedeeltelijke reactie bij hoge temperatuur in een tweede fase bij lagere temperatuur gebruikt om de reactie te voltooien. Hoewel azeotrope nitrering aanzienlijke energiebesparingen oplevert, wordt het niet als zo concurrerend beschouwd als adiabatische nitrering.
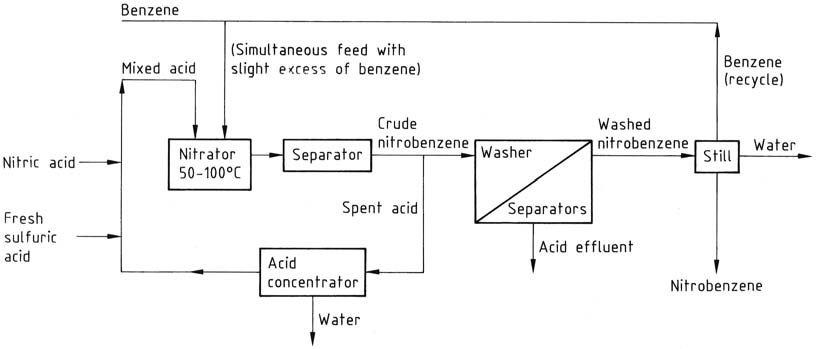
Al deze processen delen vergelijkbare opwerkingsstromen. Het reactiemengsel gaat van de nitrator naar een separator of centrifuge en het waterige verbruikte zuur wordt teruggevoerd naar de recycle-lus via een concentrator of sterkte-aanpassingsfase, indien van toepassing.
De ruwe nitrobenzeen, als bovenste laag, gaat door een reeks was-separatoren waar restzuur eerst wordt weggespoeld met verdunde alkali en vervolgens met water. Het gewassen product wordt onderworpen aan een distilleerketel om water en benzeen te verwijderen (gerecycled).
Indien nodig wordt het product uiteindelijk vacuümgedestilleerd om een zuiver product te verkrijgen met een totale opbrengst van ongeveer 96%. De wasfasen creëren een effluentprobleem, waardoor afvalwaterbehandeling noodzakelijk is, voornamelijk om nitrobenzeen te verwijderen.
In 1985 bedroeg de wereldwijde capaciteit voor nitrobenzeenproductie ongeveer 1,7 miljoen t/a, waarvan ongeveer een derde zich in West-Europa bevond en nog eens een derde in de Verenigde Staten.
4. Toepassingen van nitrobenzeen
Het gebruik van nitrobenzeen als oplosmiddel in specifieke chemische reacties speelt een kleine, maar belangrijke rol. Het grootste deel (ongeveer 95% of meer) van het geproduceerde nitrobenzeen wordt omgezet in aniline, dat dient als voorloper voor talloze downstreamproducten.
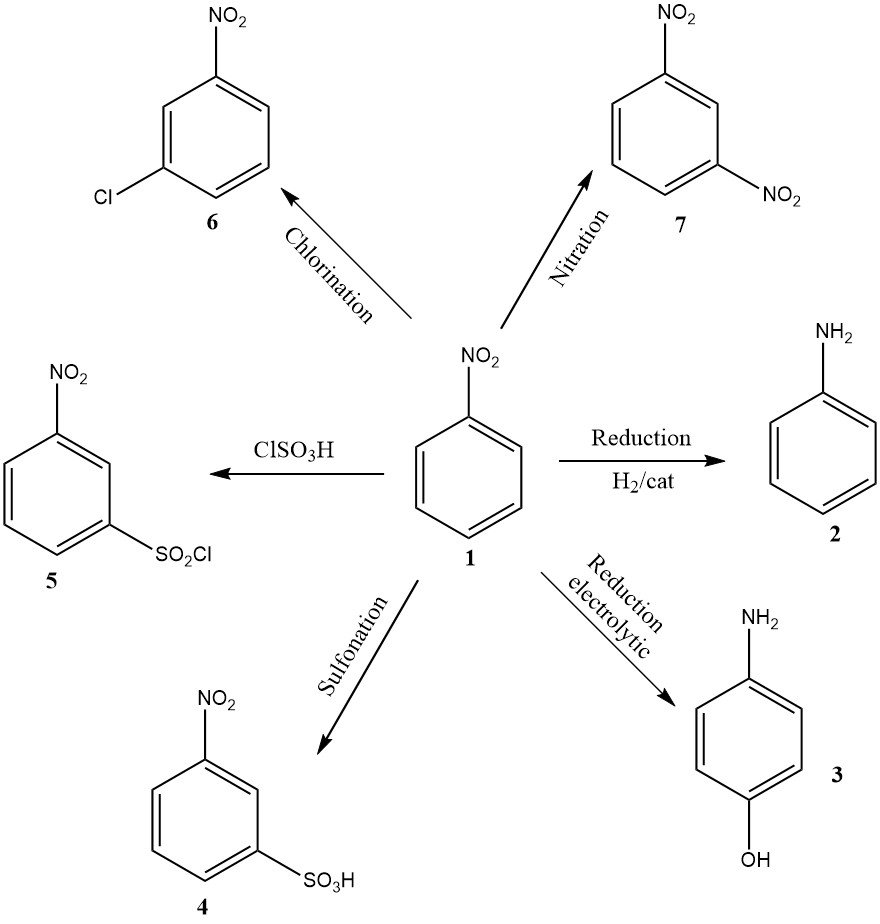
Hoewel het volume lager is, omvatten andere industrieel relevante toepassingen elektrolytische reductie om 4-aminofenol te produceren, nitrering resulterend in 1,3-dinitrobenzeen (7), chlorering resulterend in 3-chloornitrobenzeen (6), sulfonering resulterend in 3-nitrobenzeensulfonzuur (4), en chloorsulfonering resulterend in 3-nitrobenzeensulfonylchloride (5).
De laatste drie producten worden voornamelijk gebruikt als precursors voor hun reductieproducten: respectievelijk 3-chlooraniline, metanilic acid en 3-aminobenzeensulfonamide.
Aniline vindt toepassingen in de productie van urethaanpolymeren, rubberchemicaliën, pesticiden, kleurstoffen (met name azokleurstoffen), explosieven en farmaceutica. Het is een veelzijdige verbinding met een breed scala aan toepassingen in verschillende industrieën.
Naast zijn rol als anilineprecursor wordt nitrobenzeen ook gebruikt als oplosmiddel in bepaalde laboratorium- en industriële processen. Het kan worden gebruikt om verschillende stoffen op te lossen, met name stoffen die niet oplosbaar zijn in water.
De oplosbaarheid van nitrobenzeen in organische oplosmiddelen maakt het een nuttig hulpmiddel bij bepaalde experimentele procedures.
Bovendien wordt Nigrosin (C.I. Solvent Black 5) verkregen als een ruw mengsel dat ontstaat door de reactie van nitrobenzeen met aniline en anilinehydrochloride bij een temperatuur van 200 °C in aanwezigheid van ijzer of koper.
5. Toxiciteit van nitrobenzeen
Nitrobenzeen, met een drempelwaarde (TLV) van 5 mg/m³, is zeer giftig en kan leiden tot acute vergiftiging vanwege de gemakkelijke absorptie via de huid of luchtwegen.
De belangrijkste effecten van blootstelling zijn een verlaging van het hemoglobinegehalte, methemoglobinemie, cyanose en kortademigheid. Langdurige blootstelling kan leiden tot schade aan de milt en lever, geelzucht en bloedarmoede.
Het is belangrijk om op te merken dat alcoholconsumptie deze effecten kan versnellen en intensiveren. Daarom moeten er strikte en goed gedefinieerde werkomstandigheden worden vastgesteld en gehandhaafd om een goede controle en veiligheid te garanderen.
Referentie
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
